燕麦米对肥胖小鼠减肥降脂作用的研究
许 阳 胡新中,2 张 恒 李 璐 陈秋桂 任长忠
(西北农林科技大学食品科学与工程学院1,杨凌 712100)
(陕西师范大学食品工程与营养科学学院2,西安 710062)
(西麦生物技术开发有限公司3,桂林 541004)
(吉林省白城市农业科学院4,白城 137000)
近年来肥胖症的发病率不断升高,治疗费用高,但最终治疗效果不尽理想,这个公共卫生难题的存在由来已久,并严重困扰着世界范围内的很多国家[1]。2005年,世界卫生组织(WHO)发表声明:无论在发达还是发展中国家,肥胖都是全世界范围内危害公共健康的主要疾病。大量研究证实脂肪细胞是机体内部的能量储备器官,兼具类似内分泌器官的功能,当脂肪组织较多时,对很多疾病的发生和发展都起着重要的作用[2-4]。因此,开发具有高效减肥功能,且能够长期食用的食品对解决人类肥胖问题具有深远的意义。
1963年以来,很多研究都证明了燕麦中β-葡聚糖具有降低胆固醇、调节血糖和提高胰岛素敏感性、调节肝脂肪组织代谢的生理功能[5-8]。1997年,美国食品和药品管理局(FDA)声明[9]:燕麦中含有丰富的可溶性膳食纤维——β-葡聚糖,具有调节人体胆固醇功能。Rytter等[10]以燕麦为基料做汤,食用23周后受试人群体重减小了6 kg,血糖和胰岛素也得到不同程度的降低。在国内,孟昭光等[11]以高脂血症大鼠为对象,发现饲喂燕麦粉高脂饲料10 d后,燕麦能够像安妥明那样显著降低高脂血症大鼠的血清胆固醇(TC)、血清β-脂蛋白(β-LP)和血清三酰甘油(TG),且上述3者均下降30%左右。袁尔东等[12]研究发现,燕麦膳食纤维饲喂高脂模型小鼠4周后,具有非常良好的降低血清总胆固醇(TC)和三酰甘油(TG)的作用。同时,燕麦膳食纤维降低低密度胆固醇的作用也与多功能大豆纤维、纤维素和小麦纤维组间存在非常显著的差异。
燕麦米是除了燕麦片外的新型燕麦食品,是指经过打磨、灭酶后能与大米同熟且与大米消费方式类似的燕麦产品。燕麦米含有丰富的蛋白质、脂肪等营养物质,且8种人体必需氨基酸齐全,配比合理,接近于FAO/WHO推荐的营养模式,特别是赖氨酸含量很高。添加25%~35%燕麦米的混配米,其氨基酸模式评分高,营养价值优,口感好[13]。
单纯性肥胖仅由能量摄入大于能量消耗导致,并没有明确的原发疾病。本研究采用高脂饲料建立与人类肥胖最相似的单纯性肥胖模型,通过饲喂不同添加量的燕麦米,测定小鼠体重、血糖血脂、胰岛素、肝脏脂肪代谢等的变化,评价燕麦米的减肥降脂作用,旨在探索燕麦米对肥胖人群减肥降脂的作用,评价以裸燕麦为原料的中式燕麦食品对降低心血管疾病风险的意义,进而为燕麦产品开发和标准制定提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
昆明种二级雄性小鼠50只[许可证号:SCXK(军)2007-007],由第四军医大学实验动物中心提供,6~8 周龄,体重18~22 g。
1.1.2 燕麦米
吉林白城农科院培育的白燕2号燕麦品种,经过精选,碾米机打磨,常压蒸汽处理,红外灭酶(热源温度500℃)处理30 s,保温2 h后降至室温,粉碎后制粉备用[13]。
1.1.3 主要试剂
游离脂肪酸、胰岛素、肝脏三酰甘油酶联免疫试剂盒:石家庄博海生物工程开发有限公司;甲醛、二甲苯、生理盐水、酒精、苏木精、伊红、中性树脂均为分析纯。
1.1.4 主要仪器
HR-15氧弹式热量计:长沙长兴高教仪器有限公司;680酶标仪:BioRad公司;RM2235石蜡切片机:德国徕卡公司;Motic BA400光学显微镜:日本奥林巴斯显微镜公司。
1.2 试验方法
1.2.1 试验动物分组与饲喂
动物房室内温度(22±2)℃、湿度(55±5)%,50只昆明小鼠自由采食和饮水,适应性喂养普通饲料1周。之后按体重随机分为5组,每组10只。分别为普通饲料组(简称普通组);高脂饲料组(高脂组);低剂量燕麦米饲料组(简称低燕麦米组);中剂量燕麦米饲料组(简称中燕麦米组);高剂量燕麦米饲料组(简称高燕麦米组)。饲料配方与能量见表1。
除普通组外,将其余4组建立肥胖模型。根据下面公式计算肥胖度[14]:
肥胖度=(试验组实际体重-普通组平均体重)/普通组平均体重×100%
试验组包括:高脂组、低燕麦米组、中燕麦米组、高燕麦米组。当肥胖度大于20%时为肥胖,同时认为成功地建立了肥胖模型。饲喂28 d后,剔除建模不成功的小鼠,对高脂组、低燕麦米组、中燕麦米组、高燕麦米组分别饲喂相应的饲料,自由采食和饮水,于40 d后禁食12 h,处死后取血液、肝脏和脂肪组织测定相应指标(图1)。

表1 动物饲料的配方和能量
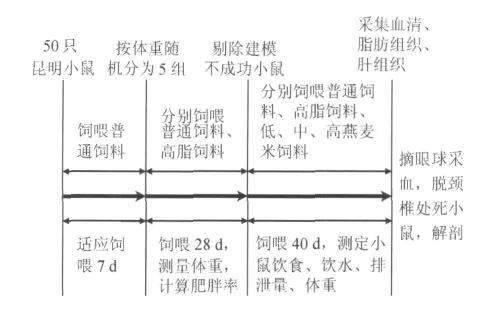
图1 动物试验及采样流程图
1.2.2 小鼠常规测定
各组小鼠均自由采食和饮水,试验期为68 d。
对各组小鼠的体重、饮水量、摄食量、排泄量进行动态监测,每5 d测定1次。
1.2.3 Lee's指数测定
记录小鼠处死前体重,测定小鼠解剖前鼻尖到肛门的长度,按照公式计算 Lee's指数[15]:Lee's指数 =[体重(g)×103/体长(cm)]1/3。
1.2.4 血液生化指标测定
待小鼠饲喂试验结束后,禁食24 h,摘眼球采血。
血液在37℃水浴锅中静置30 min后,3 000 r/min 离心15 min,分离血清[16-17],空腹血糖(FPG)和血清总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白(LDLC)、高密度脂蛋白(HDLC)送杨凌示范区医院生化检验科测定。
血清游离脂肪酸(FFA)、空腹胰岛素(FINS)采用酶联免疫试剂盒测定。
胰岛素敏感指数(ISI)[18]和胰岛素抵抗指数(IR)[19-20]取两者的自然对数值进行数据分析。

1.2.5 脂肪系数测定
小鼠解剖时,剥出全部右下腹股沟脂肪组织、生殖器周脂肪组织和双肾周脂肪组织,用万分之一天平称湿重;按下式计算脂肪系数FC:
FC=(脂肪质量/小鼠体重)×100%。
1.2.6 肝指数测定
小鼠解剖时,取出全部肝脏组织,生理盐水清洗后称重,并计算肝指数。
肝指数=肝湿重/体重×100%
1.2.7 肝脏三酰甘油测定
将肝组织取出后在-80℃储存,制备10%肝组织匀浆,采用Elisa试剂盒,检测肝匀浆三酰甘油(TG)含量。
1.2.8 肝组织切片制备与HE染色
处死动物后,取肝脏组织,立即浸泡在新鲜配制的4%中性甲醛固定液中固定,将固定好的组织进行流水冲洗、梯度酒精脱水、按标准的组织学步骤进行浸泡,包埋,6 μm 切片,烤干,脱蜡,复水,染色,脱水,封片。之后用显微镜在40、100、400倍下观察、拍照[21-22]。
1.2.9 数据处理
数据均以平均值±标准误差(Mean±SE)表示,用DPS软件进行显著性检验。
2 结果与分析
2.1 燕麦米对小鼠生长指标的影响
如表2所示,燕麦米对小鼠饮食、饮水以及排泄各有不同程度的影响。由于脂肪中能量密度非常高,长期过多食用高脂食物会引起能量摄入明显增加[23],与普通组相比,高脂组摄食、饮水量均增加,同时排泄也增加(P<0.05);3个燕麦米组的饮食、饮水、排泄与高脂组相比显著降低(P<0.05),而在摄食量和排泄量上无差异,在饮水量上随着燕麦米含量的升高而显著升高(P<0.05),可能是由于燕麦米中膳食纤维有很强的缚水作用所致。
普通组小鼠体重呈均匀增加的趋势,高脂组体重增加量较普通组高,燕麦米组体重增加幅度小,从体重增加量显著性分析结果可以看出,高脂组与普通组相比,体重增加量增加不显著(P>0.05),这是因为高脂饲料长期饲喂导致小鼠消化系统不良,随着时间的推移,高脂组的排泄量增多,因此在治疗后期,高脂组小鼠体重增量减小。与高脂组相比,燕麦米组体重增加量显著低于高脂组,并随燕麦米含量的增加而显著降低(P<0.05),这是由于膳食纤维含量随着燕麦米含量增加而增加,而前者具有减肥的功效。
高脂组的Lee's指数与普通组差异不显著,这主要是由于Lee's指数一般仅适用于谷氨酸钠(MSG)所致新生鼠肥胖模型[24]。但是,除低燕麦米组外,中燕麦米、高燕麦米组均与高脂组之间有显著性差异(P<0.05);而中、高燕麦米组之间差异不显著(P>0.05),这表明在燕麦米的剂量达到20%时,其减肥效果才开始显现,而剂量在此基础上再增加却无明显效果(表2)。

表2 燕麦米对小鼠摄食、饮水、排泄、体重以及Lee's指数的影响
2.2 燕麦米对小鼠血清指标的影响
2.2.1 燕麦米对小鼠血脂的影响
与高脂组相比,低燕麦米组中的三酰甘油显著低于高脂组(P<0.05),且与普通组差异不显著(P>0.05),高密度脂蛋白显著高于高脂组(P<0.05)。随着燕麦米加入量的增加,三酰甘油浓度略有升高,但组间差异不显著(P>0.05)。总胆固醇与低密度脂蛋白含量随着燕麦米加入量的增加而显著降低(P<0.05),并且中燕麦米组与普通组之间差异不显著(P>0.05),但高燕麦米组与中燕麦米组间差异不显著(P>0.05)。高密度脂蛋白含量随着燕麦米加入量的升高差异不显著(P>0.05)(表3)。综上分析,燕麦米加入比例20%时,其减肥效果就开始显现,并优于高燕麦米组。
但是,高脂组的总胆固醇与低密度脂蛋白含量显著低于普通组(P<0.05),原因可能是肥胖小鼠对环境刺激较敏感,在处死时体内发生应激反应所致。
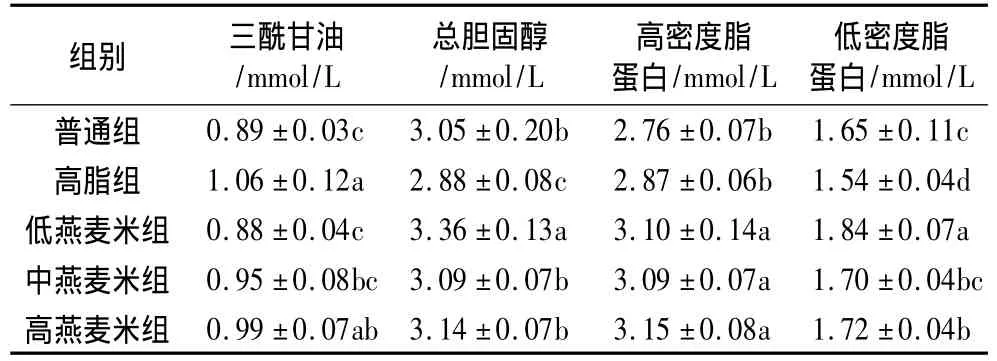
表3 燕麦米对小鼠血脂的影响
2.2.2 燕麦米对小鼠血糖、胰岛素等指标的影响
如表4所示,高脂组血糖含量与普通组相比显著升高(P<0.05),但与治疗组相比较低,主要是由于禁食对高脂组小鼠血糖的影响高过其他组。治疗组血糖浓度随着燕麦米比例的增加而降低,低燕麦米和中燕麦米组差异显著(P<0.05),而高燕麦米组与中燕麦米组间差异不显著(P>0.05)。虽然治疗组小鼠血糖降低,但仍显著高于普通组(P<0.05)。
高脂组胰岛素浓度显著高于普通组(P<0.05),这是由于肥胖导致胰岛素受体密度降低,数目减少,活性降低所致[25-26]。燕麦米组与高脂组相比,胰岛素含量显著降低(P<0.05),与普通组呈不显著差异(P >0.05)。但是,3者之间差异不显著(P >0.05)。
从胰岛素敏感指数显著性分析可得,高脂组与燕麦米组显著低于普通组(P<0.05)。但是随着燕麦米含量的增加,指数有升高的趋势(与高脂组相比),但3者差异不显著(P>0.05)。一定情况下说明小鼠在食用燕麦米饲料后,胰岛素敏感性增强。
高脂组的胰岛素抵抗指数显著高于普通组(P<0.05),这是由于肥胖者机体胰岛素超量分泌,往往存在高胰岛素血症和胰岛素抵抗。中燕麦米组和高燕麦米组胰岛素抵抗指数显著低于高脂组(P<0.05),但2 者差异不显著(P >0.05)。

表4 燕麦米对小鼠血糖、胰岛素、胰岛素敏感指数、胰岛素抵抗指数的影响
2.3 燕麦米对小鼠脂肪和肝脏的影响
2.3.1 燕麦米对小鼠脂肪系数、肝脏三酰甘油、肝系数的影响
由表5可知,高脂组的脂肪系数显著高于普通组(P<0.05),证明高脂模型建模成功。3个燕麦米组均显著低于高脂组(P<0.05),但3组之间没有显著性差异(P<0.05)。可以看出,燕麦米具有显著降低体脂肪的效果。
高脂组的肝脏三酰甘油显著高于普通组(P<0.05),低燕麦米组显著低于高脂组(P <0.05)。治疗组间有略微上升的趋势(P>0.05),可见在燕麦米的添加量在低中含量时,减肥效果较合适,剂量过大,小鼠肝脏三酰甘油含量反而升高。
高脂组的肝系数显著高于普通组(P<0.05),可见肥胖导致肝肿大,质量增加。与高脂组相比,燕麦米组肝系数显著降低(P<0.05),且随着含量增加先降低后升高,在中剂量时肝系数最小。

表5 燕麦米对小鼠脂肪系数、肝脏三酰甘油和肝系数的影响
2.3.2 肝组织HE染色
正常肝脏组织结构完整,肝小叶轮廓清晰,肝细胞围绕中央静脉呈放射状排列,纤维组织增生不明显(图2a)。高脂组肝小叶结构紊乱,肝细胞呈肝性坏死改变;纤维组织显著增生,形成纤维间隔,纤维间隔内见炎细胞浸润,呈早期肝硬化改变,脂肪细胞严重变性(图2b)。
低燕麦米组虽然也存在脂肪变性,但其明显有减缓的趋势(图2c)。再到中燕麦米组除了有少许的炎症反应外,脂肪变性基本消失(图2d)。高燕麦米组脂肪变性再次出现,这说明食用高含量的燕麦米有可能导致减肥作用的反弹(图2e)。因此,中含量燕麦米的减肥效果最佳。

图2 燕麦米对肥胖小鼠肝脏的影响(×400)
3 讨论与结论
与普通组相比,高脂组(模型组)的饮食量、饮水量、排泄量、体重、Lee's指数、血糖、三酰甘油、胰岛素、胰岛素抵抗指数、肝脏三酰甘油、脂肪系数和肝系数均显著高于普通组(P<0.05);胰岛素敏感指数显著低于普通组(P<0.05);肝细胞脂肪变性和炎症反应严重。从而证明肥胖小鼠建模成功。
燕麦中β-葡聚糖具有减肥降脂的功能[27-28],本试验从这一原理出发,根据燕麦中可溶性膳食纤维含量,设立3个不同梯度,比较不同含量燕麦米对减肥的影响。试验结果表明:3个燕麦组的饮食量和排泄量与普通组相比均无显著性差异(P>0.05),饮水量显著升高(P <0.05)。Drzikova等[29]研究发现,食用添加50%的燕麦粉或燕麦麸皮的大鼠饲料对大鼠的摄食量没有显著影响,但可以显著的增加大鼠的饮水量。与高脂组和普通组相比,体重增加量小,且随着燕麦米含量的增加而显著降低(P<0.05)。可见,加入燕麦米后,控制了体重的增加,起到了减肥的效果。除低燕麦米组外,中燕麦米、高燕麦米组的Lee's指数均与高脂组之间差异显著(P<0.05);而中、高燕麦米组之间差异不显著(P>0.05),这表明在燕麦米的剂量达到20%时,其减肥效果显著,而剂量在此基础上再增加却无明显效果(表2)。其原因可能是高剂量膳食纤维对小鼠肠道具有损伤作用,导致肠道吸收差,影响了膳食纤维减肥降脂作用的发挥。
随着燕麦米的加入,血糖与总胆固醇、低密度脂蛋白浓度均有所降低(表3,表4),这与 Davidson等[30]关于高胆固醇症患者食用燕麦片或燕麦饼干可明显降低血清LDL-C含量的结论一致。同时进一步证明:降低胆固醇含量可以明显降低高血脂症与心血管疾病的发生[9,31]。食用燕麦米显著降低了胰岛素含量和胰岛素抵抗(P<0.05),同时提高了胰岛素敏感性(P>0.05)。特别是中剂量燕麦米组,其胰岛素敏感性指数最高,胰岛素含量、胰岛素抵抗性指数最低(表4)。胰岛素分泌缺陷和胰岛素抵抗是Ⅱ型糖尿病发病机制的2个基本环节和特征,在Ⅱ型糖尿病患者中,92%的糖尿病患者有胰岛素抵抗[32]。谷物纤维可以改善肥胖者或高胰岛素患者的胰岛素水平,提高胰岛素的敏感性[33]。
小鼠的肝系数、肝脏三酰甘油含量以及脂肪系数在食用燕麦米后显著降低(表5),肝脏的组织切片结果表明,燕麦米能明显降低肝脏的脂肪变性(图2)。这与Malkki等[34]关于燕麦葡聚糖有促进肝脏脂肪代谢作用的研究相似。
不同添加量燕麦米组相比,中燕麦米组的体重、Lee's、TC、TG、LDL -C、脂肪系数、肝系数最低;HDL-C、IAI最高;肝脏脂肪变性基本得到抑制。因此,燕麦米添加量为20%时,减肥效果最明显。
[1]Eknoyan G.Obesity,diabetes,and chronic kidney disease[J].Current Diabetes Reports,2007,7(6):449 -453
[2]Pi- Sunyer X.The medical risks of obesity[J].Postgraduate Medicine,2009,121(6):21 -33
[3]Hemminki K,Li X,Sundquist J,et al.Obesity and familial obesity and risk of cancer[J].European Journal of Cancer Prevention,2011,20(5):438 -443
[4]Yang S L,Zhu L Y,Hu L Y,et al.Prospective study of the correlation between waist circumference/height ratio and type 2 diabetes[J].China Medicine,2010,5(2):127 -129
[5]Degroot A P,Luyken R,Pikoar N S.Cholesterol lower lowering effect of rolled oats[J].Lanced,1963,2:303
[6]Kelley M J,Thomas J N,Story J A.Modification of spectrum of fecal bile acids in rats by dietary fiber[J].Federation proceedings,1981,40:3497
[7]Hlebowicz J,Darwiche G,Bjorgell O,et al.Effect of muesli with 4 goat beta-glucan on postprandial blood glucose,gastric emptying and satiety in healthy subjects:a randomized crossover trial[J].Journal of the American College of Nutri-tion,2008,27(4):470 -475
[8]申瑞玲,王志瑞,董吉林,等.燕麦β-葡聚糖对高脂血症大鼠空腹和餐后脂代谢的影响[J].食品科学,2009,30(1):258-260
[9]FDA.Foodlabeling,health claim.Oats and coronary heart disease.Final rule[Z].Federal Register,1997,62(15):3584 -3601
[10]Rytter E,Erlanson - Albertsson C,Lindahl L,et al.Changes in plasma insulin,enterostatin,and lipopro - tein levels during an energy-restricted dietary regimen including a new oat- based liquid food[J].Annals of Nutrition and Metabolism,1996,40:212 -220
[11]孟昭光,刘泳泉,汪翠玲,等.燕麦对大鼠实验性高脂血症的降脂作用[J].中国药学杂志,1987,22(6):342 -343
[12]袁尔东,郑建仙.不同品种膳食纤维降血脂功能的比较[J].中国粮油学报,2002,17(3):38 -41
[13]许阳,胡新中,张恒,等.燕麦米-大米混配米饭品质评价[J].中国粮油学报,2012,27(11):14-18
[14]张莉莉.辣椒素及其受体TKPV1预防肥胖的机制研究[D].重庆:第三军医大学,2006
[15]Bunyan J.The induction of obesity in rodents by means of monosodium glutamate[J].British Journal of Nutrition,1876,35:25
[16]赵鹏,姚思宇,刘荣珍,等.γ-亚麻酸降血脂的动物实验研究[J].中国热带医学,2004,4(5):722 -723
[17]陆洁.一次性塑料试管对血清分离的影响[J].中国现代医学杂志,2000,10(11):105
[18]李光伟,潘孝仁,Lilloja S.检测人群胰岛素敏感性的一项新指数[J].中华内科学杂志,1993,33(7):656 -660
[19]Haffner S M,Gonzalez C,Miettinen H.A prospective analysis of the Homa mode1.The Mexico City diabetes study[J].Diabetes Care,1996,19:1138 -1141
[20]Haffner S M,Miettinen H,Stern M P.The homeostasis model in the San Antonio heart study[J].Diabetes Care,1997,20:1087-1092
[21]甄红敏.燕麦灭酶对大米血糖、血脂和肠道的影响[D].杨凌:西北农林科技大学,2011:37-43
[22]甄红敏,栾广忠,胡新中,等.灭酶方法对燕麦淀粉和蛋白质体外消化特性的影响[J].麦类作物学报,2011,3(3):475-479
[23]Unger R H,Orci L.Diseases of liporegulation:new perspective on obesity and related disorders[J].The Journal of the Federation of American Societies for Experimental Biology,2001,15:312 -321
[24]杜笑逸,王义明.月见草油对谷氨酸钠所致肥胖大鼠的影响中药药理与临床[J].1988,4(2):9 -13
[25]Kahn S E,Hull R L,Utzschneider K M.Mechanisms linking obesity to insulin resistance and type 2 diabetes[J].Nature,2006,444(7121):840 -846
[26]Choi K,Kim Y B.Molecular mechanism of insulin resistance in obesity and type 2 diabetes[J].The Korean Journal of Internal Medicine,2010,25(2):119 -129
[27]Jenkins D J A,Kendall C W C,Faulkner D,et al.A dietary portfolio approach to cholesterol reduction:combined effects of plant sterols,vegetable proteins,and viscous fibers in hypercholesterolemia[J].Metabolism,2002,51(12):1596 -1604
[28]Theuwissen E,Mensink R P.Simultaneous intake of beta -glucan and plant stanol esters affects lipid metabolism in slightly hypercholesterolemic subjects[J].Journal of Nutrition,2007,137(3):583 -588
[29]Drzikova B,Dongowski G,Gebhardt E.Dietary fibre - rich oat- based products affect serum lipids,microbiota,formation of short- chain fatty acids and steroids in rats[J].British Journal of Nutrition,2005,94(6):1012 -1025
[30]Davidson M H,Dugan L D,Burns J H,et al.The hypocholesterolemic effects of beta-glucan in oatmeal and oat bran.A dose - controlled study[J].The Journal of the American Medical Association,1991,265(14):1833 -1839
[31]FDA.Food labeling,health claim.Oats and coronary heart disease.Proposed rule[G].Federal Register,1996,61:216 -336
[32]Haffner S M,Agostino D R,Mvkkanen L,et al.Insulin sensitivity in subjects with type 2 diabetes[J].Diabetes Care,1999,22(4):562 -568
[33]Weickert M O,Mohlig M,Koebnick C,et al.Contibution of obesity and abdominal fat mass to risk of stroke and transient is chemicattachs[J].Stroke,2008,39(12):3145 -3151
[34]Malkki Y.Effects of oat-bran concentrate on rat serum lipids and liver fat infiltration[J].British Journal of Nutrition,1993,70(3):767 -776.

