高温压榨花生饼粕酶法制备抗氧化肽的研究
芦 鑫 朱巧梅 孙 强 张丽霞 宋国辉 黄纪念
(河南省农科院农副产品加工所1,郑州 450002)
(河南农业大学食品学院2,郑州 450002)
花生是世界重要的油料作物之一。我国是花生的生产大国,花生产量居世界首位[1]。由于花生营养丰富,且适于多种烹饪加工方式处理,所以深受我国居民的喜爱,因而我国也是花生的消费大国。目前,我国60%的花生资源用于制作花生油[2]。我国居民对浓香型花生油的嗜好性消费决定了花生制油中常有高温烘烤增香工艺,由此产生大量的高温压榨花生饼粕。
高温压榨花生饼粕中含有50%左右花生蛋白[3]。研究表明,花生蛋白营养价值高,且抗营养因子少,是优质的植物蛋白来源之一[4]。由于高温处理使花生蛋白变性造成高温压榨花生粕中蛋白难于提取利用,因此目前我国高温压榨花生饼粕主要用作饲料和肥料,造成资源浪费。蛋白经过酶解生成肽可以提高溶解性、乳化性、起泡性等功能性,此外某些肽还具有生理活性如抗氧化性、降血压、降血糖等,因此蛋白酶解制备多肽成为蛋白加工的热点[5-6]。国内外开展以花生蛋白为原料制备花生活性肽的研究,目前研究的结果表明花生活性肽多具有抗氧化活性[7-9]。但现有的研究中多以低温花生饼粕或直接从花生籽中提取花生蛋白酶解制备抗氧化肽,高温压榨花生饼粕研究较少。因此,本研究以高温压榨花生饼粕为原料提取花生蛋白,采用多种商业蛋白酶对其水解,筛选出最适制备花生活性肽的蛋白酶,并优化其水解条件,以便为高温花生饼粕的加工利用拓展新的途径。
1 材料与方法
1.1 材料与仪器
高温压榨花生饼粕[蛋白质 (54.85±0.79)%,含水量(6.53 ±0.09)%,油脂(5.63 ±0.24)%,灰分(4.90±0.16)%]:开封包公食品有限公司;碱性蛋白酶2709[酶活(225 303.48 ±22.53)U/g]、Alcalase[酶活(7 232.55 ±76.33)U/g]、木瓜蛋白酶[酶活(4 831.91 ±42.98)U/g]、菠萝蛋白酶[酶活(17 540.22 ±38.42)U/g]、胰蛋白酶[酶活(21 571.36 ±12.23)U/g]:郑州分子科贸有限公司;牛血清白蛋白、2,4,6 - 三硝基苯磺酸(TBNS)、考马斯 G250:美国sigma公司;其他试剂:国药集团化学试剂有限公司,均为分析纯。
K-05型自动定氮仪:上海晟声自动化分析仪器有限公司;Lyovac GT1冷冻真空干燥机:德国SRK系统技术有限公司;DL-5-B离心机、TGL-16A离心机:上海安亭科学仪器厂;XS205电子天平:梅特勒-托利多仪器有限公司;DF-101S集热兼磁力加热搅拌器:巩义市予华仪器有限公司;DNM-9606酶标分析仪:北京普朗新技术有限公司;UV-6300双光束紫外可见分光光度计:上海美谱达仪器有限公司。
1.2 试验方法
1.2.1 花生蛋白的提取
高温压榨花生饼粕粉碎至100目,加入到正已烷中,80~90℃加热回流3 h,滤除溶剂。称取一定量的脱脂花生饼粕粉加入到蒸馏水中,两者比例为1∶10,磁力搅拌下用1.0 mol/L NaOH 调节到pH 10.0,室温搅拌2 h,采用4 000 r/min离心20 min,收集上清液,将沉淀再次加入到相同体积蒸馏水并调节到pH 10.0,重复上述搅拌和离心操作,合并第1次和第2 次上清液,采用1.0 mol/L HCl调节到 pH 4.30,4 ℃静置30 min,4 000 r/min离心20 min,收集沉淀,并水洗至中性,冷冻干燥,粉碎至100目,得到花生蛋白。干基花生蛋白的纯度为(94.50±0.15)%。
1.2.2 酶解反应
配制一定浓度的花生蛋白溶液,用0.1 mol/L NaOH调节至所需的pH,放入集热兼磁力加热搅拌器中,使其温度到达设定值,加入一定浓度蛋白酶进行反应。水解过程中,持续搅拌并保持pH恒定,反应完毕后,采用95℃加热10 min灭酶,冷却,采用8 000 r/min离心15 min,收集上清液,取部分测定水解度和抗氧化活性,余下冷冻干燥。
1.2.3 蛋白酶筛选
结合文献和说明书,菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶、Alcalase、碱性蛋白酶2709酶解花生蛋白的条件见表1,测定上清液中的蛋白水解度和抗氧化活性。

表1 不同蛋白酶酶解花生蛋白的条件
1.2.4 蛋白酶水解工艺优化
对筛选出的工具酶,采用单因素试验确定其加酶量和花生蛋白浓度范围。考察加酶量影响时,固定酶解温度为50℃,水解时间2 h,蛋白浓度固定5%,pH 9.5,加酶量依次取 5 000、10 000、15 000、20 000、25 000 U/g蛋白。
在此基础上,找到合适的加酶量范围。花生蛋白浓度固定在5%,采用响应面继续优化酶解pH、酶解时间、酶解温度和加酶量。
1.2.5 蛋白浓度测定
酶解液中蛋白浓度测定采用考马斯亮蓝G-250,测定波长为595 nm,以牛血清白蛋白作为标准蛋白[10]。
1.2.6 水解度测定
取0.25 mL上清液加入到试管中,随后加入2 mL,0.1%的 TNBS 和2 mL,0.2 mol/L,pH 8.20 磷酸缓冲液,置于水浴锅中50℃水浴振荡60 min,水浴过程中,采用铝箔覆盖遮光。随后用4 mL 0.1 mol/L的盐酸进行终止反应,室温静置30 min,以L-亮氨酸作为标准曲线,采用340 nm测定吸光度[11]。蛋白水解度(DH)计算公式如下:

式中:h为水解物每克被裂解的肽键量/mmol/g;htot为每克原料蛋白质的总的肽键量/mmol/g。花生蛋白的 htot为 7.49 mmol/g[12]。
1.2.7 抗氧化能力的测定
参照Zainol等[13]硫氰酸铁法,并略加修改。取一定体积的上清液加入10 mL 50 mmol/L pH 7.0的磷酸缓冲液和10 mL 1.3%的亚油酸乙醇溶液,定容到25 mL,置于40℃暗室中反应10 min。从中取80 μL溶液,加入100 μL 1%的KSCN乙醇溶液和100 μL 1.3 mmol/L FeCl2乙醇溶液于酶标板中,测定波长为492 nm。抗氧化能力计算公式如下:

式中:AA为抗氧化能力;A0为空白吸光度;As为加抗氧化剂的样品吸光度。本次试验中测定抗氧化性时,蛋白浓度为5 mg/mL。
1.2.8 成分测定方法
蛋白测定采用凯氏定氮法GB 5009.5—2010,N为5.46;灰分测定采用550℃灰化法GB/T 5505—2008;水分测定采用105℃恒重法GB5512—1985;粗脂肪测定采用索氏抽提法GB/T 14772—2008。蛋白酶酶活标定采用Folin法SB/T 10317—1999。
1.2.9 数据处理
无特殊说明,所有试验平行测定3次,采用SPSS Statistics 19进行Duncan算法的单因素方差分析,SAS9.1.3进行 Box-Behnken设计的响应面分析。显著水平为0.05,高度显著水平为0.01。
2 结果与分析
2.1 蛋白酶种类对花生抗氧化肽制备的影响
蛋白酶是制备活性肽的重要因素,由于不同蛋白酶水解蛋白质作用位点不同,从而造成蛋白水解程度和多肽活性有所差异。由图1a所示,水解时间在0~3 h期间,水解度快速增加,随后水解度变化趋于平缓。其中碱性蛋白酶2709和Alcalase水解花生能力较强,菠萝蛋白酶水解能力最弱。由于采用的花生蛋白来源于高温压榨花生饼粕,该花生蛋白经过高温处理,蛋白变性伸展程度高,水解位点暴露容易被酶水解,且加酶量较高,这可能是本次试验中水解度较高的原因。由图1b所示,不同蛋白酶水解产物的抗氧化活性存在明显差异,但抗氧化活性随时间变化趋势相似,即水解时间60 min内,抗氧化活性迅速上升,随后有所下降,这与陈贵堂等[6]的研究结果一致。此外,前人研究发现采用Neutrase、As1.398中性蛋白酶水解花生蛋白可以产生抗氧化肽[7,14]。本次研究中5种蛋白酶酶解花生蛋白均可产生抗氧化肽,这表明花生蛋白适宜作为制备抗氧化肽的原料。

图1 蛋白酶种类对水解花生蛋白的DH和AA的影响
观察水解度和抗氧化活性可以发现,水解度较低时,具有抗氧化活性的多肽生成较少,则抗氧化活性较低;但水解度过高,具有抗氧化活性的肽被降解,破坏了产生抗氧化活性的基团,造成抗氧化活性降低,这可能是碱性蛋白酶2709酶解产物抗氧化活性在后续水解中有大幅下降而胰蛋白酶酶解产物抗氧化活性减低较为平缓的原因。虽然胰蛋白酶水解产物具有较强的抗氧化活性,但其成本较高,因此,选择碱性蛋白酶2709作为水解花生蛋白的工具酶。此外,通过分析水解时间对抗氧化的影响可知,要获得高活性的抗氧化肽水解时间应控制在2 h以内。
2.2 碱性蛋白酶2709加酶量对花生抗氧化肽制备的影响
由图2可知,酶解时间一定时,伴随着加酶量的增加,花生蛋白的水解度呈现上升趋势,但当加酶量大于15 000 U/g蛋白时,继续增加加酶量对花生蛋白的水解度无显著影响。这是由于适当增加蛋白酶浓度可以增加酶与底物作用位点接触机率,从而加速酶解反应的进行,但在一定体系内,花生蛋白中可以被蛋白酶作用的位点数目有限,当这些位点都参与酶解反应时,水解速度达到平衡,水解度不在随加酶量的增加而上升。观察酶解产物的抗氧化性可以发现,加酶量在5 000~10 000 U/g蛋白之间时,酶解产物的抗氧化性呈现上升趋势,继续增加加酶量反而降低了抗氧化性。这是由于在相同的酶解时间内,高加酶量的体系中,花生蛋白水解程度高于低加酶量的样品,过度的水解造成抗氧化肽的结构被破坏,导致抗氧化活性降低。考虑抗氧化性,可以将加酶量确定为5 000~15 000 U/g蛋白之间。
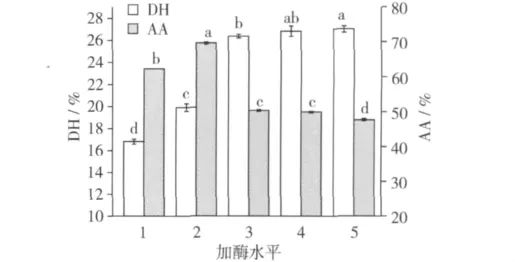
图2 碱性蛋白酶2709加酶量对花生蛋白酶解物DH和AA的影响
2.3 响应面优化酶解条件
2.3.1 酶解条件对水解度的影响
采用SAS响应面分析水解度数据(表2)发现,整个模型高度显著(P=0.000 1),这说明采用二次曲面模型适合模拟客观情况;失拟项不显著(P=0.061 7),这表明没有遗漏重要的影响因子,选取的酶解因素全面;R2=98.34%,调整 R2=96.41%,这说明响应面模型和实际结果拟合程度高。
分析影响因素,酶解pH、酶解时间和加酶量是高度显著影响因素(P<0.01),而酶解温度是非显著影响因素(P=0.148 7)。酶解温度是非显著影响因素的原因可能与酶解温度取值区间较窄有关。获得的拟合曲线如下:
水解度 =144.15 -13.99X1+1.78X2-4.04X3+4.8 × 10-4X4+0.81X12+0.19X1X2+0.03X1X3+4.2 ×10-5X1X4+0.02X22-0.9 ×10-2X2X3+0.28 ×10-3XX+0.04X2-1.1 ×10-5XX+1.85 ×10-9X42

表2 响应面优化制备抗氧化花生肽试验设计条件和结果

图3 酶解因素对花生蛋白酶解物水解度的影响
由于酶解温度是非显著影响因素,固定酶解温度为45℃,因此分析加酶量、pH和酶解时间对水解度的影响。固定酶解温度为45℃,加酶量为10 000 U/g蛋白,pH不变考察酶解时间影响时发现,伴随着酶解时间延长,花生蛋白的DH逐渐上升,但随着反应时间的增加,DH上升速度有所降低。当固定酶解时间,分析pH影响时发现,增加酶解体系的pH有利于花生蛋白DH增加,pH 10.5的酶解样品具有最高的水解度(图3a)。结果表明,由于体系pH会影响碱性蛋白酶2709在反应体系中的构象,从而带来酶活差异,从而对蛋白水解产生影响。由图3b反映加酶量和pH对花生蛋白DH的影响。当固定pH,分析加酶量影响发现,增加加酶量会提高花生蛋白的DH。
2.3.2 酶解条件对抗氧化性的影响
研究表明:酶法制备抗氧化肽受多种因素的影响,如蛋白酶种类、底物种类、酶解程度等因素影响。分析表2中的抗氧化性结果发现:模型高度显著(P=0.000 1),失拟项不显著(P=0.052 1),R2=97.06%和调整R2=93.63%,因此采用响应面模型可以真实客观的反映酶解产物的抗氧化性。
在此基础上,方差分析酶解因素发现:pH、酶解时间和加酶量是高度显著因素(P <0.01),酶解温度为非显著影响因素(P=0.619 0),获得的回归方程如下:
抗氧化性 = -1 424.27+149.56X1+109.76X2+26.76X3+0.02X4-6.62X12-5.87X1X2-0.08X1X3-1.12 ×10-3X1X4-8.33X22-0.12X2X3-2.01 ×10-3X2X4-0.28X32-1.2 ×10-5X3X4-2.38 ×10-7X42
响应面图4直观反映了pH、酶解时间、加酶量和它们交互作用对抗氧化性的影响。如图4a所示,当固定酶解温度为45℃,加酶量为10 000 U/g蛋白,pH保持不变观察酶解时间对抗氧化性的影响发现,酶解时间在1~2.1 h之间,增加酶解时间促进抗氧化性提高,继续增加酶解时间,样品抗氧化性有所降低。这是由于伴随着酶解时间延长,水解度增加,具有抗氧化活性的多肽被进一步水解,导致抗氧化性有所降低。固定酶解时间观察pH对抗氧化性的影响发现,pH从8.5增加到9.5过程中,增加pH有利于酶解样品抗氧化性的增加,而从9.5增加到10.5时,抗氧化活性有所下降。这是由于在低的pH条件下,碱性蛋白酶2709酶活较低,相同酶解时间下,花生蛋白水解程度较低,产生较少的抗氧化性肽,因此抗氧化性较低。而当处于高的pH条件下,蛋白酶酶活高,花生蛋白过度水解,抗氧活性肽的功能基团被破坏,导致活性有所下降。图4b所示,当固定pH时,增加加酶量有利于提高抗氧化性,过度添加蛋白酶会带来抗氧化性下降。这是由于加酶量较少时,水解速度较低,相同时间内,产生抗氧化性肽较少,从而抗氧化活性较低。当加酶量较高时,体系内酶浓度高,酶与蛋白底物反应位点碰撞的机率增加,水解速度快,蛋白水解程度高,抗氧化活性肽可能被进一步水解,降低抗氧化活性。

图4 酶解因素对花生蛋白酶解物抗氧化能力的影响
2.3.3 水解度与抗氧化性关系
制备抗氧化活性肽的目的在于获得高活性的酶解产物,但由于蛋白酶解反应复杂,会产生多种酶解多肽产物。因此,需要通过水解度来推测酶解产物组成和检控酶解反应的程度。为了阐述抗氧化活性与水解度二者的关系,以酶解因素为自变量,水解度和抗氧化活性为应变量,考察二者随酶解因素变化及其二者之间的联系(图5)。
由图5可知,伴随着加酶量、pH、酶解时间的增加,水解度呈上升趋势,而抗氧化活性呈现先上升后下降的趋势。水解度和抗氧化活性的关系如下:当水解度小于18%时,抗氧化活性伴随着水解度增加,当水解度处于18%至21%之间时,抗氧化活性呈现缓慢下降趋势;当水解度进一步增加,抗氧化活性呈现快速下降。在取值范围内,抗氧化性存在最大值,预测的最大值为(70.71±1.24)%,对应酶解条件为pH 9.42,酶解时间为1.98 h,酶解温度为45 ℃,加酶量为 7 883.86 U/g蛋白。该条件下,水解度为(17.56±0.60)%。结合实际情况,确定获得最高抗氧化活性的酶解条件为:酶解温度45℃,加酶量为7 885 U/g蛋白,pH 9.40,酶解时间取 1.98 h,在此条件进行水解,获得抗氧化活性肽的水解度和抗氧化活性分别为(17.44 ±0.35)%和(70.2 ±0.63)%。

图5 花生蛋白酶解物抗氧化能力与水解度关系
3 结论
本试验结果表明,以高温压榨花生饼粕为原料提取的花生蛋白经过酶法水解可以用于制备抗氧化活性肽。花生蛋白酶解产物的抗氧化能力受蛋白酶种类和酶解工艺的影响。
初步采用菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶、Alcalase和碱性蛋白酶2709水解花生蛋白分析酶解产物的抗氧化能力发现,胰蛋白酶和碱性蛋白酶2709具有较好的效果。结合生产成本考虑,选用碱性蛋白酶2709作为制备花生抗氧化肽的工具酶。
以抗氧化活性作为评价指标,采用响应面优化碱性蛋白酶2709的酶解条件发现,加酶量、pH和酶解时间是高度显著影响因素,酶解温度为非显著因素。获得最佳酶解工艺:温度45℃,加酶量7 885 U/g蛋白,pH 9.40,酶解时间取1.98 h,在此条件获得抗氧化活性肽的水解度和抗氧化活性分别为(17.44±0.35)%和(70.2±0.63)%。同时,当水解度控制在18%以下时,增加水解度有利于提高抗氧化活性,但水解度继续上升,抗氧化活性反而有所下降。
[1]姚云游,乔玉兰.花生功能成分及营养价值的研究进展[J].中国油脂,2005,30(9):31 -33
[2]徐维艳,王卫东,秦卫东.花生蛋白的制备、功能性质及应用[J].食品科学,2010,31(17):476 -479
[3]芦鑫,孙强,张丽霞,等.蛋白酶种类对酶法提取高温压榨花生饼中蛋白的影响[J].中国油脂,2012,37(6):23-27
[4]华娣,秦剑,史吕.花生水解蛋白营养价值的研究[J].中国油脂,2010,35(11):28 -32
[5]赵谋明,任娇艳.食源性生物活性肽结构特征与生理活性的研究现状与趋势[J].中国食品学报,2011,11(9):69-81
[6]张贵川,袁吕江.食源性生物活性肽的研究进展[J].中国粮油学报,2009,24(9):157 -162
[7]陈贵堂,赵立艳,丛涛,等.A lcalase蛋白酶水解花生蛋白制备抗氧化肽的研究[J].食品工业科技,2008,29(3):119-122
[8]郭兴凤,胡二坤,蒋淑华,等.花生蛋白酶水解产物抗氧化活性研究[J].中国油脂,2005,30(3):61-63
[9]陈贵堂,赵立艳,王岁楼.制备花生抗氧化肽的蛋白酶筛选研究[J].中国粮油学报,2008,23(3):164 -168
[10]余冰宾.生物化学实验指导[M].北京:清华大学出版社,2004:136-138
[11]李雪,罗永康,尤娟.草鱼鱼肉蛋白酶解物抗氧化性及功能特性研究[J].中国农业大学学报,2011,16(1):94-99
[12]梁蓉,杨瑞金,王璋.高温花生粕酶法制备低苦味多肽的研究[J].中国油脂,2008,33(5):24-28
[13]Zainol M K,Yusof S,Muse R,et al.Antioxidative activity and total phenolic compounds of leaf,root and petiole of fouraccessions of Centellaasiatica(L.)Urban[J].Food Chemistry,2003,81(4):75 -581
[14]王建化,熊柳,孙高飞,等.花生抗氧化活性肽制取工艺的研究[J].中国油脂,2008,33(6):15 -18.

