全稀释食品级单辛酸甘油酯微乳的稳定性研究
梅 子 傅玉颖 卢锦丽
(浙江工商大学食品与生物工程学院,杭州 310035)
单辛酸甘油酯是食品三大营养物之一的脂肪的中间代谢产物[1],是一种高安全性的新型高效广谱防腐剂,对革兰氏菌、霉菌、酵母均有抑制作用[2],同时,其优良的乳化性能对稳定食品形态、改善组织结构,优化制品品质有显著帮助,可广泛应用于生湿面制品(如面条、饺子皮、馄饨皮、烧麦皮)、糕点、焙烤食品馅料、表面用挂浆及肉灌肠类。但单辛酸甘油酯不溶于水,这对水分含量相对较高的食品,限制了其抑菌作用的发挥。绝大多数微生物的生存繁殖依赖于水,防腐剂须溶解或均匀分散在水相中才能有效地作用菌体,或干扰其代谢酶系统,达到抑菌或杀菌目的。
微乳能通过表面活性分子将两种互不相容相制备成热力学稳定,各向同性的均一透明的纳米级分散体系[3]。作为一种优良的载体,它能有效提高非水溶性物质在水中的溶解度,保护增溶于其中的活性物质(β-胡萝卜素,抗坏血酸VE等)抵抗外界环境破坏及一系列降解反应(氧化、消化、酶解等)[4-6],常在食品、化妆品及医药中增溶运载非水溶性活性物质[7-9]。将单辛酸甘油酯作为油相制备出食品级O/W型微乳可有效改善单辛酸甘油酯在水中的溶解状况,同时其自身的亲酯性能作用微生物细胞膜的脂双层,提高抑菌效率。但相对于其他行业,食品微乳化技术挑战性较高,出于安全角度考虑,能应用于食品的表面活性剂种类、用量极为有限。且食品加工过程中,水相稀释及各种成分添加往往会破坏微乳结构,引起微乳相变。在食品行业中,拥有水稀释能力的溶胶才具有实践价值[10],而目前缺乏具有稀释稳定性的微乳浓缩液[11]。
本试验选择食品级原料,构建可无限稀释的食品级单辛酸甘油酯微乳体系,探索稀释过程及外界因素对其稳定性变化影响,制备出能稳定应用于食品的具有抑菌特性的微乳。
1 材料与方法
1.1 材料与仪器
单辛酸甘油酯(GMC):食品级,河南正通化工有限公司;吐温80:食品级,广州汇科精细化工有限公司;无水乙醇、丙二醇、磷酸氢二钠、氯化钠:天津市永大化学试剂有限公司;柠檬酸:天津市光复科技发展有限公司;上述试剂无特殊说明外皆为分析纯。
Zatasizer Nano ZS粒度分析仪:英国马尔文公司;UV-3200PC紫外分光光度计:上海美谱达;KQ100-DE超声波清洗器:昆山市超声仪器有限公司;AR2140分析天平:美国奥豪斯仪器有限公司;DDSJ-308A电导率仪:上海精科;TGL-16M离心机:湖南湘仪;PHS-3C pH计:上海理达仪器厂。
1.2 试验方法
1.2.1 微乳制备
经过筛选试验,确定油相:单辛酸甘油酯(GMC)与丙二醇(PG)质量比2∶1,表面活性剂相:吐温80与乙醇质量比2∶1,拟三元相图见图1。固定油相与表面活性剂相质量比7∶3混合均匀,称取一定质量的微乳原液于具塞比色管中,分别用5倍,10倍,100倍质量的水相稀释,制备出T73-5,T73-10,T73-100微乳,同样方法制备微乳T82-5,T82-10,T82-100。每支比色管上下颠倒10次,超声30 min,25℃平衡24 h。
1.2.2 电导率测定
将油相、表面活性剂相按一定质量比配置微乳原液于试管中,恒温在(25±1)℃逐渐滴加水相,搅拌均匀,测定电导率随含水量的变化。
1.2.3 增溶特性[12]
Wm,某一稀释线上水相的最大量。
1.2.4 稳定性试验
粒度分析:采用Zatasizer Nano ZS粒度分析仪测定,测定前各试管微乳上下颠倒10次以混匀,记录微乳的平均粒径及粒径分布图。平行3次,测定温度与微乳贮放温度对应,粒径分布图为平衡7 d时的微乳粒径分布。
吸光值测定:用于表征微乳的浑浊状态[13],体系越浑浊,吸光值越大。吸收波长选择600 nm。
离心试验:4 000 r/min,离心20 min,观察微乳沉淀、分层及油水相分离情况。
贮藏稳定试验:25℃下存放1个月,观察有无浑浊、分层及沉淀。
2 结果与讨论
2.1 稀释对微乳的影响
水分稀释会引起微乳相行为的变化。图1中白色部分为单相区(混合液透明或半透明),黑色部分为多相区(混合液浑浊或分层),各稀释线上,最大水相增溶量Wm变化见表1。
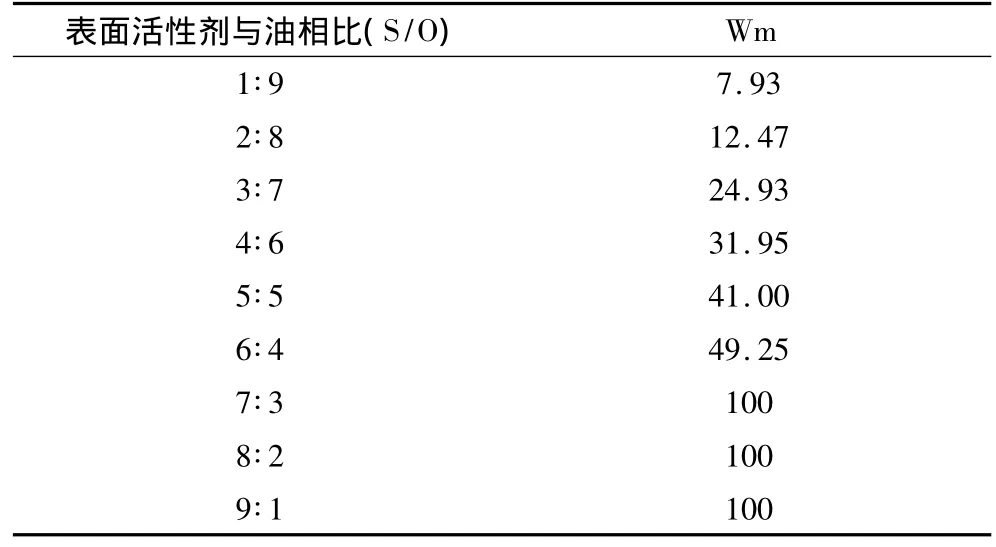
表1 微乳稀释线水相增溶量变化
随着表面活性剂相比例的增加,稀释线最大水增溶量也逐渐增大,当表面活性剂相与油相比为7∶3,8∶2 和 9∶1 时,Wm 达到 100%,即此微乳有 3 条无限稀释线,T73、T82和T91,它们分别表示表面活性剂相的质量分数为70%,80%与90%,油相质量分数为 30%,20%与 10%[14]。
2.1.1 稀释过程微乳变化
考虑到油的增溶及微乳稀释稳定性,选择T73,T82稀释线作为研究对象。

图2 电导率随含水量的变化
T73与T82电导率变化趋势相同(图2),根据电导渗滤阈值理论,T73与T82的渗滤阈值均为13%。含水量小于13%时,形成的W/O型微乳外相不易导电,体系主要靠分散水滴碰撞电导,电导率增加缓慢。以T73为例,13% <含水量<52%时,电导率呈直线上升,增加的水滴逐渐形成电导链,当含水量处于52%~68%时,初期由W/O型微乳液滴黏性碰撞产生的水相通道扩大并连接,形成网络结构,体系处于油水局部连续的过度态中间结构,即双连续相(B.C),电导率增加减缓,含水量68%时电导达到最大,完成双连续相向O/W型微乳的转变,之后水分的稀释使得电导率下降。T82微乳在含水量为47%时就开始由W/O型转变为双连续型,含水量>66%时,完成双连续型微乳向O/W型微乳的转变。T82微乳双连续型结构(B.C)形成范围(47% <含水量<66%)略大于T73微乳(52% <含水量<68%),这可能是表面活性剂比例的提高利于B.C型微乳的形成。
2.1.2 稀释对粒径的影响
通过比较不同含水量的微乳粒径变化,分析稀释对微乳稳定性的影响。

图3 稀释对微乳粒径变化影响
图3 为微乳在不同稀释梯度下,粒径随时间变化的曲线。左图测定的是用5、10、100倍质量水稀释的T73微乳25℃下分别贮藏1、7、30 d时的粒径。T73-5粒径几乎无变化,T73-10,T73-100随着时间的推移,粒径均增大,其中T73-10粒径在7~30 d之间变化明显。水分稀释减少了表面活性剂相对含量,使得单体液滴上吸附的表面活性剂量不足,不能维持满足超小尺寸纳米颗粒的超低界面张力,单体液滴易于凝结。同时,稀释可能会引起乙醇等助表面活性剂从微乳单体液滴界面分离出来,溶解到连续相中,动摇微乳微粒界面,最终破坏微乳微结构[15]。但稀释也可能会拉开微乳微粒之间的距离,减少碰撞聚合几率,造成T73-100贮藏30 d后的平均粒径小于T73-10。T82所有稀释度的微乳在贮藏期内平均粒径均保持<15 nm,具有优良的稀释稳定性。制备食品级微乳时,当油与表面活性剂结构兼容,再适当地添加多元醇(丙醇、甘油)与乙醇,即可得到水或油全稀释的微乳[16]。单辛酸甘油酯与吐温80都是双亲分子,亲油基均为脂肪酸基,单辛酸甘油酯亲水基呈线状,吐温80亲水基呈环状,他们具有良好的兼容性,当以合适比例混合时,微乳可无限稀释。
2.2 盐离子浓度对微乳的影响
选择T73-100与T82-100为研究对象,探讨盐离子浓度对微乳稳定性的影响。
以 0.1、0.2、0.3、0.6 mol/L 的 NaCl盐溶液代替双蒸水为水相,配置出不同盐离子浓度的T73-100,T82-100微乳,放置于25℃下贮藏,观察微乳表观状态,测定25℃下的粒径及600 nm下的吸光值。
一般而言,非离子表面活性剂配置的微乳,电解质能吸附与胶粒表面形成溶剂化层,使分散相与分散介质性质相同,减小两粒子间的吸引力,稳定微乳,同时电解质的加入会争夺体系中的水,引起表面活性剂“盐析”,降低增溶能力,不利于微乳稳定。图4a描述的是不同盐离子浓度的T73-100微乳在25℃下贮藏7 d的粒径分布。0.1 mol/L NaCl配置的微乳有两个主要分布峰,7~60 nm与80~800 nm,与不加盐离子的对照微乳及0.2 mol/L下的微乳粒径分布比较,20 nm左右的微粒分布较多;0.3 mol/L NaCl配置的微乳,粒径在8~200nm之间都有分布,只有1个分布峰,但主要集中分布在20 nm左右,当盐离子浓度达到0.6 mol/L时,粒径分布增宽到8~400 nm,且在100 nm左右的微粒增多。贮藏30 d时,各盐离子浓度的T73-100微乳平均粒径均有不同程度增加,其中0.1 mol/L下的平均粒径最小,0.6 mol/L的最大,见图5a。这些现象的发生可能是因为微量的盐离子能在微乳粒表面形成溶剂化层,加大微乳之间排斥力,有利于微乳稳定,但当盐离子过多时,会争夺水分子,减少溶解表面活性剂的分散剂,促进微乳粒之间聚沉,随着时间的推移,逐渐产生大颗粒。
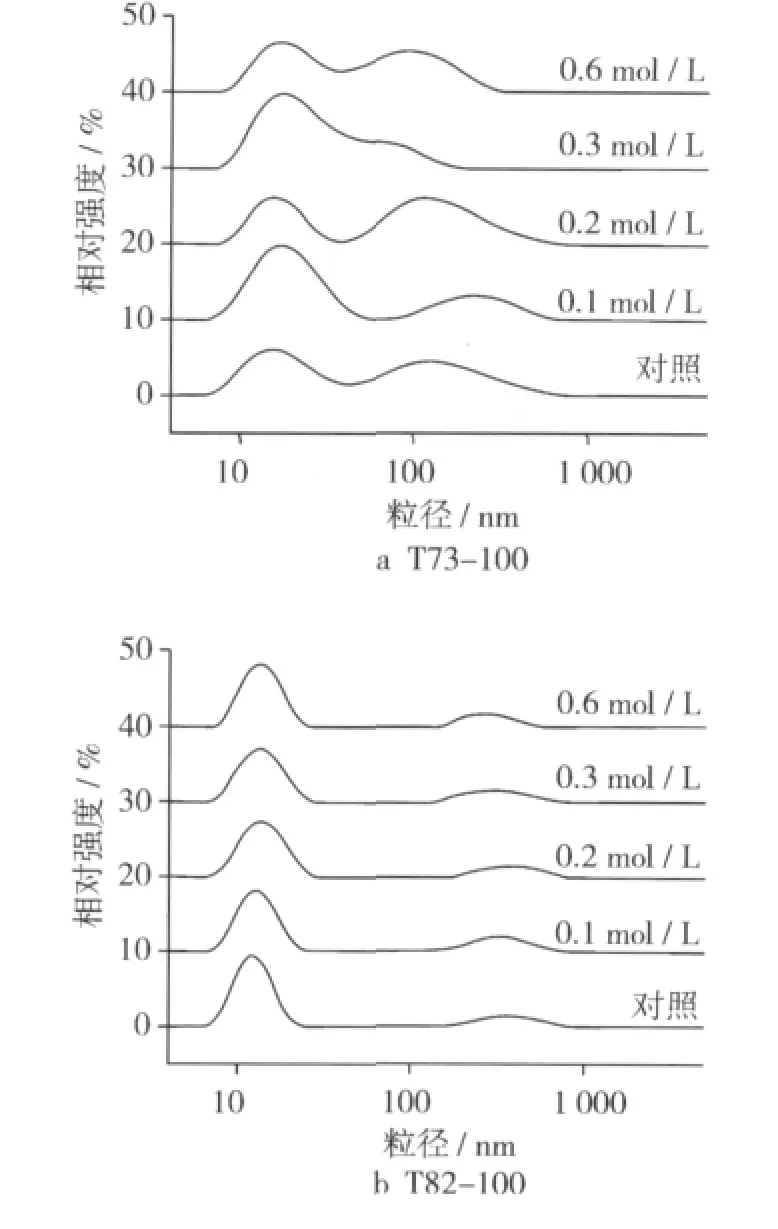
图4 各盐离子浓度下微乳粒径分布图
盐离子对T82-100微乳影响较小。在0~0.6 mol/L NaCl范围内,T82-100微乳平均粒径均小于20 nm(图5b),粒径分布于7~30 nm之间(图4b),贮藏期30 d内,平均粒径无明显变化(图5b),离心试验无沉淀及分层现象,相对于 T73-100来说,T82-100微乳具有良好的耐盐性及贮藏稳定性。

图5 不同贮藏时间下盐离子对微乳粒径及吸光值的影响
2.3 pH对微乳的影响
0.1 mol/L柠檬酸与0.2 mol/L磷酸氢二钠配置成缓冲液代替双蒸水为水相,制备出pH分别为3、5、7、8的T73-100,T82-100微乳,探讨 pH 对微乳稳定性的影响。
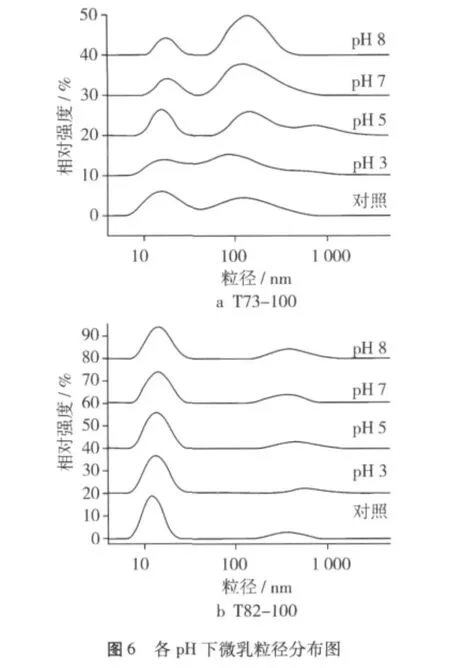

不同pH下,T73-100微乳的粒径在100~1 000 nm之间都有较多分布,且随着pH的增大,此粒径范围内的微粒逐渐增多。一方面可能是柠檬酸与磷酸氢二钠的添加,增加了体系中的电解质,改变了微乳微观结构;另一方面,配置此微乳的表面活性剂(吐温80)与油(单辛酸甘油酯)都属于酯类,酯类在酸碱条件下会发生水解反应,特别在碱性溶液中,发生的皂化反应会不可逆得生成相应的醇与羧酸盐。醇分散到水相中,单个表面活性剂的亲水基团变为COO—,亲水基团尺寸减小,亲水性相对减弱,当水解达到一定量时,会使得表面活性剂之间距离增加,减小微乳微粒之间的排斥力,发生聚合。因此对比双蒸水配置的T73-100对照微乳,各pH值下的平均粒径均有不同程度增大,pH 8时增加幅度最大。pH 3对微乳平均粒径影响最小,这可能是因为H3O+的提供,加强了非离子表面活性剂聚氧乙烯脱水山梨醇单油酸酯(吐温80)氧乙烯基团上的氧与醇分子中—OH基团结合,形成稳定的氢键,加强微乳液的液膜强度,有利于稳定[17]。
在不同pH下,T82-100微乳均集中分布在5~50 nm之间(图6b),且在30 d贮藏期内,平均粒径及浑浊度变化不明显(图7b)。T82-100在pH 3~8范围内,具有较高的稳定性。
2.4 温度对微乳的影响
选择0、25、40℃,3个温度梯度为变化因素,将配制好的T73-100,T82-100微乳贮藏在对应温度下,观察表观性状变化,并定期测定相应温度下的粒径及吸光值。
在图8中,各温度下T73-100微乳粒径分布中发现,0℃时,微乳粒径大部分分布在 >100 nm,尤其>1 000 nm的微粒数量比对照组(25℃)增多明显,微乳贮藏30 d后有白色沉淀产生。这可能是因为低温使布朗运动减弱,不利于分散,导致微粒聚沉;而40℃时,微乳颗粒平均粒径增大,保持在100 nm左右,外观呈均一半透明,有淡蓝色乳光。这也许是在低于吐温80相转变温度65℃时,温度的提高会减小界面张力,增加微粒之间的有效碰撞概率,导致粒径变大。但此微乳在40℃下贮藏30 d后,粒径依旧分布在100 nm左右,引起此现象的原因,及是否可逆,有待进一步研究。
温度对T82-100微乳粒径分布影响不大,均主要分布在5~30 nm之间,0℃低温导致粒径>100 nm的微粒稍微增多,贮藏30 d后的平均粒径增大到34 nm(图9),表观性状及吸光值改变不明显。但40℃下,T82-100微乳几乎无变化,具有较好的稳定性。


3 结论
以单辛酸甘油酯,丙二醇质量比2∶1为油相;吐温80,乙醇质量比2∶1为表面活性剂相;双蒸水为水相制备出具有3条高稀释通道的食品级微乳。选择T73与T82稀释线为对象,通过电导率测定,确定了T73及T82微乳的相行为变化,发现表面活性剂比例的提高能扩大B.C型微乳形成范围。用5、10、100倍质量双蒸水稀释T73及T82微乳的研究中发现,稀释是导致微乳不稳定性的重要因素之一,随着水分添加,T73微乳平均粒径增大,且贮藏不稳定。但对T82 微乳影响不明显。以 0.1、0.2、0.3、0.6 mol/L NaCl溶液,pH 为3、5、7、8的柠檬酸 -磷酸氢二钠缓冲溶液为水相,探讨盐离子浓度、pH对T73-100及T82-100微乳稳定性影响。盐离子对非离子表面活性剂制备的微乳影响较小,少量的盐离子有利于微乳的稳定,较高浓度时会导致大粒径微粒增多;pH会引起微乳粒径向右分布,尤其是碱性条件,当pH为8时,T73-100微乳粒径在>100 nm有较多分布,表观性状也明显发生变化。但对于T82-100微乳,NaCl浓度在0.1 ~0.6 mol/L,pH 在3 ~8 之间粒径分布无明显变化,平均粒径均小于29 nm,吸光值<0.015,具有较好的贮藏稳定性。0、40℃均会影响T73-100微乳的稳定性,40℃下贮藏7 d,T73-100微乳呈良好的均一半透明状且具有乳光现象,粒径均匀分布在100 nm左右,30 d后,此现象依旧,粒径分布变化不大。T82-100微乳在0~40℃范围内稳定性较好。本试验采用食品级原料制备的单辛酸甘油酯抑菌性T82微乳不仅稀释稳定性强,且具有较好的耐盐离子、pH及温度特性,整个试验中均保持均一透明的稳定状态。选择合适的表面活性剂、助表面活性剂及恰当比例,能制备出全稀释的稳定微乳,这对扩大微乳在食品中的应用提供可能。
[1]修祥菊,郑尚基,刘春宪,等.新型防腐剂单辛酸甘油酯在食品中的应用[J].中国食品添加剂,1997,(4):29-32
[2]张春鸣,赵文秀,陈峰,等.单辛酸甘油酯的酶法合成[J].食品科学,2007,28(11):360 -364
[3]Leung R,Shah D O.Solubilization and phase equilibria of water-in-oil microemulsionsⅠ.effects of spontaneous curvature and elasticity of interfacial films[J].Journal of Colloid and Interface Science,1987,120(2):320 -329
[4]颜秀花,王正武,王建磊,等.β-胡萝卜素微乳液的制备及其稳定性研究[J].化学通报,2007,70(1):67 -72
[5]Pakpayat N,Nielloud F,Fortuné R,et al.Formulation of ascorbic acid microemulsions with alkyl polyglycosides[J].European Journal of Pharmaceutics and Biopharmaceutics,2009,72(2):444-452
[6]Chiu Y C,Yang W L.Preparation of vitamin E microemulsion possessing high resistance to oxidation in air[J].Colloids and Surfaces,1992,63(3 -4):311 -322
[7]Moreno M A,Frutos P,Ballesteros M P,et al.Release of nortriptyline hydrochloride from oil - water microemulsions[J].Chemical and Pharmaceutical Bulletin,2000,48(11):1623 -1627
[8]Ktistis G,Niopas I.A study on the In - vitro percutaneous absorption of propranolol from disperse systems[J].Jouranl of Pharmacy and Pharmacology,1998,50(4):413 -418
[9]Trotta M,Gallarate M,Pattarino F,et al.Investigation of the phase behaviour of systems containing lecithin and 2-acyl lysolecithin derivatives[J].International Journal of Pharmacentics,1999,190(1):83 -89
[10]Spernath A,Yaghmur A,Aserin A,et al.Food - grade microemulsions based on nonionic emulsifiers:media to enhance lycopene solubilization[J].Journal of Agricultural and Food Chemistry,2002,50(23):6917 -6922
[11]Spernath A,Aserin A,Garti N.Fully dilutable microemulsions embedded with phospholipids and stabilized by shortchain organic acids and polyols[J].Journal of Colloid and Interface Science,2006,299(2):900 -909
[12]Garti N,Aserin A,Ezrahi S,et al.Water solubilization and chain length compatibility in nonionic microemulsions[J].Journal of Colloid and Interface Science,1995,169(2):428-436
[13]Rao J J,McClements D J.Food - grade microemulsions,nanoemulsions and emulsions:fabrication from sucrose monopalmitate & lemon oil[J].Food Hydrocolloids,2011,25(6):1413-1423
[14]Garti N,Spernath A,Aserin A,et al.Nano - sized self- assemblies of nonionic surfactants as solubilization reservoirs and microreactors for food systems[J].Soft Matter,2005,(3):206-218
[15]Flanagan J,Singh H.Microemulsions:a potential delivery system for bioactives in food[J].Critical Reviews in Food Science and Nutrition,2006,46(3):221 -237
[16]Yaghmur A,Aserin A,Garti N.Phase behavior of microemulsions based on food-grade nonionic surfactants:effect of polyols and short- chain alcohols[J].Colloids and Surfaces A:Physicochemical and Engineering,2002,209(1):71-81
[17]孙华.氰戊菊酯微乳液形成过程的研究[D].泰安:山东农业大学,2005.

