大豆蛋白酶解肽蛋白Tricine-SDS-PAGE分离体系的建立
黄 薇 宋永康 余 华 田宝玉
(福建省农业科学院中心实验室福建省精密仪器农业测试重点实验室1,福州 350003)
(福建师范大学生命科学学院工业微生物教育部工程研究中心2,福州 350108)
利用生物催化技术将低值的蛋白源转化成多肽、寡肽等高值蛋白原料的方法是目前大豆蛋白开发利用的新方法[1]。大豆蛋白水解后,形成各种不同分子质量大小的多肽,研究表明蛋白水解物的营养价值和功能特性与肽段的分子质量大小密切相关[2-4]。同时在水解生成的多肽混合物中,分子质量分布可以反应蛋白质的水解程度、多肽的分子质量以及多肽含量分布。因此,建立一种能快速测定大豆蛋白酶解产物中多肽分子质量分布的方法具有十分重要的意义。
聚丙烯酰胺凝胶电泳(SDS-PAGE)是测定蛋白质分子质量最常用的方法。但常规Tris-Glycine-SDS-PAGE电泳分析分辨大分子物质的分子质量范围在10~200 ku,对小于10 ku的小分子多肽分辨率低,常出现条带扩散丢失、无色带等问题。Sch gger[5]应用三(羟甲基)甲基甘氨酸(Tricine)代替甘氨酸作为终止离子,能够有效分离小分子蛋白、多肽。但近年来文献报道,使用Tricine-SDS-PAGE分离小分子肽的样品多为低分子质量蛋白质标准品或者小分子蛋白[6-9],而对酶解产物小分子肽蛋白的分离鲜见报道。在分离大豆酶解产物的实际操作中发现,Tricine-SDS-PAGE分离效果与样品上样量、凝胶系统、缓冲液系统以及染色方法等密切相关。试验对大豆酶解肽蛋白Tricine-SDS-PAGE分离的主要影响条件进行优化,旨在建立一种效果理想、简便灵敏的适合检测大豆酶解产物分子质量分布的分离体系,为提高大豆酶解技术水平以及深入研究特定分子质量大豆多肽的生理活性与功能特性提供技术方法。
1 材料与方法
1.1 试剂与设备
1.1.1 主要试剂
大豆分离蛋白(蛋白质质量分数83.29%):福州科汇生物技术有限公司;Alcalase碱性蛋白酶、Protamex复合蛋白酶、Flavourzyme风味蛋白酶:丹麦Novozymes公司;Protex.7L细菌中性蛋白酶:杰能科(中国)生物工程有限公司;胰蛋白酶:美国 Aeresco公司;木瓜蛋白酶:福州福科公司;40%(质量体积比)Acryl/Bis(29∶1)溶液、40%(质量体积比)Acryl/Bis(19∶1)溶液、三羟甲基氨基甘氨酸(Tricine)、过硫酸胺、尿素、Tris碱、十二烷基磺酸钠(SDS)、二硫苏糖醇(DTT)、TEMED、溴酚蓝、考马斯亮蓝 G250、考马斯亮蓝R250:上海生物工程有限责任公司;低分子质量蛋白标准品:美国 Thermo公司;对苯二甲醛(OPA)、氢氧化钠、盐酸、戊二醛、甘油、乙二醇等其他常用试剂:国药集团化学试剂有限公司。
1.1.2 仪器
Kjeltec 2300自动定氮仪:瑞典Foss有限公司;U-3900紫外分光光度计:日本Hitachi公司;PHS-3C pH酸度计:上海精密科学仪器有限公司;Mini-PROTEAN 3电泳系统:美国Biorad公司;Avanti-J25高速离心机:美国BACKMAN公司;MilliQ-Water纯水仪:美国Millipore公司;TS-1型脱色摇床:江苏海门市其林贝尔仪器有限公司。
1.1.3 溶液配制
10 ×电泳缓冲液:1 mol/L Tris,1 mol/L Tricine,1%SDS,pH 8.3。3 × 凝胶缓冲液:3 mol/L Tris,1 mol/L HCl,0.3%SDS。2 × 上样缓冲液 1:60%甘油,4%SDS,0.2% 溴酚蓝,3%DTT。2 × 上样缓冲液2:40% 甘油,4%SDS,0.2% 溴酚蓝,3%DTT。2×上样缓冲液3:20%甘油,4%SDS,0.2%溴酚蓝,3%DTT。固定液:5%戊二醛。考马斯亮蓝R-250染色液:0.1%考马斯亮蓝R-250,25%异丙醇,10%冰醋酸。考马斯亮蓝G-250染色液:0.1%考马斯亮蓝 G-250,25%异丙醇,10%冰醋酸。脱色液:10%冰醋酸,5%乙醇。
1.2 方法
1.2.1 大豆蛋白酶解液的制备
称取大豆分离蛋白1 g,按1∶50固液比加入蒸馏水,用1.0 mol/L NaOH 或1.0 mol/L HCl调 pH 至酶反应最适pH,按加酶量3 000 U/g加入蛋白酶、置于酶的最适温度下水解30 min后,酶解液置于沸水浴中灭酶10 min,离心取上清液,保存在4℃待分析用。大豆酶解肽电泳分离条件的建立采用Alcalase酶解大豆蛋白液。本试验所选用的蛋白酶及其性质见表1。

表1 试验所选蛋白酶的性质
1.2.2 水解度的测定
水解度(DH,Degree of Hydrolysis)的定义是指蛋白质水解过程中,被断裂的肽键数h(mmol/g蛋白质)与给定蛋白质的总肽键数htot(mmol/g蛋白质)之比。水解度的测定方法采用邻苯二甲醛(OPA)法[10]。
1.2.3 蛋白质含量测定
蛋白质含量依据GB/T 5009.5—2010微量凯氏定氮法,采用Foss Kjeltec 2300自动凯氏定氮仪进行测定。
1.2.4 Tricine-SDS - PAGE
依据郭尧君[11]的方法,按表2给出的数据灌制分离胶和浓缩胶,加入1×电泳缓冲液,上样,200 V电泳约2 h,电泳结束后,用双蒸水把胶面洗净,置于新鲜配制的5%戊二醛溶液中固定30 min,然后用双蒸水洗净胶面5 min,置于染色液中水浴60℃染色15 min,再置于脱色液中水浴60℃脱色,脱色后的凝胶用凝胶成像及分析系统拍照并分析。
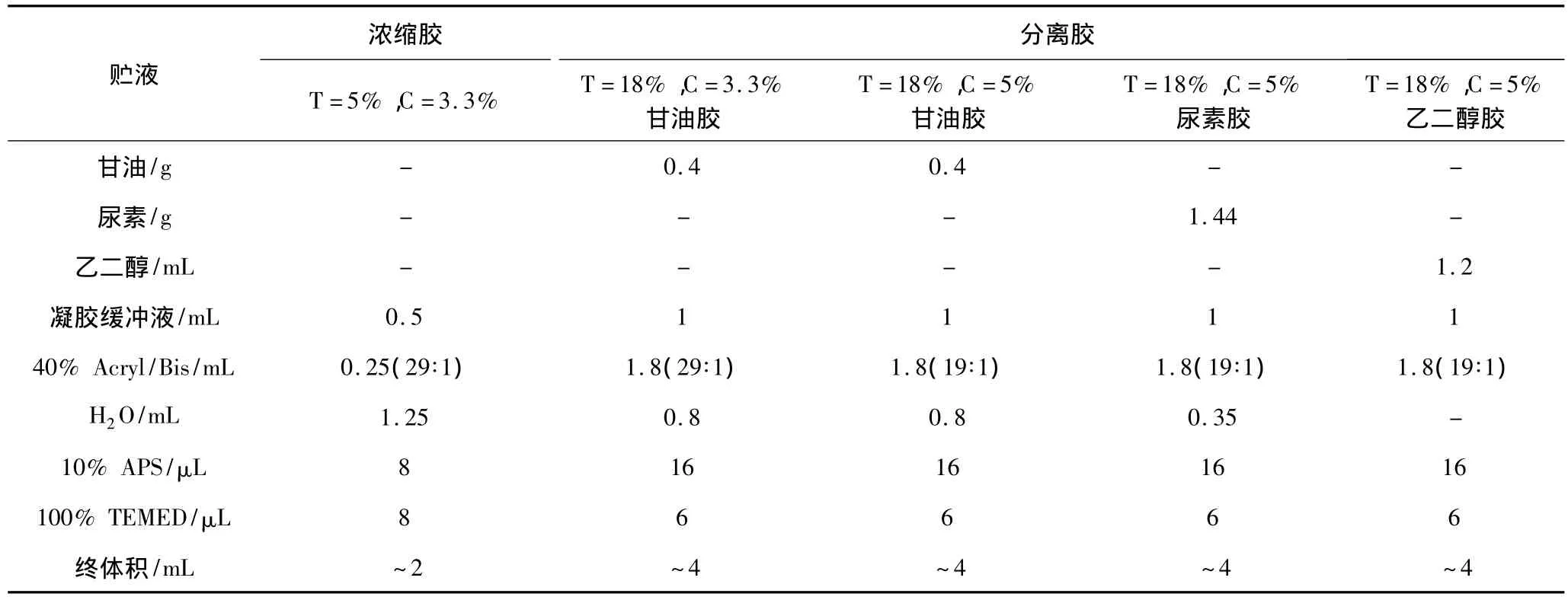
表2 胶的配制
2 结果与分析
2.1 大豆蛋白酶解产物的水解度及可溶性蛋白含量分析
对不同蛋白酶水解大豆分离蛋白所得酶解液的水解度和可溶性蛋白含量进行分析,结果见表3。试验数据进行差异显著性检验表明,不同蛋白酶的水解大豆分离蛋白的能力还是有显著差异的。水解30 min,水解度最高的为 Protamex,达到 17.65%,其次是胰蛋白酶(16.95%)>风味蛋白酶(15.85%)>Protex.7L(15.39%)> 木瓜蛋白酶(15.16%)>Alcalase(14.69%)。酶解液中可溶性蛋白含量最高的是胰蛋白酶(20.61 mg/mL),其次是Flavourzyme(19.22 mg/mL)> Protamex(18.65 mg/mL)> Protex.7L(18.43%)>Alcalase(12.47%)>木瓜蛋白酶(12.41%)。考虑到Alcalase为来自微生物的内切蛋白酶,作用位点广泛,因而采用Alcalase酶解液来建立大豆酶解肽Tricine-SDS-PAGE的分离条件。

表3 不同蛋白酶酶解产物的多肽得率
2.2 不同凝胶系统对分离效果的影响
为了达到理想的分离效果,本试验用4种不同凝胶系统对大豆酶解液的分离效果进行比较分析。结果表明,这4种不同组成的凝胶电泳基本上都能分离分子质量4.6 ku以上的蛋白质标准品和10 ku以上的大豆多肽,但分离1.7 ku的低分子质量蛋白质标准品和10 ku以下的大豆多肽时,电泳图谱不尽相同。从图1a~图1b中可以看出,交联度为5%时的分离酸能够使凝胶分子结构更致密,更有利于小分子肽的分离,带型更清晰。甘油胶(图1a~图1b)不能分离1.7 ku的低分子质量蛋白质标准品和10 ku以下的大豆多肽;尿素胶(图1c)能改善小分子的分离效果,但4.6 ku与1.7 ku的低分子质量蛋白质标准品条带紧靠,不能完全分离,且对10 ku以下的大豆多肽分离效果欠佳;乙二醇胶(图1d)分离1.7 ku的效果很好,并可以分离分子质量低至1.7 ku的大豆多肽。

图1 不同凝胶系统的Tricine-SDS-PAGE图谱比较
2.3 不同上样缓冲液对分离效果的影响
合适的电泳缓冲液能保持蛋白质在电泳系统中的溶解性能和稳定性能[12]。在试验中发现,大豆多肽在上样缓冲液甘油质量分数少于30%时,跑出的蛋白电泳条带带型两头偏下,中间偏高,且带型模糊,成皱眉现象(如图2所示)。这可能是由于大豆蛋白酶解肽的密度较小,不易下沉,容易扩散。

图2 不同上样缓冲液的Tricine-SDS-PAGE图谱比较
2.4 不同上样量对分离效果的影响
电泳的分辨率是有限的,上样量过高易造成水平拖尾并出现过饱和现象,过低则导致一些低丰度的蛋白质不能被检测到,所以选择合适的上样量很重要。本研究选择了20、30、40和50 μg 4个不同的上样量。从Tricine-SDS-PAGE图谱的分离效果来看,20 μg 上样量优于 30、40 和 50 μg。当上样量超过20 μg时,出现挤压泳道,浓缩不完全,条带模糊,出现严重拖尾现象,甚至严重影响相邻泳道的分离。因此,对于大豆蛋白酶解肽Tricine-SDS-PAGE,上样量在20 μg较合适。

图3 不同上样量的Tricine-SDS-PAGE图谱比较
2.5 不同染色方法对分离效果的影响
在蛋白染色方法中,目前以考马斯亮蓝染色最为常用。本试验采用考马斯亮蓝R-250和考马斯亮蓝G-250 2种染色方案对大豆酶解肽Tricine-SDS-PAGE电泳结果进行了染色(图4)。从图4可以看出,考马斯亮蓝R-250染料对分子质量大的多肽结合力较强,而对小分子多肽的结合力较弱,易扩散冲洗掉而着色较差;而考马斯亮蓝G-250染料对小分子多肽的结合力较强,能够提高大豆小分子多肽电泳的分辨率,小分子蛋白带更为清晰。

图4 不同染色方法的Tricine-SDS-PAGE图谱比较
2.6 不同蛋白酶酶解液的Tricine-SDS-PAGE电泳分析
不同的蛋白酶由于酶切作用方式及酶切位点的不同,导致所得酶解产物的营养成分组成包括肽段的分子质量大小和游离氨基酸的组成都有很大的差异,直接影响产品的营养价值和风味的好坏[13]。本试验采用 Alcalase、胰蛋白酶、Protamex、Flavourzyme、Protex.7L、木瓜蛋白酶等6种蛋白酶对大豆蛋白进行酶解,并用改进的Tricine-SDS-PAGE电泳对各蛋白酶酶解物进行分离,结果见图5。从图5中可以清晰直观地看出各蛋白酶酶解产物的分子质量分布,胰蛋白酶和Flavourzyme酶解产物以分子质量大于17 ku的片段为主;Protamex与Protex.7L的酶解情况相似,酶解产物主要以26~17 ku的片段为主;木瓜蛋白酶的酶解产物以分子质量小于10 ku的肽段为最多;Alcalase酶解产物均匀分布在26~4.6 ku之间。从蛋白质分离的效果来看,本试验所获得Tricine-SDS-PAGE电泳图谱背景浅、分辨率高,蛋白条带清晰,但Alcalase以外的其他蛋白酶酶解产物也出现竖向条纹、拖尾、蛋白带偏斜等问题,这需要进一步根据具体蛋白酶酶解产物的特性,对电泳条件稍加优化。

图5 不同蛋白酶酶解产物的Tricine-SDS-PAGE图谱分析
3 讨论
随着多肽生物活性和功能特性的发现,使得小分子多肽的分离、纯化和鉴定变得越来越重要。Tricine-SDS-PAGE与其他分离技术相比,其所需仪器简单、操作方便、重现性好、经济、时间短,能为小分子蛋白质、多肽的研究提供极大方便[14-15]。但分离效果与凝胶浓度、凝胶体系、缓冲液浓度、上样量以及染色方法等诸多因素密切相关。本试验在前人的研究基础上,对影响大豆多肽分离的主要电泳条件进行摸索,建立了较理想的大豆蛋白酶解肽Tricine-SDS-PAGE分离技术。前人研究显示,甘油或尿素能增大丙烯酰胺和甲叉双丙烯酰胺的交联度,改善小分子的分离效果[6,16]。试验中,发现在分离胶中加入30%的乙二醇比加入甘油或尿素更有利于小分子大豆肽的分离,带型更清晰。大豆小分子肽密度较小,不易下沉,容易扩散,当上样缓冲液中甘油含量少于30%时,带型成皱眉现象(图1),因此在后续的研究中选择含30%甘油的上样缓冲液。对于酶解产物分离来说,上样量至关重要,偏低造成低丰度蛋白难以在胶上呈现,偏高又容易出现过饱和现象。经过反复尝试,20 μg的上样量是比较合适的,上样量仅增加10 μg,就会出现浓缩不完全,条带模糊等现象。由于小分子多肽对染料的结合力较弱,因此选择合适的染色方法是必要的。通过比较研究,考马斯亮蓝G-250染色方法比考马斯亮蓝R-250更有利于小分子多肽的显色,这与Westermeier[17]的研究一致,而与姚瑶[18]建立的低分子多肽电泳体系X-尿素-PAGE体系结论不一致,这可能与其在分离胶中添加新的阴离子表面活性剂X有关。此外,本试验通过先固定后染色,并在染色和脱色过程中使用60℃水浴,以加快染色和脱色的过程[19]。这一方面可以提高染料与小肽的结合并减少小肽扩散丢失;另一方面可以避免凝胶长时间浸泡导致凝胶肿胀变形,蛋白带扭曲变形。
4 结论
从多肽的分离效果来看,改进的Tricine-SDSPAGE系统:分离胶凝胶质量分数为18%、交联度为5%并加入30%(体积分数)乙二醇,上样缓冲液含30%甘油,上样量为20 μg,染色方法采用考马斯亮蓝G-250染色法,能显著提高大豆低分子多肽电泳的分辨率。同时通过改进的Tricine-SDS-PAGE电泳技术能够获得较高分辨率的大豆蛋白不同蛋白酶酶解肽电泳图谱。大豆蛋白经蛋白酶水解后,产生许多分子链长度不等的多肽。不同功能性,生理活性肽分布于不同分子质量段,并且肽段的分子质量大小和氨基酸组成会直接影响蛋白水解物的营养价值。本试验建立的大豆蛋白酶解肽Tricine-SDS-PAGE体系能快速、精确、直观的检测酶解产物的分子质量分布,可以为评价大豆蛋白酶解产物的营养价值以及提高大豆蛋白的生物催化技术水平提供参考依据。
[1]李善仁,陈济琛,胡开辉,等.大豆肽的研究进展[J].中国粮油学报,2009,24(7):142 -147
[2]邓成萍,薛文通,孙晓琳,等.不同分子量段大豆多肽功能特性的研究[J].食品科学,2006,27(5):109-112
[3]吕方,米沙,王士贤,等.酶法制备大豆多肽的分子量分布和抑瘤实验观察[J].营养学报,2008,30(3):273-276
[4]孙强,黄纪念,芦鑫,等.大豆多肽的降压活性及其相对分子质量分布研究[J].中国食物与营养,2012,18(9):36-39
[5]Sch gger H.Tricine - SDS - PAGE[J].Nature protocols,2006(1):16-22
[6]Haider S R,Reid H J,Sharp B L.Tricine - SDS - PAGE[J].Methods in Molecular Biology,2012,869:81 -91
[7]Huang Y J,Deng K F,Xuan C,et al,.Comparison of protein profiles between acetonitrile and non-acetonitrile-treated sera from patients with nasopharyngeal carcinomas[J].Oncology Letters,2011,2(3):477 - 481
[8]Nowack E C,Grossman A R.Trafficking of protein into the recently established photosynthetic organelles of Paulinella chromatophora[J].Proceedings of the Nation United States of America,2012,109(14):5340 -5345
[9]韦霄,何敏,农炳金,等.人血清中小分子蛋白质分离电泳方法改进[J].中国公共卫生,2007,23(4):424 -426
[10]Nielsen P M,Petersen D,Dambmann C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66:642 -646
[11]郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2005
[12]Sch gger H,Jagow G.Tricine - sodium dodecy sulfate -polyacry-lamide gel electrophoresis for the separation of proteins in the range from l to 100 KDa[J].Analytical Biochemistry,1987,166(2):368 -397
[13]胡文婷,张凯.酶解海洋生物源蛋白制备活性肽研究进展[J].海洋科学,2010,34(5):83-88
[14]Hames B D.Gel electrophoresis of proteins[M].Oxford U-niversity Press,New York,1998
[15]Haider S R,Reid H J,Sharp B L.Modification of tricine -SDS-PAGE for online and offline analysis of phosphoproteins by ICP - MS[J].Analytical and Bioanalytical chemistry,2010,397:655 -664
[16]Kyte J,Rodriguez H.A discontinuous electrophoretic system for separating peptides on polyacrylamide gels[J].Analytical Biochemistry,1983,133,515 -522
[17]Westermeier R.Electrophoresis in practice:A guide to theory and practice[M].Weinheim:Wiley - VCH press,1993
[18]姚瑶.新的低分子多肽电泳体系X-尿素-PAGE体系的建立及应用[D].山东大学,2006
[19]Kurien B T,Scofield R H.Accelerated Coomassie Blue staining and destaining of SDS-PAGE gels with application of heat[J].Methods in Molecular Biology,2012,869:471 -479.

