文冠果壳黄酮提取物抑制酪氨酸酶活性的研究
张洪梅 耿 杰 周泉城
(山东理工大学农业工程与食品科学学院,淄博 255049)
文冠果是我国特有的优良珍贵木本油料作物,在生物柴油开发、水土保持、新木材培植以及植物观赏领域等各方面,都有极大的开发价值[1]。近年来,由于其较高的工业、营养价值,越来越受到人们的关注。如今我国种有大量的文冠木,种仁多用于制取生物柴油,而果壳作为废弃物未曾得到合理的利用。研究表明,文冠果果壳中含有脂肪酸、皂苷、甾醇、黄酮等多种化学成分。
黄酮是以苯色酮环为基础的酚类化合物。多为晶体型固体或无定形粉末,颜色与结构有一定的关系,一般呈黄色。在自然界中一般以苷类形式存在,并且由于结合糖的种类、数量、位置及联接方式的不同,可以形成各种各样黄酮苷类[2]。黄酮类化合物已经引起了人们的广泛重视,因为它几乎存在于所有绿色植物中,是许多中草药的有效成分[3]。研究表明黄酮类物质有抗氧化和清除自由基的作用;保护心脑血管系统、抗衰老、抗肿瘤、抗癌作用;调节免疫能力以及降血糖降血脂等诸多生理功能[4]。黄酮类化合物的功能已经被人们认可,因此黄酮类化合物也已经广泛应用。
酪氨酸酶(Tyrosinase)是一种结构复杂的多亚基的含铜氧化还原酶[5],广泛存在于人体、动植物及微生物中[6-9]。来源于胚胎神经峭细胞,是黑色素代谢和儿茶酚胺的关键酶。酪氨酸酶活性越高,黑色素生成越多;活性被抑制,产生黑色素的能力就相应降低。因此,颜色较深的皮肤中的酪氨酸酶活性要更高一些。要想控制皮肤黑化,可以想办法抑制酪氨酸酶的活性。酪氨酸酶突变可中断铜结合使其催化活性丧失,眼、皮肤白化病是由于酪氨酸酶基因突变所致,而酪氨酸过量异常表达可导致色素沉积性疾病。酪氨酸酶抑制剂可以用于治疗雀斑、黄褐斑、老年斑等常见的色素沉积导致的皮肤病[10]。目前,市场上流行的美白化妆品中增白剂大多是酪氨酸酶抑制剂如熊果苷、维生素C衍生物及一些中药提取物等[11]。
本试验旨在确定适合提取文冠果壳中黄酮的溶剂,并对文冠果黄酮对酪氨酸酶的抑制作用进行研究,以期为文冠果壳的合理开发利用提供思路和依据,增加文冠果的附加值、提高资源综合利用效率。
1 材料与方法
1.1 试验材料
文冠果:陕西金道种业有限公司;酪氨酸酶(≥30 U/mg):合肥博美生物科技有限公司,酶溶液以pH 6.8磷酸缓冲液配成适宜浓度。其他试剂均为国产分析纯。
1.2 试验设备
101A22E电热鼓风干燥箱:上海实验仪器厂;FZ102植物粉碎机:天津泰斯特仪器公司;SHB-111循环水式真空泵:郑州金育科贸有限公司;RE 52-86E旋转蒸发器:上海亚荣生化仪器厂;TDL-40B离心机:上海安亭科学仪器厂;XW-80A旋涡混合器上海青浦沪西仪器厂;UV-2102紫外-可见分析仪:尤尼柯仪器有限公司。
1.3 试验方法
1.3.1 文冠果壳黄酮提取
1.3.1.1 乙醇浸提流程
文冠果壳→粉碎→石油醚脱脂→乙醇浸提→过滤→滤液浓缩。
取文冠果壳于烘箱中干燥至恒重,粉碎得粉末,称取粉末20 g,置于200 mL烧瓶中,60~90℃石油醚脱脂3次,时间4 h,液料比5∶1。加入70%的乙醇溶液70℃冷凝回流5 h,液料比7∶1。滤去残渣,回收乙醇至20%,在浓缩液中加入3倍体积的无水乙醇,搅拌均匀,置于4℃冰箱内静置24 h,进行醇沉以除去蛋白质、多糖、树脂等杂质。过滤,除去沉淀物,继续回收溶剂得浸膏。浸膏用8倍水量溶解,3 500 r/min离心分离15 min,取上清液作为试验样品。
1.3.1.2 水浸提流程
文冠果壳→粉碎→石油醚脱脂→水浸提→过滤→滤液浓缩。
取文冠果壳于烘箱中干燥至恒重,粉碎得粉末,称取粉末20 g,置于200 mL烧瓶中,60~90℃石油醚脱脂3次,时间4 h,液料比5∶1。加入去离子水(pH值为 10.5~11.5)140 mL,于 90 ℃冷凝回流120 min。滤去残渣,旋转蒸发浓缩,3 500 r/min离心分离15 min,上清液作为试验样品。
1.3.2 样品中黄酮质量分数的测定
1.3.2.1 标准曲线[12]
配制0.1 mg/mL的芦丁标准溶液,准确移取标准液0.20、0.60、1.00、1.40 mL,分别置于 10 mL 比色管中,加入0.3 mL,5%的亚硝酸钠,在旋涡混合器上摇匀,静置5 min,然后加入0.3 mL,10%的硝酸铝,震荡摇匀,静置5 min,最后加入4%的氢氧化钠2.5 mL,摇匀静置15 min后定容至刻线。空白溶液为参比溶液,在510 nm处测定吸光度值。以芦丁标准溶液浓度(c)对吸光度(A)作回归处理,得出标准曲线方程。
1.3.2.2 黄酮质量分数计算
文冠果壳醇提取液中的黄酮质量分数按NaNO2-A1(NO3)3比色法显色法测定[13]。吸取文冠果壳黄酮提取液1 mL于试管中,按标准曲线制备方法操作,测定反应液吸光度。做3个平行试验,取平均值。根据标准曲线方程求出提取液中黄酮的质量分数。
计算方法:
回归方程:Y=0.001 8X+0.003 9,R2=0.996 8
质量分数 =NV(Y-0.003 9)/(0.001 8 ×106m)×100%
式中:N为稀释倍数;V为溶液体积/mL;m为原料重量/g。
1.3.3 抑制酪氨酸酶活性试验
1.3.3.1 酪氨酸酶活性测定方法及抑制率计算
[14]操作:酪氨酸酶活力以催化L-多巴氧化反应生成多巴醌的二酚酶活力来衡量。试管中加入 L - 多巴 0.4 mL(1.0 mg/mL),pH 6.8 磷酸缓冲液2.4 mL,30℃水浴保温10 min后,加入酪氨酸酶0.2 mL(250 U/mL)混和均匀,酶促反应将L-多巴转化为红色产物多巴醌,在475 nm处有最大吸收。以每分钟A475增加0.001为1个酶活力单位,酶促反应的速度用每分钟A475增加值来表示。从混合均匀开始测量,每30秒测定一次,测到7 min。按如下两式计算相对酶活力和酶抑制率。
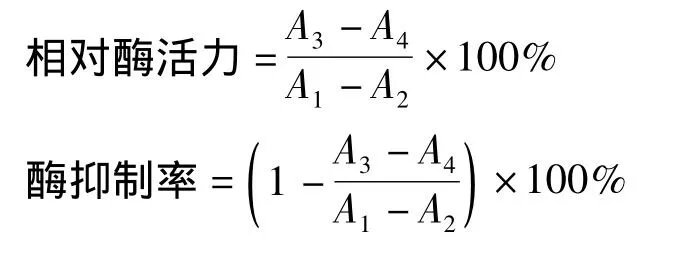
式中:A1为无黄酮提取液有底物时的吸光度;A2为无黄酮提取液无底物时的吸光度;A3为有黄酮提取液与底物时的吸光度;A4为有黄酮提取液无底物时的吸光度。
1.3.3.2 不同浓度文冠果黄酮对酪氨酸酶活力的影响
按1.3.3.1 方法,在试管中加入底物溶液 0.4 mL,以及不同量的文冠果黄酮,pH 6.8磷酸缓冲液补充反应液至2.8 mL,30℃水浴保温10 min,加入酪氨酸酶0.2 mL(250 U/mL)混和均匀后立即测定各反应的吸光度变化,计算抑制率。
1.3.3.3 不同反应顺序对抑制作用的影响
其他条件相同,底物、文冠果黄酮和酪氨酸酶按以下3种顺序加入:(A)底物与酪氨酸酶反应10 min后加入文冠果黄酮;(B)文冠果黄酮与酪氨酸酶预热10 min后加入底物进行反应;(C)底物与文冠果黄酮预热10 min后加入酪氨酸酶进行反应。测定各反应吸光度变化,计算抑制率。
1.3.3.4 不同反应时间下对抑制作用的影响
取定量的底物溶液与定量黄酮提取液于30℃水浴保温10 min,加入定量的酪氨酸酶反应不同时间,测定有无提取液加入情况下反应液的吸光度变化,计算抑制率。
1.3.3.5 文冠果黄酮对酪氨酸酶的抑制作用类型
其他条件相同,在反应体系加入定量酪氨酸酶,给定文冠果黄酮浓度,测定底物浓度不同时酶促反应的吸光度值,求出相应的反应速度。按Lineweaver-Burk的双倒数作图法作图,确定抑制作用的类型,得出米氏常数Km、最大反应速度Vmax。
2 结果与分析
2.1 黄酮质量分数标准曲线的绘制
按1.3.2.1方法操作,测得各浓度下的吸光度。以芦丁标准品浓度(c)对吸光度(A)作回归处理。绘出标准曲线,见图1。得回归方程:Y=0.001 8X+0.003 9,R2=0.996 8。
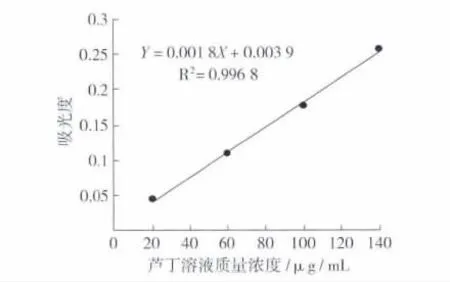
图1 黄酮测定标准曲线
2.2 文冠果黄酮的提取溶剂确定
由表1可知,醇提取法测得黄酮质量分数为2.15%左右而水提取法质量分数在1.82%左右。乙醇提取液黄酮质量分数较高,表明乙醇作为提取剂更加合适。因此选用文冠果壳醇提取液作为抑制剂测定文冠果黄酮对酪氨酸酶活性的抑制作用。
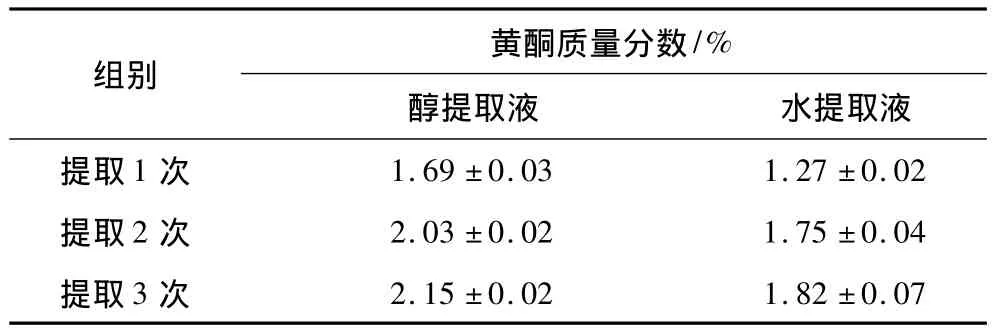
表1 文冠果壳黄酮质量分数
2.3 抑制酪氨酸酶活性试验
2.3.1 酪氨酸酶催化L-多巴氧化反应
L-多巴在酪氨酸酶作用下转化为红色产物多巴醌,反应体系中颜色的深浅与生成物浓度成正比。由图2反应液吸光度随反应时间的变化可知,反应体系的吸光度随反应时间的增加而增大,即多巴醌的浓度不断增加。但曲线斜率的逐渐减小,意味着反应速度降低。7 min时,反应速度为零,因此选择测定时间为0~7 min。
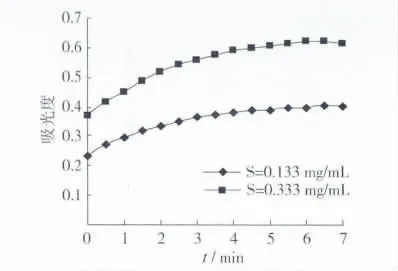
图2 酪氨酸酶催化L-多巴氧化反应进程曲线
2.3.2 不同浓度文冠果黄酮对酪氨酸酶活力的影响
由图3黄酮对酪氨酸酶活性的抑制率可知,文冠果黄酮对酪氨酸酶有抑制作用,反应时间相同时,抑制率随黄酮浓度增大而增加。但并非呈线性变化。文冠果黄酮对酪氨酸酶活性的抑制作用随时间的延长而降低。质量浓度为0.48 mg/mL的黄酮提取液作用于酪氨酸酶,反应时间为1 min时抑制率为39.3%,反应时间为7 min时,抑制率为25.3%。

图3 文冠果黄酮对酪氨酸酶活性的抑制作用
2.3.3 不同反应顺序对抑制作用的影响
底物、黄酮提取液和酪氨酸酶酶按1.3.3.3所述顺序加入。测定各反应吸光度变化,计算抑制率。得出不同反应顺序对酪氨酸酶活性抑制作用的影响见图4。
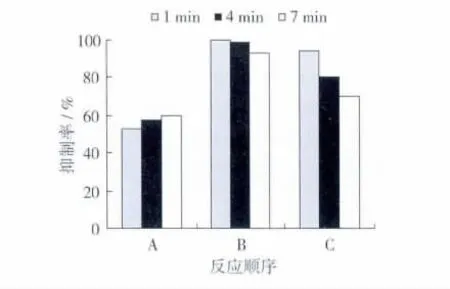
图4 反应顺序对酪氨酸酶活性抑制作用的影响
由图4可以看出,反应顺序的不同,作用效果差异明显。在不同反应时间内,操作B(文冠果黄酮提取液与酪氨酸酶预热10 min后加入底物进行反应)的抑制效果都明显高于A(底物与酪氨酸酶反应10 min后加入文冠果黄酮提取液)、C(底物与文冠果黄酮提取液预热10 min后加入酪氨酸酶进行反应)。说明在酪氨酸酶催化L-多巴的反应中,文冠果黄酮通过与酶相互作用,影响底物与酶反应,从而达到抑制酶活的效果。
2.3.4 不同反应时间文冠果黄酮对酪氨酸酶抑制作用的影响
定量的底物溶液、黄酮提取液与酪氨酸酶反应不同的时间,测定有无黄酮提取液加入情况下反应液的吸光度变化,得出不同反应时间时文冠果黄酮对酪氨酸酶抑制率的变化见图5。
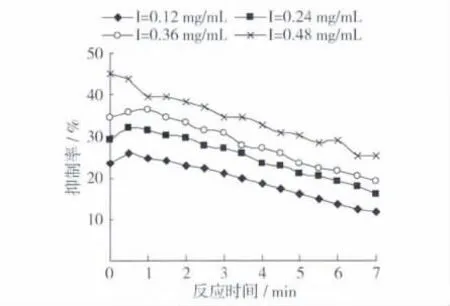
图5 反应时间对酪氨酸酶活性抑制作用的影响
由图5可以得知:不同浓度的黄酮提取液对酪氨酸酶活性抑制作用的变化趋势一致,反应初始时抑制率最高,随时间的延长逐渐降低。最高抑制率45.1%,由黄酮质量浓度为0.48 mg/mL时反应初始测得,当反应进行到7 min时,抑制率降到25.3%。
2.3.5 文冠果黄酮对酪氨酸酶抑制作用类型
在文冠果黄酮浓度及酪氨酸酶一定的情况下,测定不同底物浓度时反应体系吸光度的变化,求出相应反应速率,作反应速率随底物浓度变化图,结果如图6所示。
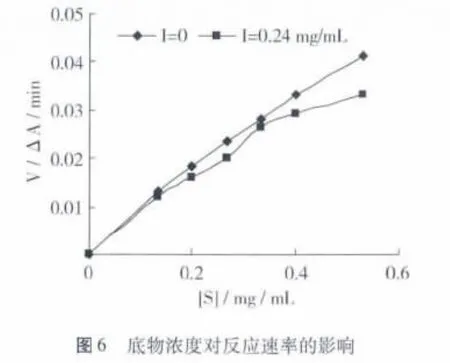
用底物浓度的倒数和反应速率的倒数做Lineweaver-Burk图,见图7。

从图7可以得知:未加文冠果黄酮提取液的试验组动力学参数 Km=1.05 mg/mL,Vmax=0.119 ΔA/min。加入提取液的试验组动力学参数 Km=1.23 mg/mL,Vmax=0.116 ΔA/min。2 条直线相交于第二象限并非交于横轴上,加提取液组Km减增大,说明文冠果黄酮提取液对酪氨酸酶的抑制作用类型不是单纯的非竞争性抑制。加入文冠果黄酮组最大反应速度减小,竞争性抑制作用最大反应速度应不变,表明也不是单纯的竞争性抑制作用。由于文冠果黄酮仅采用乙醇浸提未进行纯化,提取液中可能含有其他成分,因此不排除同时含有竞争性抑制剂和非竞争性抑制剂多种有效成分,抑制机理有待于进一步研究。
3 结论
3.1 醇提取法测得文冠果黄酮的质量分数为2.15%左右,水提取法质量分数1.82%左右。经比较得知乙醇提取法测得文冠果壳中黄酮物质质量分数更高。从资源利用率上来讲,乙醇提取法比水取提法好。
3.2 本研究发现,文冠果黄酮对酪氨酸酶的活性存在抑制作用,且随浓度的增加抑制剂对酶活性的抑制作用显著增强,当黄酮质量浓度为0.48 mg/mL时,抑制率最高可达45.1%。因此,文冠果黄酮具有美白作用。此研究既实现了果壳废物利用,也符合当前以天然物质为美容成分的发展趋势,提高了农产品的利用率和经济价值。
参考文献
[1]中国科学院中国植物志编辑委员会.中国植物志[M].47卷,1册.北京:科学出版社,1985:72
[2]张培成.黄酮化学[M].北京:化学工业出版社,2009
[3]唐浩国.黄酮类化合物研究[M].科学出版社.北京:科学出版社,2009
[4]张美莉.食品功能成分的制备及其应用[M].中国轻工业出版社,2007
[5]Harald Claus,Heinz Decker.Bacterial tyrosinases[J].Systematic and Applied Microbiology,2006,29(1):3 -14
[6]Van Gelder C W,Flurkey W H,Wichers H J,et al.Sequence and structural features of plant and fungal tyrosinases[J].Phytochemistry,1997,45(7),1309 -1323
[7]李国荣,张士璀,李红岩,等.酚氧化酶研究概况I——特性、功能、分布和在胚胎发育中的变化[J].海洋科学,2003,27(4):4 -8
[8]Sánchez - FerrerA,Rodríguez - López J N,García - Cánovas F,et al.Tyrosinase:a comprehensive review of its mechanism[J].Biochim.Biophysica Acta,1995,1247(1):1 -11
[9]Jonathan L.Rees.The Genetics of Sun Sensitivity in Humans[J].American journal of human genetics,2004,75(5):739-751
[10]王寒清,王昌涛,董银卯.美白化妆品的功能评价方法[J].日用化学品科学,2007,30(2):32 -34
[11]唐海谊,何冠邦,周喜林.美白中药之水及乙醇提取物对酪氨酸酶抑制功效之比较[J].中国药学杂志,2005,40(5):342-343
[12]焦岩.大果沙棘黄酮分离纯化及生物活性研究[D].哈尔滨:东北林业大学,2010
[13]李春英,王微,赵春建.沙棘不同部位黄酮含量的测定及比较[J].植物研究,2005,4(25):453 -455
[14]段玉清,刘睿,谢笔钧.莲房原花青素对酪氨酸酶活力和黑色素生物合成影响的初步研究[J].食品科学,2004,25(3):169-174.

