香叶醇治疗小鼠白假丝酵母菌阴道炎的疗效研究
代 敏, 彭 成
(1.成都医学院,四川成都610500;2.成都中医药大学中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川成都610075)
白假丝酵母菌Candida albicans俗称白色念珠菌,常存在于人阴道、肠道、口腔和上呼吸道等。在阴道内,白假丝酵母常和热带念珠菌、近平滑念珠菌、克柔念珠菌、光滑念珠菌等其它种属共同构成阴道的正常菌群[1],作为阴道内最主要的一个种属,当阴道内pH值改变或机体防御机能下降时,白假丝酵母会大量增殖,诱发阴道炎[2]。外阴阴道念珠菌病是全球妇女常见的一种感染性疾病[3],据报道,几乎75%女性至少经历一次感染,40%~50%患者有反复发作,严重影响妇女的生活和健康[4]。目前常用广谱抗真菌药如克霉唑等进行治疗,但因抗菌药的长期使用,白假丝酵母耐药率不断增加,发病率不断增加[5-6]。因此,开发新型天然无毒抗白假丝酵母药物迫在眉睫。
中药芳香疗法被用于传统的阴道念珠菌病治疗[7]。香叶醇是一种天然的植物源醇,广泛存在于香茅油、香叶油、香草油、玫瑰油等,作为一种香料成分,广泛用于建筑装饰和化妆品、高级香水、洗发水、香皂和其它非化妆品,如家用洗洁精和去污剂,全球使用每年超过1 000吨[8],现代药理学研究表明,香叶醇具有抗细菌、抗霉菌、杀虫、抗肿瘤、逆转细菌耐药性和免疫调节[9-13]等广泛的药理活性,亦被美国环境保护署认为是最低风险的杀虫剂[14]。课题组前期研究发现香叶醇还具有杀灭阴道滴虫和抗多重耐药细菌等广谱抗微生物活性。关于香叶醇抗白假丝酵母活性研究方面,目前仅有关于天竺葵油的主要成分香叶醇抑制白假丝酵母菌丝生长和对阴道菌落数影响的报道[7]。本研究拟采用琼脂平板二倍稀释法测定香叶醇对白假丝酵母标准株和临床分离株的最低抑菌浓度,研究其体外活性;体内采用白假丝酵母阴道炎小鼠模型,探讨香叶醇对白假丝酵母阴道炎模型小鼠的治愈率和治愈时间,以及对阴道内白假丝酵母生长的影响,结合体内、外活性研究,综合评价香叶醇在治疗白假丝酵母阴道炎的临床疗效,为后续防治白假丝酵母阴道炎及白假丝酵母感染性疾病的新药——香叶醇的系统研究与开发奠定基础。
1 材料与方法
1.1 实验菌株 ①白假丝酵母标准株:3株,其中1株购自美国临床实验室菌种保藏中心,编号为ATCC14053;2株购自中国工业微生物菌种保藏管理中心,编号分别为CICC32819和CICC31284。
②白假丝酵母临床分离株:14株,于2011年9月至12月分离于四川省妇幼保健院妇科门诊患者的阴道分泌物,并经BIO-KONT公司的KC-16鉴定板条与药敏纸片鉴定为白假丝酵母。
1.2 药物 实验药物:香叶醇 (购自Sigma公司,批号:MKBH7931V,质量浓度为0.878 g/mL)。
阳性药物:克霉唑阴道片 (济南利民制药有限公司,批号:1108148)。
1.3 实验动物 小鼠 (SPF级) [成都中医药大学实验动物研究中心,生产许可证号:SCXK(川)2008-11,使用合格证号:SCXK(川)2008-049]。
1.4 培养基和试剂 沙氏琼脂培养基 (每升含氯霉素0.1 g/L,广东环凯微生物科技有限公司),苯甲酸雌二醇注射液 (天津金耀氨基酸有限公司,批号:1007061),吐温-80(成都市科龙化工试剂 厂, 批 号:20080925),Mcfarland Standard(bioMeriéux,Inc. 批号:821772701)等。
1.5 主要仪器 多点接种仪 (日本佐久间制作所,SAKUMA MIT-P型),实验室用高压灭菌器(SANYO, MLS—3780 型 ), CO2INCUBATOR(SANYO,MOC—15A),节能净化工作台 (成都新光非兰特净化工程有限公司)等。
1.6 香叶醇抗白假丝酵母的体外活性
1.6.1 含药平板的制备 用1%吐温-80无菌蒸馏水对香叶醇进行倍比稀释,分别稀释成1∶2~1∶2 048共11个梯度,在一次性无菌培养皿中分别加入不同梯度的药液1 mL和14 mL灭菌的沙氏琼脂培养基,药物在各平板中的稀释梯度分别为29.27~28.58μg/mL,充分混匀,干燥后备用,以平板内加入等量1%吐温-80水代替药物制备溶剂对照平板,以生理盐水代替药物制备阳性对照平板。
1.6.2 菌液配置 将白假丝酵母标准株和临床分离株用无菌生理盐水调至菌密度1.5×106CFU/mL。
1.6.3 最低抑菌浓度 (MIC)的测定 用多点接种仪将菌液加入不同梯度的含药平板、阳性和溶剂对照平板,并以生理盐水代替菌液作阴性对照。37℃恒温培养24~48 h,观察各菌株在平板中的生长情况。
1.6.4 结果判定 以平板内无白假丝酵母生长的药物最小浓度为此药对该菌株的最低抑菌浓度。
1.7 香叶醇治疗白假丝酵母菌阴道炎的疗效
1.7.1 受试菌活化 将白假丝酵母标准株CICC32819接种于沙氏琼脂培养基,37℃培养24 h,活化后备用。
1.7.2 模型制备 在文献[15]的基础上加以改进,并通过预实验对影响模型建立的各项因素进行优化,确定白假丝酵母菌阴道炎模型小鼠的建立方法。具体方法如下,选取SPF昆明小鼠60只,体质量 (20±2)g,在感染前6 d开始,每只小鼠隔日颈部皮下注射苯甲酸雌二醇0.1 mg,并于最后1次注射苯甲酸雌二醇后,随机选择50只小鼠阴道内接种,每只小鼠感染白假丝酵母菌1.5×107CFU,24 h后重复感染1次;另10只以等体积生理盐水代替菌液作为空白对照。在最后1次感染后48 h和72 h分别取阴道分泌物进行涂片镜检,观察菌丝及芽生孢子生成情况,同时接种阴道分泌物于沙氏琼脂平板上,37℃培养24~48 h,观察菌株的生长情况;并观察阴道分泌物等变化。若在平板中生长有典型的白假丝酵母菌落,显微镜下观察到菌丝及芽生孢子,说明白假丝酵母菌阴道炎模型小鼠制备成功。
1.7.3 实验分组 待小鼠造模成功后,用0.1 mL无菌生理盐水对每只小鼠阴道进行无菌冲洗,对冲洗液进行菌落计数,根据小鼠阴道菌落计数结果将小鼠随机分为5组,即模型组、实验药物 (高、中、低)三个剂量组和阳性药物克霉唑组。未感染的为空白组,每组10只。各组小鼠阴道内白假丝酵母的菌落数情况见表1。
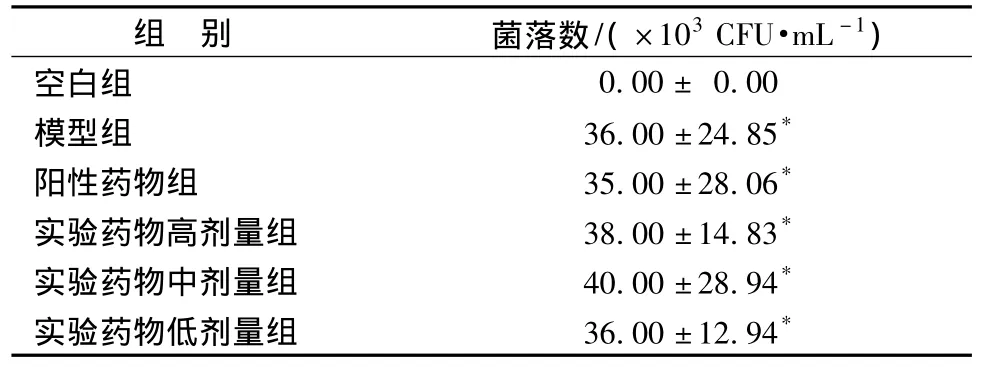
表1 各组小鼠阴道感染白假丝酵母的情况分析Tab.1 Analysis on the colony num ber of Candida albicans in vagina
给药前,与空白组比较,模型组、阳性药组和实验药组阴道内菌落数明显增加(P<0.01),而模型组和实验组各组之间均无统计学意义(P>0.05)。说明白假丝酵母菌阴道炎小鼠模型造模成功,且各组小鼠阴道内感染程度相当。
1.7.4 香叶醇治疗白假丝酵母菌阴道炎模型小鼠的疗效 采用阴道内给药法对白假丝酵母菌阴道炎模型小鼠进行治疗,即每天分别采用高、中、低三个剂量的香叶醇对感染模型小鼠进行治疗,连续20 d。其中阳性药物组用克霉唑,模型和空白组用生理盐水。分别在给药前(0 d),以及第3天、第5天和第7天给药6 h后用0.1 mL无菌生理盐水冲洗阴道,对冲洗液内的白假丝酵母进行菌落计数,分别统计分析给药前(0 d)、给药后第3天、第5天和第7天小鼠阴道内菌落数的变化情况,观察药物对感染小鼠阴道内白假丝酵母的杀灭或抑制作用。在给药第7天后每天接种观察阴道分泌物的菌丝及芽生孢子生长情况以及在沙氏琼脂平板中的生长情况,同时观察小鼠阴道分泌物等的变化情况。以连续3 d阴道分泌物接种,无白假丝酵母生长,且阴道无充血、肿胀等临床症状,判定为治愈,治愈小鼠不再用药。
1.7.5 数据统计分析 采用SPSS 17.0软件中的单因素方差分析法比较分析各组小鼠阴道内菌落数之间的差异显著性,用配对T检验分析香叶醇各剂量组在给药前后及不同给药时间的差异显著性,统计给药14 d和给药20 d的治愈时间和治愈率。
2 结果与分析
2.1 香叶醇抗白假丝酵母的体外活性 采用琼脂平板二倍稀释法测定了香叶醇和阳性药克霉唑对3株白假丝酵母标准株和14株临床分离株的最低抑菌浓度,结果见表2。

表2 香叶醇对白假丝酵母的体外抗菌活性Tab.2 In vitro anti-Candida albicans activity of geraniol
由上表可知,香叶醇对3株白假丝酵母标准株和14株临床分离株均有较强的抗菌活性。对3株白假丝酵母标准株和14株临床阴道炎感染患者分离株的 MIC分别为0.11~0.23 mg/mL、0.11~0.23 mg/mL[MIC均 值 为 (0.19 ± 0.06)mg/mL]。阳性药克霉唑对1株标准株ATCC14053和2株临床分离株无明显抗菌活性,说明克霉唑对部分白假丝酵母产生了一定程度的耐药性。
2.2 香叶醇治疗白假丝酵母菌阴道炎的疗效 香叶醇对白假丝酵母菌阴道炎模型小鼠阴道内白假丝酵母生长的影响结果见表3,给药14 d和给药20 d的治愈时间和治愈率分析见表3。
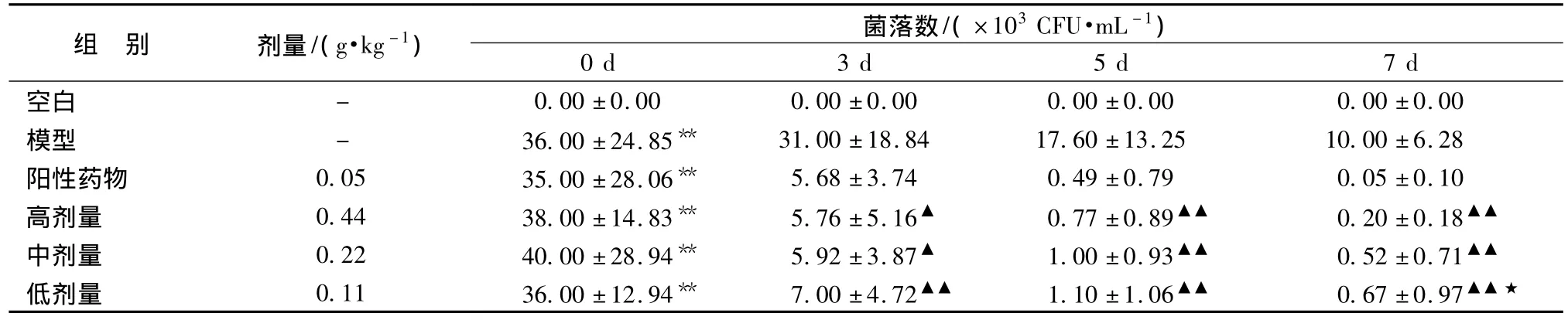
表3 香叶醇对白假丝酵母菌阴道炎模型小鼠阴道内菌落数的影响Tab.3 Effect on the colony number of Candida albicans in mice vagina of geraniol
由表3可知,给药后,与模型组比较,高、中、低剂量组白假丝酵母菌落数明显下降,且随着给药时间的延长,病情逐渐好转。比较各剂量组给药前后的菌落数变化情况,与同组内给药前比较,高剂量组给药后第3天菌落数显著降低 (P<0.05)、第5天和第7天菌落数均极显著性下降(P<0.01);中剂量组给药后第3天菌落数显著降低 (P<0.05),第5天和第7天菌落数均极显著性下降 (P<0.01);低剂量组给药后第3天、第5天和第7天菌落数均极显著性下降 (P<0.01)。与给药后第3天比较,低剂量组给药后第7天菌落数呈显著性下降 (P<0.05)。说明香叶醇高、中、低三个剂量组与阳性药克霉唑具有相似的体内抗白假丝酵母活性。
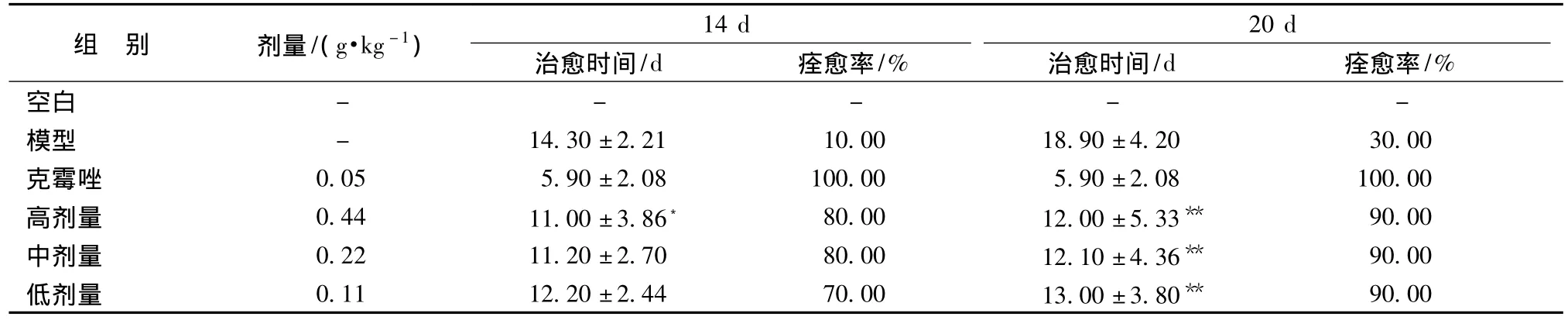
表4 香叶醇治疗白假丝酵母菌阴道炎的疗效Tab.4 Efficacy of geraniol against candidal vaginitis
由表4可知,香叶醇高、中、低剂量组给药14 d对白假丝酵母菌阴道炎模型小鼠的平均治愈时间分别为11.00 d、11.20 d和12.20 d,治愈率分别为80.00%、80.00%和70.00%;与模型组(平均自愈时间为14.30 d,自愈率为10.00%)比较,高剂量组治愈时间明显缩短 (P<0.05),中、低剂量组治愈率显著提高;各剂量组内之间比较,治愈时间均无明显统计学意义,且量效关系不显著。香叶醇高、中、低剂量组给药20 d对模型小鼠的平均治愈时间分别为12.00 d、12.10 d和13.00 d,治愈率均为90.00%;与模型组 (平均自愈时间为18.90 d,自愈率为30.00%)比较,三个剂量组治愈时间均明显缩短 (P<0.01),治愈率显著提高;各剂量组内之间比较,治愈时间均无明显统计学意义 (P>0.05)。说明香叶醇具有治疗白假丝酵母菌阴道炎作用,在试验剂量范围内,量效关系不显著。
3 讨论
念珠菌性阴道炎是育龄妇女常见的条件致病真菌感染,其中约有85%~90%由白色念珠菌引起[16]。在美国,所有外阴、阴道炎疾病中念珠菌性阴道炎发生率最高为39%,是滴虫性阴道炎的4倍[17]。近年来,随着抗生素及皮质激素药物的广泛应用,我国白假丝酵母菌阴道炎发病率呈明显上升趋势,严重影响妇女的工作及性生活[16-17]。为了探讨抗真菌中药治疗白假丝酵母菌阴道炎的疗效,本研究首次对香叶醇在体外对白假丝酵母的最低抑菌浓度进行了测定,结果表明香叶醇对17株白假丝酵母受试菌株均有较强的抗真菌活性,其中对来自临床阴道炎感染患者分离株的MIC为0.11~0.23 mg/mL,虽然低于广谱抗真菌阳性药克霉唑对多数白假丝酵母分离株的体外抗真菌活性(MIC为0.81~26.04μg/mL),但研究发现克霉唑对受试菌株中的1株标准株和2株临床分离株在最大浓度1.67 mg/mL时无抗菌活性,说明部分白假丝酵母菌株对克霉唑产生了一定程度的耐药性。因此,香叶醇除本身具有较强的自身体外抗菌活性之外,还具有克霉唑等阳性药所不可比拟的优势,一方面香叶醇对所有受试菌均有较强抗真菌活性,无耐药菌株;另一方面香叶醇广泛存在于多种植物中,作为天然物质,具有毒副作用小和明显的自然资源优势。
目前,中药在抗感染性疾病的研究方面主要集中于体外研究,体内整体疗效研究相对较少。鉴于机体感染不仅受外界环境因素的影响,还受体内诸多因素的影响,因此,本研究以“药物 (香叶醇)—机体 (模型小鼠)—微生物 (白假丝酵母)”的整体观和系统观为指导思想,综合分析了药物、机体和微生物这三者之间的相互作用,为系统、科学评价香叶醇在未来抗感染性疾病中的开发和运用奠定基础。首先,借助于小鼠外阴阴道感染白假丝酵母制备念珠菌阴道炎感染模型,探讨机体和微生物之间的相互作用,选择外源性雌激素造成小鼠假发情状态,能明显增强小鼠对白假丝酵母的易感性,小鼠阴道感染率可达100.00%,且感染小鼠的阴道内菌落数计数在整个观察期中一直保持较高水平,亦证明本实验白假丝酵母菌阴道炎模型小鼠制备成功。其次,利用白假丝酵母菌阴道炎模型小鼠,通过阴道内给药,且每给药2 d后用生理盐水冲洗阴道对阴道内的白假丝酵母进行菌落计数,分析了药物香叶醇对感染机体内微生物的作用。结果表明,与模型组和给药前比较,随着给药时间的延长,病情逐渐好转,菌落数明显下降(P<0.05,P<0.01)。最后,结合中药自身药效相对较慢的特点和预实验结果,分别选择了用药14 d和20 d,根据小鼠阴道内微生物转阴率、阴道分泌物变化等情况综合分析香叶醇对微生物和机体的相互作用,确定小鼠的治愈率和治愈时间。结果表明,给药14 d后,高、中、低剂量小鼠的治愈时间分别为11.00 d,11.20 d和12.20 d,治愈率分别为80.00%、80.00%和70.00%,明显低于模型组的自愈时间 (14.30 d),高于模型组的自愈率(10.00%)。给药20 d后,高、中、低剂量组小鼠的治愈时间分别为12.00 d、12.10 d和13.00 d,治愈率均为90.00%,均明显低于模型组自愈时间18.90 d(P<0.01),明显高于模型组的自愈率(30.00%)。比较高、中、低三个剂量组的治愈率和治愈时间,发现三者均无明显统计学差异,说明在给定的剂量范围内,量效关系不显著,提示使用低剂量治疗白假丝酵母阴道炎,即可达到较好的临床疗效。
此外,本研究还发现香叶醇在高、中、低三个剂量范围内对小鼠阴道均无明显局部刺激性和毒副作用,说明香叶醇在治疗白假丝酵母菌阴道炎是相对安全、有效的,亦有报道香叶醇可能导致过敏性接触性皮炎[18-19],对于香叶醇的其它毒副作用有待于后续深入研究。课题组前期研究还发现香叶醇除具有自身的抗真菌活性外,还兼有具抗多重耐药菌如耐甲氧西林金黄色葡萄球菌和抗滴虫等多种药理活性,说明香叶醇具有治疗真菌性、细菌性和滴虫性阴道炎的联合疗效,更符合常以混合感染性阴道炎的临床实际。因此,香叶醇具有运用于治疗白假丝酵母菌阴道炎、滴虫性阴道炎、细菌性阴道炎的开发和运用前景,尤其是在治疗由耐药菌株和虫株引起的阴道炎等感染性疾病方面具有重要的理论和现实意义。
[1]Resende J C,de Resende M A,Saliba JL.Prevalence of Candida spp.in hospitalized patients and their risk factors[J].Mycoses,2002,45(8):306-312.
[2]Candido R C,Toloi M R,Franceschini SA,et al.In vitro activity of antimycotic agents determined by E-test method against vaginal Candida species[J].Mycopathologia,1999,144(1):15-20.
[3]Mahmoudi Rad M,Zafarghandi S,Abbasabadi B,et al.The epidemiology of Candida species associated with vulvovaginal candidiasis in an Iranian patient population[J].Eur J Obstet Gynecol Reprod Biol,2011,155(2):199-203.
[4]Asticcioli S,Sacco L,Daturi R,et al.Trends in frequency and in vitro antifungal susceptibility patterns of Candida isolates from women attending the STD outpatients clinic of a tertiary care hospital in Northern Italy during the years 2002—2007[J].New Microbiol,2009,32(2):199-204.
[5]Yücesoy M,Marol S.Performance of chromagar Candida and biggy agar for identification of yeast species[J].Ann Clin Microbiol Antimicrob,2003,2:8.
[6]Sendid B,Francois N,Standaert A,et al.Prospective evaluation of the new chromogenic medium Candi Select 4 for differentiation and presumptive identification of the major pathogenic Candida species[J].J Med Microbiol,2007,56:495-9.
[7]Maruyama N,Takizawa T,Ishibashi H,et al.Protective activity of geranium oil and its component,geraniol,in combination with vaginal washing against vaginal candidiasis in mice[J].Biol Pharm Bull,2008,31(8):1501-1506.
[8]Lapczynski A,Bhatia S P,Foxenberg R J,et al.Fragrance material review on geraniol[J].Food Chem Toxicol,2008,46(11):S160-170.
[9]Mendonça-Ade L,da-Silva C E,de-Mesquita F L,et al.Antimicrobial activities of components of the glandular secretions of leaf cutting ants of the genus Atta[J].Antonie Van Leeuwenhoek,2009,95(4):295-303.
[10]余伯良,罗惠波,周 健,等.山苍子油抗霉菌及抑制黄曲霉产毒的有效成分研究[J].四川轻化工学院学报,2002,15(1):32-36.
[11]Barros L A,Yamanaka A R,Silva L E,et al.In vitro larvicidal activity of geraniol and citronellal against Contracaecum sp(Nematoda:Anisakidae)[J].Braz J Med Biol Res,2009,42(10):918-920.
[12]Lorenzi V,Muselli A,Bernardini A F,et al.Geraniol restores antibiotic activities against multidrug-resistant isolates from gram-negative species[J].Antimicrob Agents Chemother,2009,53(5):2209-2211.
[13]Tiwari M,Kakkar P.Plant derived antioxidants-Geraniol and camphene protect rat alveolar macrophages against t-BHP induced oxidative stress[J].Toxicol In Vitro,2009,23(2):295-301.
[14]Reeves W K,Miller M M.Aqueous 2%geraniol as a mosquito repellent failed against Aedes aegypti on ponies[J].J Am Mosq Control Assoc,2010,26(3):340-341.
[15]刘丽芬,柴天川.扶正方药对复发性念珠菌性阴道炎小鼠模型的抗真菌作用研究[J].时珍国医国药,2009,20(3):535-536.
[16]谭 娟,曹 菲,丁 娟,等.不同条件下小鼠白念珠菌性阴道炎易感性的研究[J].华中医学杂志,2005,29(3):149-150.
[17]陈善娟,刘志香,吴 艳,等.不同抗真菌药治疗白念珠菌性阴道炎模型小鼠的疗效比较[J].医药导报,2006,25(12):1246-1249.
[18]Tamagawa-Mineoka R,Katoh N,Kishimoto S.Allergic contact cheilitis due to geraniol in food[J].Contact Dermatitis,2007,56(4):242-243.
[19]Reeves W K,Miller M M.Aqueous 2%geraniol as a mosquito repellent failed against Aedes aegypti on ponies[J].J Am Mosq Control Assoc,2010,26(3):340-341.

