华蟾素诱导人胃癌BGC-823细胞miRNA表达变化的实验研究
周荣平, 陈 刚, 沈志力, 潘立群
(1.南京中医药大学第一临床医学院,江苏 南京210046;2.南京医科大学附属江宁医院,江苏 南京211100)
MicroRNA(miRNA)是一类广泛存在于真核生物中,19~24核苷酸长度的内源性单链非编码小RNA分子,其与靶基因mRNA通过碱基配对方式引导 RNA沉默复合体 (RNA-induced silencing complex,RISC)降解mRNA或阻碍其翻译 ,在转录后水平负调节基因的表达,从而参与了细胞的一系列重要进程,包括细胞增殖[1]、凋亡[2]、发育[3]、分化[4]和代谢[5]等。它的表达在许多肿瘤中发生异常改变,所以miRNA与癌症的研究,对于认识癌症的发生、诊断、治疗有了新的启示。
胃癌是消化系统常见的恶性肿瘤之一,严重威胁人类的健康。目前,化疗是胃癌综合治疗的重要组成部分,5-氟尿嘧啶、铂类仍是首选化疗药物,含新型化疗药物在内的联合化疗方案鲜见更优越的有效性和安全性。华蟾素 (cinobufacin)是中药复方制剂,具有清热解毒、利水消肿、化瘀溃坚等作用。很多研究表明华蟾素通过抑制细胞增殖和诱导细胞凋亡等机制发挥抗肿瘤作用,对肝癌、食管癌、肺癌、前列腺癌、卵巢癌和白血病等多种肿瘤细胞产生抑制作用[6-8]。但是,目前关于miRNA与华蟾素抗胃癌作用之间关系的研究还甚少。本实验研究华蟾素对人胃癌BGC-823细胞株的抑制增殖、诱导凋亡作用以及miRNA表达谱的变化,以探讨miRNA参与调控华蟾素抗胃癌作用的可能机制。
1 材料与方法
1.1 材料 人胃癌BGC-823细胞 (东南大学医学院表遗传实验室提供);华蟾素注射液 (2 mg/mL,5 mL/支,安徽金蟾生化股份有限公司);DMSO(SIGMA);链霉素混合液 (Keygen);胰蛋白酶-EDTA消化液 (Keygen);MTT试剂盒 (BIOSHARP);Trizol(Invitrogen, Carlsbad, CA,USA);基因芯片及相关试剂盒 (上海康成生物公司);RNA纯化试剂盒 (Takra);实时定量PCR试剂盒 (Takra)。
1.2 常规细胞培养 人胃癌BGC-823细胞在含FBS的RPMI-1640培养液中,37℃,5%二氧化碳的孵箱中常规培养。
1.3 MTT法检测华蟾素对细胞增殖的抑制作用细胞消化、计数、配制成密度为3×104个/mL的细胞悬液,96孔细胞培养板中每孔加入100μL细胞悬液 (每孔3×103个细胞),96孔细胞培养板置于37℃,5%CO2培养箱中培养24 h;用完全培养基稀释药物至所需质量浓度 (50、25、12.5 mg/mL),每孔加入200μL相应的含药培养基,同时设立阴性对照组,阳性对照组;96孔细胞培养板置于37℃,5%CO2培养箱中培养24、48、72 h;每孔加入20μL MTT(5 mg/mL),在培养箱继续培养4 h;弃去培养基,每孔加入150μL DMSO溶解,酶标仪读出每孔的OD值,计算抑制率及细胞生存率。

细胞生存率 (%)=100%-实验组抑制率(%)
应用SPSS(Staffstical Package for the Social Science)17.0通过机率单位加权回归法 (Bliss法)计算IC50
1.4 MiRNA芯片分析 华蟾素处理对数生长期人胃癌BGC-823细胞48 h后,用 Trizol(Invitrogen,Carlsbad,CA,USA)提取总 RNA,总 RNA在3'-端用miRCURYTM LNA Arrays进行杂交,通过GenePix 4000B扫描仪和Gene Pix 6.0软件进行图像扫描和数据分析图像存成TIF文件,使用GenePixPro 6.0分析数据 (本实验由上海康成生物工程有限公司完成)。
1.5 miRNA生物信息学分析 华蟾素作用于人胃癌BGC-823细胞为48 h后,获得表达上调或下调的miRNA表达谱。应用miRWalk数据库分析预测差异表达miRNA的靶基因。
1.6 实时荧光定量逆转录聚合酶链式反应 (RTPCR)实验 将microRNA芯片结果中差异表达较显著的2个miRNA进一步进行RT-PCR检测。
人胃癌BGC-823细胞用50 g/mL华蟾素处理48 h后使用 TRIzol法提取细胞总 RNA,NanoDrop ND—1000全波长紫外测量光密度 D(260/280),1%的琼脂糖电泳鉴定并进行反转录 U6作为内参照RT-PCR引物序列如表1。将所有cDNA样品分别配置Realtime PCR反应体系。体系配置如下:2×Master Mix 5μL,10μmol/L的PCR特异引物F,0.5μL 10μmol/L的PCR特异引物R 0.5μL。加水至总体积为8μL,5 000 r/min短暂离心,将8 μL混合液加到384-PCR板对应的每个孔中,再加入对应的2μL cDNA。将上述PCR板置于Realtime PCR仪上进行PCR反应。所有的指标均按以下程序进行:95℃,10 min;40个PCR循环 (95℃,10 s;60℃,60 s(收集荧光)。按 (95℃,10 s;60℃,60 s;95℃,15 s);并从60℃缓慢加热到99℃ (仪器自动进行-Ramp Rate为2%)。各样品的目的miRNA和内参 (U6)分别进行Realtime PCR反应。数据采用2-ΔΔCT法进行分析 (本实验由上海康成生物工程有限公司完成)。

表1 m iR-29a、m iR-26a引物序列Tab.1 Primer sequence of m iR-29a and m iR-26a
1.7 统计学方法 采用SPSS 10.0软件行统计学处理。实验数据以±s表示,计量资料数据两组间均数比较采用成组t检验,多组间均数比较采用单因素方差分析,计数资料数据比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 不同质量浓度华蟾素对人胃癌细胞BGC-823生长的抑制作用 见图1。不同质量浓度华蟾素处理人胃癌细胞BGC-823 24、48、72 h后,细胞的生长均受到不同程度的抑制。华蟾素50 mg/mL作用48 h对人胃癌BGC-823细胞的生存率为39.72%,均高于其他质量浓度剂量组及时间点,随着药物质量浓度的增加,华蟾素对人胃癌BGC-823细胞的生长抑制作用明显增强 (见图1),具有剂量相关性,各质量浓度组与对照组相比,不同质量浓度的华蟾素对细胞增殖抑制率具有显著性(P <0.05)。

图1 MTT法检测华蟾素对胃癌细胞增殖的抑制作用折线图Fig.1 Cinobufacin inhibited p roliferation of BGC823 cells measured by MTT assay
2.2 华蟾素对人胃癌BGC-823细胞miRNA表达的影响及其靶基因的预测 华蟾素处理48h后,使人胃癌细胞BGC-823的miRNA中33个miRNA表达上调1.5倍以上,分别为hsa-miR-18a-5p、hsamiR-29a-5p、hsa-miR-3178、hsa-miR-29a-3p、hsamiR-424-5p、hsa-miR-3651、hsa-miR-27a-3p、hsamiR-29b-3p、 hsa-miR-21-5p、 hsa-miR-5684、 hsamiR-20b-5p、hsa-miR-4521、hsa-miR-335-5p、hsamiR-4321、 hsa-miR-299-3p、 hsa-miR-107、 hsamiR-30d-5p、 hsa-miR-4288、 hsa-miR-138-2-3p、hsa-miR-19a-3p、 hsa-miR-494、 hsa-miR-26a-5p、hsa-miR-15a-5p、 hsa-miR-29a-3p、 hsa-miR-3177-3p、hsa-miR-18b-5p、hsa-miR-454-3p、hsa-miR-24-1-5p、hsa-miR-100-5p、hsa-miR-301a-3p、hsa-miR-493-5p、hsa-miR-4500、hsa-miR-1273g-3p,12 个miRNA表达下调1.5倍以上,分别为hsa-miR-3613-3p、hsa-miR-1246、hsa-miR-21-3p、hsa-miR-1246、hsa-miR-183-5p、hsa-miR-33b-5p、hsa-miR-548as-3p、hsa-miR-32-3p、hsa-miR-7-5p、hsa-miR-34a-5p、hsa-miR-339-5p、hsa-miR-1246。
2.3 qRT-PCR的方法验证华蟾素诱导的miRNA的表达 选取芯片中表达上调的miRNA分子中的两个miRNA,即miR-29a和miR-26a,利用实时定量RT-PCR的方法进行验证。结果如图2,华蟾素可以诱导miR-29a和miR-26a的表达上调,与基因芯片结果相一致。
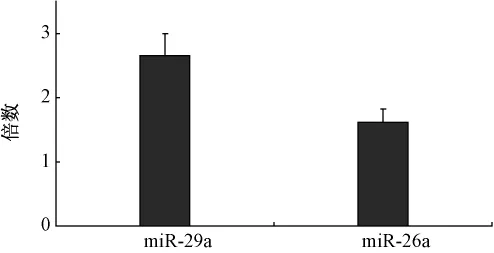
图2 华蟾素诱导人胃癌BGC-823细胞m iR-29a和m iR-26a表达上调的qRT-PCR验证结果Fig.2 Upregulated expression of m iR-29a and m iR-26a in BGC-823 cells treated with Cinobufacin confirmed by qRT-PCR
2.4 生物信息学方法预测miR-29a和miR-26a的靶基因 利用生物信息学方法,miRWalk数据库分析预测差异表达miR-29a和miR-26a的靶基因,见表2。

表2 m iR-29a和m iR-26a的靶基因Tab.2 Target genes of m iR-29a and m iR-26a
3 讨论
华蟾素具有抑制肿瘤细胞核酸代谢,干扰DNA和RNA的合成,阻碍细胞有丝分裂,从而使肿瘤细胞形态和功能发生变化,破坏细胞结构,促使细胞凋亡等药理作用[9-11]。本研究结果显示:在本研究中,华蟾素抑制了胃癌BGC-823细胞系的生长,并具有时间依赖性。这与Han等[12]的研究结果相一致。由此可见,华蟾素对人胃癌BGC-823细胞有明显增殖抑制作用,且在一定范围内,随华蟾素质量浓度增加作用时间延长,细胞增殖抑制率相应增加,具有时效和量效关系。
许多研究显示华蟾素通过免疫调节抑制肿瘤生长、诱导肿瘤细胞分化、影响细胞周期、抑制肿瘤血管形成、调节酶活性以及抑制肿瘤细胞增殖、促进细胞凋亡等机制达到抗肿瘤作用,但有关miRNA参与华蟾素抗癌机制的研究未见报道。miRNA可通过负调控靶基因 (癌基因或抑癌基因)的表达,参与癌症的发生发展,所以miRNA的调控机制在中医药抗胃癌中的研究正成为当今研究的热点。有研究显示,白藜芦醇、延胡索总碱、姜黄素等多种中药抗肿瘤作用与miRNA表达变化相关[13-15]。本研究发现,华蟾素抑制胃癌 BGC-823细胞株增殖过程中,伴随着miRNA表达谱的改变,在所有571个miRNA分子中表达上调的有33个,表达下调的有12个,在表达上调的miRNA分子中,选取 miR-29a、miR-26a进行实时定量 qRTPCR方法进行验证,结果显示其表达倍数与芯片结果相一致。
有研究显示miR-29a通常表现为抑癌基因的作用,它的过表达可以降低包括肺癌、鼻咽癌、胆管癌等多种实体肿瘤细胞的增值和侵袭潜能[16-18],除此之外,研究显示,miR-26a在肝细胞性肝癌中表达显著下调[19]。许多证据提示,miRNA与肿瘤相关的信号转导通路具有密切的联系[20]。通过生物信息学方法 (miRWalk)进行miRNA的靶基因预测,其中miR-29a的靶基因中,有与抑制肿瘤细胞增殖并诱导凋亡相关的基因,如PPM1D、Wip-1、bcl-2、MCL-1、Caspse-8、P53 等,Meng 等[21]利用Western-blot和实时定量RT-PCR技术检测肝癌组织中miR-29呈低表达,进一步证实P53信号通路中的PPMID、Wip-1是 miR-29a的直接靶点。miR-26a的可能靶基因中有与细胞周期通路相关因子如PCNA、CDK1、PEBP1等,miR-26a可能调控这些靶基因的表达来抑制肿瘤细胞的增殖。刘友平等[22]利用 miR-26a mimics转染人肝癌细胞株HepG2方法,证实miR-26a可能通过调控细胞增殖通路相关蛋白的表达,参与肝癌细胞周期的调控以抑制肝癌细胞的增殖,从而达到抑制肝癌的发生发展。通常一个基因可以被多个miRNA所调节,同时一个miRNA也可以调节多个miRNA,所以,推测华蟾素可能通过诱导某些重要的miRNA分子如miR-29a、miR-26a等的过表达,由这些分子共同来调控增殖通路中的相关基因,抑制胃癌细胞株增殖。但是,关于华蟾素诱导某些特定miRNA表达变化的可能机制、验证与抗胃癌作用相关的特定miRNA的功能及其对应的靶基因之间的关系,还有待进一步更深入的研究。
综上所述,华蟾素抑制胃癌BGC-823细胞株增殖作用可能与miRNA表达谱的变化密切相关。本研究可能为miRNA调控华蟾素抗胃癌的机制提供了新的理论依据,同时也为华蟾素治疗胃癌找到一个新的敏感性指标。
[1]Cheng A M,Byrom M W,Shelton J,et al.Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J].Nucleic Acids Res,2005,33(4):12902-1297.
[2]Xu P,Guo M,Hay B A.Micro RNAs and the regulation of cell death[J].Trends Genet,2004,20(12):617-624.
[3]Karp X,Ambros V.Encountering microRNAs in cell fate signaling[J].Science,2005,310(5752):1288-1289.
[4]Chen C Z,Li L,Lodish H F,et al.MicroRNAs modulatehematopoietic lineage differentiation[J]. Science,2004,303(5654):83-86.
[5]Poy M N,Eliasson L,Krutzfeldt J,et al.A pancreatic is let2 specific microRNA regulates insulin secretion[J].Nature,2004,432(7014):226-230.
[6]Yeh J Y,Huang W J,Kan S F,et al.Effects of bufainand cinobufagin on the proliferation of androgen dependent and independent prostate cancer cells[J].Prostate,2003,54(2):112-124.
[7]Takai N,Ueda T,Nishida M,et al.Bufalin induces growth inhibition,cell cycle arrest and apoptosis in human endome trial and ovarian cancer cells[J].Int J Mol Med,2008,21(5):637-643.
[8]张 莉,李军民,钱 樱,等.华蟾素诱导U937细胞凋亡及其作用机制[J].肿瘤,2007,27(5):41-344.
[9]He X,Tang J,Qiao A,et al.Cytotoxic biotransformed products from cinobufagin by Mucor spinosus and Aspergillus niger[J].Steroids,2006,71(5):392-402.
[10]Kerr JF,Wyllie A H,Currie A R.Apoptosis:a basic bio-logical phenomenon with wide-ranging implications in tissue kinetics[J].Br J Cancer,1972,26(4):239-257.
[11]Mirkes P E.Warkany lecture:to die or not to die,play the role of apoptosis in normal and abnormal mammalian development[J].Teratology,2002,65(5):228-239.
[12]Han H B,Chen J Y,Yuan Y,et al.Cinobufacin-induced apoptosis in human gastric carcinoma cell line BGC-823[J].Bull Chin cancer,2008,17:233-235.
[13]Sun M,Estrov Z,Ji Y,et al.Curcumin(diferuloymethane)alters the expression profiles of microRNAs in human pancreatic cancer cells[J].Mol Cancer Ther,2008,7(3):464-473.
[14]张国铎,谢 丽,胡文静,等.延胡索总碱对人肝癌细胞系Hep G2抑制作用及其对 microRNA表达谱的影响[J].南京中医药大学学报,2009,25(3):181-183.
[15]徐 凌,王 锋,徐选福,等.白藜芦醇通过下调 microRNA-151表达抑制肝癌细胞株Hep G2细胞活性的研究[J].上海交通大学学报:医学版,2010,30(7):774-778.
[16]Fabbri M,Garzon R,Cimmino A,et al.MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltrans ferases 3A and 3B[J].Proc Natl Acad Sci USA,104(40):15805-15810.
[17]Mott JL,Kobayashi S,Bronk SF.mir-29 regulates Mcl-1 protein expression and apoptosis[J]. Oncogene,26(42):6133-6140.
[18]Sengupta S,den-Boon JA,Chen I H.MicroRNA 29c is downregulated in nasopharyngeal carcinomas,up-regulating mRNAs encoding extracellular matrix proteins[J].Proc Natl Acad Sci USA,105(5):5874-5878.
[19]Han S H,Sakuma L,Shin E K,et al.Antiatherosclerotic and anti-insulin resistance effects of adiponectin:basic and clinical studies[J].Prog Cardiovasc Dis,2009,52(2):126-140.
[20]Wu W,Sun M,Zou G M,et al.MicroRNA and cancer:Current status and prospective[J].Int J Cancer,2007,120(5):953-960.
[21]Meng Xianzhi,Zheng Tongsen,Chen Xi,et al.MicroRNA expression alteration after arsenic trioxide treatment in HepG-2 cells[J].J Gastroenterol Hepatol,2010,26(1):186-193.
[22]刘友平,李 娟,代荣阳,等.miR-26a mimics转染人肝癌细胞株HepG2的表达蛋白质组分析[J].中国病理生理杂志,2011,27(2):367-370.

