MK-801诱导的精神分裂症小鼠行为学和胼胝体髓鞘的改变☆
修芸 张蕾 仇玄 陈林 卢伟 彭超 程国华 晁凤蕾 唐勇
精神分裂症(schizophrenia,SZ)是一组常见的病因未完全阐明的精神疾病,多起病于青壮年。多巴胺亢进[1]、5-羟色胺功能异常[2]及谷氨酸[3-4]功能低下等被认为是SZ的主要发病原因。近来研究表明SZ患者大脑白质存在体积减小[5-8],及髓鞘蛋白和少突胶质细胞相关蛋白低表达等病理改变[9-12],提示白质紊乱可能参与SZ发病[13-14]。本研究拟采用C57BL/6J小鼠长期腹腔注射地卓西平马来酸盐(dizocilpine,MK-801)制备SZ动物模型,并研究该动物模型的行为学改变和胼胝体内髓鞘相关蛋白及髓鞘超微结构的改变,以期为SZ的白质改变假说寻找进一步的证据。
1 材料与方法
1.1 实验动物 8周龄雄性C57BL/6J小鼠(清洁级)48只(购自重庆医科大学实验动物中心),随机分为SZ慢性给药模型组(M1、M2、M3)和对照组,每组12只。实验前小鼠在动物房饲养至少3 d,进入研究时小鼠体重为20~25g。
1.2 药物及给药方法 MK-801购自美国Sigma公司,以生理盐水配成5mg/mL的储备液,后按比例稀释成不同浓度的工作液(每日现配现用)。M1~M3组小鼠分别腹腔注射(10mL/kg,q.d.)0.025mg/mL、0.050mg/mL和0.100mg/mL的MK-801,对照组小鼠则注射等体积生理盐水。每日下午1:00~2:00注射,共持续2周。
1.3 行为学实验
1.3.1 Morris水迷宫实验 模型制备第9天即开始水迷宫测试,为避免MK-801急性注射对测试造成影响,测试时间为每日上午9:00~12:00。实验周期共7天,前6天为隐匿平台期,第7天为撤平台实验。每次实验限时1min,记录小鼠逃避潜伏期、穿越原平台位置的次数及目标象限滞留时间等参数。
1.3.2 探孔实验 将小鼠置于孔板(UGO Basile,意大利)中央,安静环境下任其自由活动3~5min,记录其头伸入孔洞中的次数。
1.3.3 转棒实验 实验前1h训练小鼠1次,实验开始时将小鼠置于固定低转速(4 r/min)的转棒(UGO Basile,意大利)上适应条件,随后启动加速,4min内由4 r/min增加到40 r/min,记录小鼠在转棒上的停留时间。共测试3次,测试间隔至少15min。
1.4 免疫组化及电镜实验 模型制备第16天,行为学测试结束6h后取脑组织进行免疫组化染色和电镜实验。
1.4.1 免疫组化 5μm石蜡切片经脱蜡及PBS漂洗,抗原热修复20min,3%过氧化氢封闭10min;以髓鞘碱性蛋白抗体(anti-MBP,1:200稀释,Sigma-Aldrich公司)37℃孵育 1.5h,二抗孵育 30min后DAB显色。显微镜(Nikon,日本)下采图,并以Image-Pro Plus 6.0分析,MBP 染色系数=髓鞘染色OD值/灰质染色OD值。
1.4.2 电镜实验 将大脑半球沿冠状面切成1mm的连续切片,每只动物随机抽取4张脑组织切片,并于尾侧面随机叠加透明等距测试框,在测试点击中胼胝体的部位取1mm3大小的组织块。将胼胝体组织以电镜标本制备方法常规固定处理,按“球切法”(isector)包埋制备超薄切片,透射电镜下随机选取12个视野采图(放大20 000倍)。采用体视学方法[15]计数损伤神经纤维比例,有髓神经纤维损伤比例(%)=损伤有髓神经纤维总数/有髓神经纤维总数×100%。
1.5 统计学方法 采用SPSS 19.0进行统计分析,数据以均数±标准差(±s)表示。逃避潜伏期数据采用重复测量方差分析;其余数据采用单因素方差分析,并用Dunnett-t检验进行对照组和各模型组间的比较。检验水准α为0.05,双侧检验。
2 结果
2.1 行为学测试结果 注射MK-801后0.5h,小鼠自发活动及刻板性行为增加,M2和M3组小鼠出现后肢肌力障碍和明显的共济失调,1~2h后此症状消失。
2.1.1 水迷宫实验 隐匿平台实验阶段,MK-801处理因素主效应无统计学意义(F=0.761,P=0.522),时间效应具有统计学意义(F=127.361,P<0.001),但时间和处理的交互效应(day×group)无统计学意义(F=1.146,P=0.337),即时间因素的作用不随着分组的不同而不同。见表1。空间探索实验阶段,各组动物间目标象限停留时间(F=0.157,P=0.925)、穿越平台次数(F=0.220,P=0.882)、平均游泳速度(F=0.843,P=0.478)及游泳总路程(F=0.928,P=0.436)的差异均无统计学意义。见表2。
2.1.2 探孔实验 MK-801处理组小鼠经常出现在孔板中央静止不动的现象。单因素方差分析显示,各组间动物 3min(F=11.826,P<0.001)和 5min(F=9.549,P<0.001)探孔次数差异具有统计学意义。Dunnett-t检验示,M1(P=0.001)、M2(P=0.018)和 M3(P<0.001)组3min 探孔次数均低于对照组;但5min内探孔次数,仅M1(P=0.017)和M3(P<0.001)组探孔次数低于对照组,而M2组与对照组间差异无统计学意义(P=0.076)。见表3。
2.1.3 转棒实验 各组间小鼠在转棒上的停留时间差异无统计学意义(F=0.815,P=0.493)。见表4。
2.2 髓鞘形成相关蛋白MBP表达缺失和髓鞘损伤 免疫组化结果见图1,各模型组MBP表达较低,染色呈斑块状缺失,M1、M2和M3各模型组染色系数分别为(179±10)%、(235±7)%和(152±9)%;而对照组MBP表达完整,染色较深,染色系数为(288±18)%。单因素方差分析显示各组间MBP染色差异有统计学意义(F=29.269,P<0.001),Dunnett-t检验示,M1(P<0.001)、M2(P=0.005)和 M3 组(P<0.001)MBP 染色均低于对照组。电镜下髓鞘超微结构分析显示,对照组小鼠大脑胼胝体髓鞘结构完整,而各模型组小鼠大脑胼胝体髓鞘出现不同程度的板层分离、节段性脱髓鞘等病变。见图2。体视学计数及t检验显示,M3组小鼠胼胝体内损伤有髓神经纤维比例(22.42±4.24)%高于对照组(3.84±1.35)%,差异有统计学意义(P<0.001)。
表1 小鼠水迷宫隐匿平台实验逃避潜伏期(±s,单位:s)
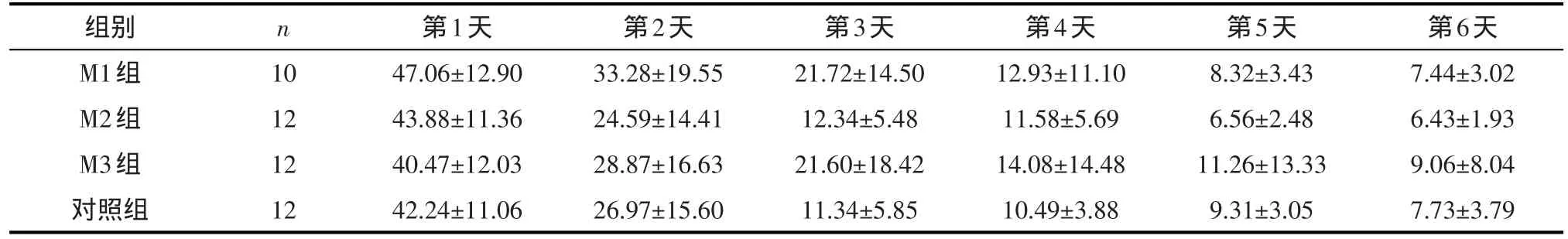
表1 小鼠水迷宫隐匿平台实验逃避潜伏期(±s,单位:s)
组别M1组M2组M3组对照组n 10 12 12 12第1天47.06±12.90 43.88±11.36 40.47±12.03 42.24±11.06第2天33.28±19.55 24.59±14.41 28.87±16.63 26.97±15.60第3天21.72±14.50 12.34±5.48 21.60±18.42 11.34±5.85第4天12.93±11.10 11.58±5.69 14.08±14.48 10.49±3.88第5天8.32±3.43 6.56±2.48 11.26±13.33 9.31±3.05第6天7.44±3.02 6.43±1.93 9.06±8.04 7.73±3.79
表2 小鼠水迷宫空间探索实验数据(±s)
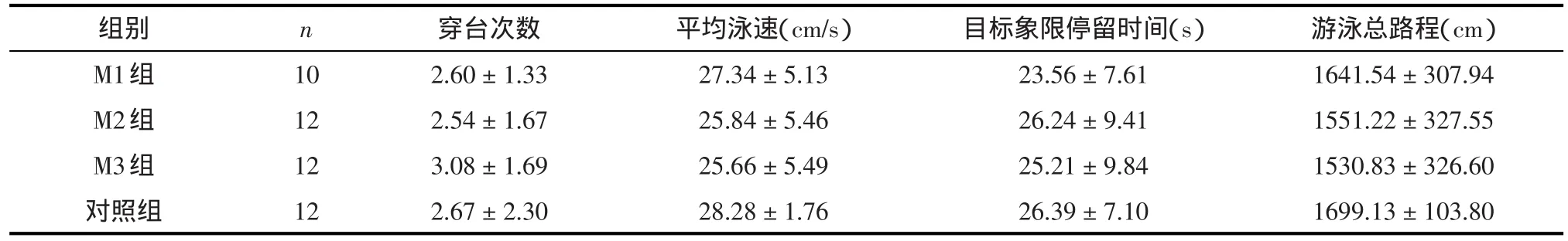
表2 小鼠水迷宫空间探索实验数据(±s)
组别M1组M2组M3组对照组n 10 12 12 12穿台次数2.60±1.33 2.54±1.67 3.08±1.69 2.67±2.30平均泳速(cm/s)27.34±5.13 25.84±5.46 25.66±5.49 28.28±1.76目标象限停留时间(s)23.56±7.61 26.24±9.41 25.21±9.84 26.39±7.10游泳总路程(cm)1641.54±307.94 1551.22±327.55 1530.83±326.60 1699.13±103.80
表3 小鼠探孔次数(±s)
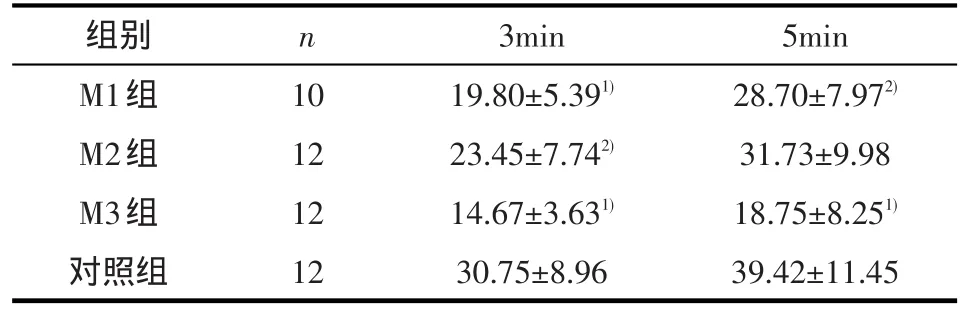
表3 小鼠探孔次数(±s)
1)与对照组比较,经Dunnett-t检验,P<0.01;2)与对照组比较,经Dunnett-t检验,P<0.05
组别M1组M2组M3组对照组n 10 12 12 12 3min 19.80±5.391)23.45±7.742)14.67±3.631)30.75±8.96 5min 28.70±7.972)31.73±9.98 18.75±8.251)39.42±11.45
表4 小鼠转棒上停留时间(±s,单位:s)
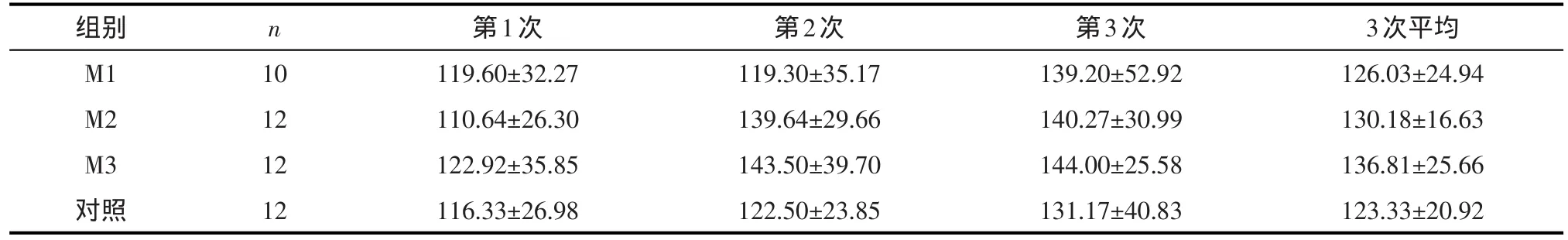
表4 小鼠转棒上停留时间(±s,单位:s)
组别M1 M2 M3对照n 10 12 12 12第1次119.60±32.27 110.64±26.30 122.92±35.85 116.33±26.98第2次119.30±35.17 139.64±29.66 143.50±39.70 122.50±23.85第3次139.20±52.92 140.27±30.99 144.00±25.58 131.17±40.83 3次平均126.03±24.94 130.18±16.63 136.81±25.66 123.33±20.92
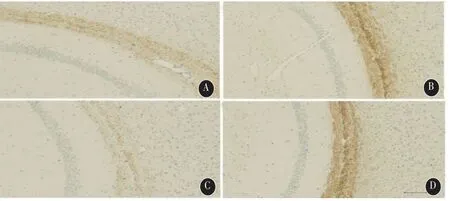
图1 不同剂量MK-801组小鼠胼胝体MBP免疫组化结果(标尺=100μm)A.M1组(MK-801 0.25mg/kg);B.M2组(MK-801 0.50mg/kg);C.M3组(MK-801 1.00 mg/kg);D.对照组
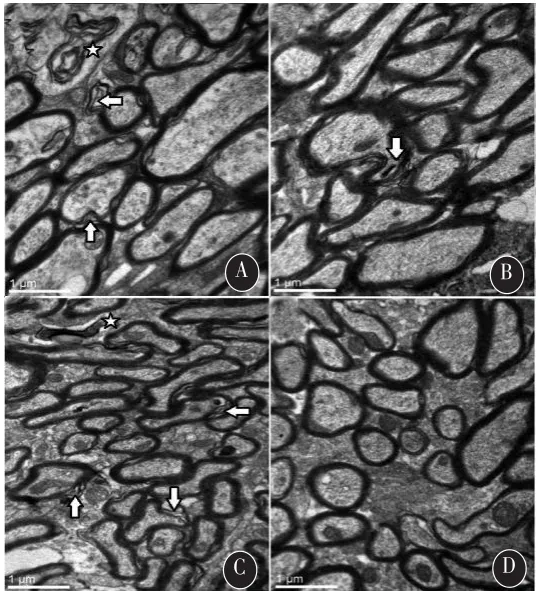
图2 不同剂量MK-801组小鼠胼胝体髓鞘结构(箭头示板层分离,星号示沃勒变性)A.M1组;B.M2组;C.M3组;D.对照组
3 讨论
以苯环己哌啶、MK-801等制备的SZ动物模型,因能较好地模拟SZ的阴性、阳性症状,被广泛应用于SZ发病机制的研究中[3-4,16-20]。以往研究显示,神经化学、解剖改变[3-4,17-20]及神经元死亡是MK-801诱发SZ的主要原因:Elhardt等[18]发现连续15天腹腔注射MK-801(0.1mg/kg)可引起C57乳鼠海马区域锥体神经元排列杂乱,细胞间复杂联系减少,细胞基底树突数量减少及长度变短;但Yu等[19]的研究却显示0.6mg/kg MK-801连续处理7天可增加C57小鼠前额叶皮质和腹侧被盖区神经元树突总长度;Okamura等[20]研究甚至发现MK-801可引起大鼠压后部皮质Ⅲ-Ⅳ层神经元内出现空泡。显然,研究者对MK-801诱导SZ的研究主要聚焦在突触和神经元上,很少关注白质改变。本研究首次在MK-801诱导的SZ小鼠大脑中发现MBP蛋白低表达,这与Lindahl等[21]和Zhang等[22]在PCP大鼠SZ模型上的研究结果一致;本研究尚发现MK-801可诱发胼胝体内髓鞘出现板层分离、节段性脱髓鞘等损伤改变。髓鞘结构在神经冲动传导和信息整合中发挥重要作用[13-14],胼胝体脱髓鞘改变可能是慢性腹腔注射MK-801诱导SZ的病因之一。
本研究中,MK-801注射后1~2h内(急性期)小鼠自发活动增加,0.50mg/kg和1.00mg/kg组小鼠尚出现后肢功能障碍和共济失调,这与苏允爱等[16]的研究结果一致;MK-801反复注射2周后小鼠表现出对新环境探索减少的SZ阴性症状,这与Yu等[19]的研究结果相似;转棒实验表明MK-801慢性期小鼠并无运动及协调能力障碍,这可排除运动障碍及不协调等因素对小鼠探孔次数减少造成影响,提示精神神经因素在其中起主要作用。本研究中,反复给予MK-801并未引起小鼠空间学习记忆能力的下降,与Li等[23]的研究结果不一致,这可能与测试时间及模型制备差异有关。Li等[23]采用未成年大鼠制备SZ模型,造模完成后进行水迷宫测试;本研究中,水迷宫测试在造模过程中(较Li等[23]的实验提前1周)进行,是因为拟在造模后最短时间内观察MK-801能否引发髓鞘损伤,避免髓鞘修复对其产生影响,这是本研究的不足之处。
MK-801诱导的SZ模型小鼠中髓鞘损伤及髓鞘蛋白表达下调的研究结果,从动物水平为白质/髓鞘功能紊乱参与SZ发病提供了进一步的证据,并拓展了该小鼠模型的应用。与神经元不能再生不同,髓鞘可以修复,倘若白质功能紊乱在SZ的发生中起作用,那少突胶质细胞及其形成的髓鞘就有望成为治疗SZ的潜在靶点[24]。MK-801反复给药通过何种途径诱发大脑白质/髓鞘损伤,大脑白质/髓鞘损伤又是如何参与SZ发病,尚需进一步的深入研究。
[1]Simpson EH,Kellendonk C,Kandel E.A possible role for the striatum in the pathogenesis of the cognitive symptoms of schizophrenia[J].Neuron,2010,65(5):585-596.
[2]Muguruza C,Moreno JL,Umali A,et al.Dysregulated 5-HT(2A)receptor binding in postmortem frontal cortex of schizophrenic subjects[J].Eur Neuropsypharmacol,2013,23(8):852-864.
[3]Neill JC,Barnes S,Cook S,et al.Animal models of cognitive dysfunction and negative symptoms of schizophrenia:Focus on NMDA receptor antagonism[J].Pharmacol Ther,2010,128(3):419-432.
[4]Mouri A,Noda Y,Enomoto T,et al.Phencyclidine animal models of schizophrenia:approaches from abnormality of glutamatergic neurotransmission and neurodevelopment[J].Neurochem Int,2007,51(2-4):173-184.
[5]Sanfilipo M,Lafargue T,Rusinek H,et al.Volumetric measure of the frontal and temporal lobe regions in schizophrenia:relationship to negative symptoms[J].Arch Gen Psychiatry,2000,57(5):471-480.
[6]McDonald C,Bullmore E,Sham P,et al.Regional volume deviations of brain structure in schizophrenia and psychotic bipolar disorder:computational morphometry study[J].Br J Psychiatry,2005,186:369-377.
[7]Zhou SY,Suzuki M,Hagino H,et al.Decreased volume and increased asymmetry of the anterior limb of the internal capsule in patients with schizophrenia[J].Biol Psychiatry,2003,54(4):427-436.
[8]Kubicki M,Park H,Westin CF,et al.DTI and MTR abnormalities in schizophrenia:Analysis of white matter integrity[J].Neuroimage,2005,26(4):1109-1118.
[9]Kerns D,Vong GS,Barley K,et al.Gene expression abnormalities and oligodendrocyte deficits in the internal capsule in schizophrenia[J].Schizophr Res,2010,120(1-3):150-158.
[10]Regenold WT,Phatak P,Marano CM,et al.Myelin staining of deep white matter in the dorsolateral prefrontal cortex in schizophrenia,bipolar disorder,and unipolar major depression[J].Psychiatry Res,2007,151(3):179-188.
[11]Hof PR,Haroutunian V,Copland C,et al.Molecular and cellular evidence for an oligodendrocyte abnormality in schizophrenia[J].Neurochem Res,2002,27(10):1193-1200.
[12]Takahashi N,Sakurai T,Davis KL,et al.Linking oligodendrocyte and myelin dysfunction to neurocircuitry abnormalities in schizophrenia[J].Prog Neurobiol,2011,93(1):13-24.
[13]Nave KA.Myelination and support of axonal integrity by glia[J].Nature,2010,468(7321):244-252.
[14]Fields RD.White matter in learning,cognition and psychiatric disorders[J].Trends Neurosci,2008,31(7):361-370.
[15]Tang Y,Nyengaard JR.A stereological method for estimating the total length and size of myelin fibers in human brain white matter[J].J Neurosci Methods,1997,73(2):193-200.
[16]苏允爱,司天梅,周东风,等.MK-801建立谷氨酸功能低下精神分裂症小鼠模型的研[J].中国神经精神疾病杂志,2006,32(6):558-560.
[17]Guo C,Yang Y,Su Y,et al.Postnatal BDNF expression profiles in prefrontal cortex and hippocampus of a rat schizophrenia model induced by MK-801 administration[J].J Biomed Biotechnol,2010,2010:783297.
[18]Elhardt M,Martinez L,Tejada-Simon MV.Neurochemical,behavioral and architectural changes after chronic inactivation of NMDA receptors in mice[J].Neurosci Lett,2010,468(2):166-171.
[19]Yu J,Qi D,Xing M,et al.MK-801 induces schizophrenic behaviors through downregulating Wnt signaling pathways in male mice[J].Brain Res,2011,1385:281-292.
[20]Okamura N,Reinscheid RK,Ohgake S,et al.Neuropeptide S attenuates neuropathological,neurochemical and behavioral changes induced by the NMDA receptor antagonist MK-801[J].Neuropharmacology,2010,58(1):166-172.
[21]Lindahl JS,Kjellsen BR,Tigert J,et al.In utero PCP exposure alters oligodendrocyte differentiation and myelination in developing rat frontal cortex[J].Brain Res,2008,1234:137-147.
[22]Zhang R,He J,Zhu S,et al.Myelination deficit in a phencyclidine-induced neurodevelopmental model of schizophrenia[J].Brain Res,2012,1469:136-143.
[23]Li JT,Su YA,Guo CM,et al.Persisting cognitive deficits induced by low-dose,subchronic treatment with MK-801 in adolescent rats[J].Eur J Pharmacol,2011,652(1-3):65-72.
[24]Takahashi N,Sakurai T.Roles of glial cells in schizophrenia:possible targets for therapeutic approaches[J].Neurobiol Dis,2013,53:49-60.

