侧脑室内促肝细胞生长素对脑积水大鼠的干预作用
张绍林刘锋△王占祥 刘希尧朱宏伟沈上杭徐昊
脑脊液(cerebro-spinal fluid,CSF)循环吸收通路纤维化引起CSF回流和吸收障碍,在脑积水形成过程中的作用倍受关注[1,2],已从尸体解剖[3]和动物模型[4]中找到了纤维化的组织学证据。研究表明,转化生长因子β1(transforming growth foctor beta 1,TGF-β1)是一种极其重要的强效致纤维化因子,可刺激细胞外基质(extracellular matrix,ECM)成分的表达并沉积于CSF循环通路,引起CSF回流和吸收障碍。ECM蛋白的降解主要由基质金属蛋白酶(matrix metalloproteinases,MMPs)介导,在MMPs中亦已证明MMP-2和MMP-9能降解由TGF-β1信号通路产生的ECM成分[5]。肝细胞生长因子(hepatocyte growth factor,HGF)与TGF-β1的生物活性在很多方面是互逆的,同时HGF也可促进多种细胞系表达MMP-9,进而促进EMC的分解代谢[6,7]。促肝细胞生长素(hepatocyte growth-promoting factor,pHGF)具有促进细胞分裂增值,改善器官纤维化等作用,与HGF有相似的作用[8-10]。本研究通过在制作脑积水模型的同时给予侧脑室pHGF持续干预,探讨其对脑积水的干预作用和可能的作用机理,为脑积水的局部治理提供理论依据。
1 材料与方法
1.1 研究对象 清洁级健康雄性SD大鼠40只,体质量(250g±10)g,动物生产许可证号:SCXK(沪)2007-0005(上海斯莱克实验动物有限责任公司),使用许可证号:SYXK(闽)2008-0003(厦门大学实验动物中心)。采用随机数字表法分成2组:pHGF干预组(实验组,n=20),生理盐水干预组(对照组,n=20)。试剂与设备:pHGF(长春富春制药有限公司);高岭土(西陇化工股份有限公司);鼠TGF-β1和HGF单克隆抗体、羊MMP-9多克隆抗体(美国Santa cruz公司);即用型免疫组织化学检测试剂盒、血清封闭液(福建迈新生物技术开发有限公司);大鼠脑立体定位仪(安徽省淮北正华生物仪器设备有限公司);Alzet2002型植入式微渗透泵(美国Alzet公司);磁共振仪(7T,美国VARIAN公司)。
1.2 动物模型建立及干预 取健康SD雄性大鼠,称重,10%水合氯醛腹腔注射(300mg/kg)麻醉,剃除额顶部毛发,头部固定于大鼠脑立体定位仪上,调整门齿杆及双侧耳杆保持大鼠头顶部水平位,碘伏常规消毒铺巾;头顶正中切口切开头皮约1.5cm,钝性分离皮下组织,暴露前囟;取前囟后0.8 mm,中线旁开1.6 mm,钻孔至硬脑膜;微量进样器吸取3%灭菌高岭土生理盐水混悬液30μL,固定于立体定向仪上,垂直进针约3.7 mm,以10μL/min速率缓慢注入;缓慢拔出微量进样器后,将Alzet微渗透泵脑灌流插管垂直插入约3.7mm,耳脑胶固定,套管通过导管与微渗透泵链接,渗透泵置于肩胛骨之间,实验组渗透泵储药囊中装满40mg/mL的pHGF,对照组渗透泵储药囊中装满生理盐水;固定渗透压泵,缝合皮肤;术后每饮水瓶添加阿莫西林胶囊1粒抗炎。
1.3 Morris水迷宫检查 术后第10天,利用Morris水迷宫实验检测大鼠空间学习记忆能力。Morris水迷宫直径 1.5m,高 50cm,平台高 30cm、直径10cm,水深42cm,水中加入适量墨汁使其不透明,保持水温在22℃±1℃,水迷宫外视觉线索相对固定。将Morris水迷宫以水池边缘相等分布的4个点作为入水点,将圆形水池等分为4个象限,平台位于第一个象限内(目标象限),在水面下2cm。术后11d分别行:①定向航行实验,随机选择入水点,将大鼠面向池壁放入水中,允许大鼠用60s找到隐藏在水下的逃逸平台并在平台上停留15s(即逃逸潜伏期);如果在规定时间内找不到平台(逃逸潜伏期以60s记),实验者帮助其找到平台并允许在平台上停留15s,每天实验3次,每次间隔1h,持续4d;②空间探索实验:定向航行实验完成后,次日行空间探索实验。移除平台,动物从远离平台的最远入水点放入,让其自由游泳,时间为60s。整个实验过程均用摄像系统进行监控,并记录各象限的游泳时间分布。
1.4 磁共振成像(MRI)检查 术后第16 d行MRI检查,扫描参数如下:T2WI冠状面,层厚1mm,层数 25,TE50ms,TR5000ms,FOV5.0cm×5.0cm,Matrix256×256。根据大鼠三脑室层面侧脑室最大横径[11],<1.0mm 为正常,≥1.0~1.5mm 为轻度脑积水,>1.5~2.0mm 为中度脑积水,>2.0mm 为重度脑积水。计算侧脑室指数=侧脑室最大横径/同一层面脑组织最大横径。
1.5 RT-PCR检测脑组织中TGF-β1、HGF和MMP-9的mRNA水平 MRI检测后24h内处死大鼠,取脑,按照说明书抽提RNA,测定RNA纯度、浓度后进行RT-PCR。引物由广州英韦创津生物科技有限公司合成,具体序列如下:TGF-β1:5'-TGAGTGGCTGTCTTTTGACG-3',5'-TGGTTGTAGAGGGCAAGGAC-3';HGF:5'-ACAGCTTTTTGCCTTCGAGCTA-3',5'-CATCAAAGCCCTTGTCGGGATA-3';MMP-9:5'-CACTGTAACTGGGGGCAACT-3',5'-CAGAAGGACCAGCAGTAGGG-3';β-actin:5'-CAACCTTCTTGCAGCTCCTC-3',5'-CCCTCATAGATGGGCACAGT-3'。反应条件为95℃预变性30s,95℃变性5s,55~65℃退火15s,72℃延伸20s,共 45个循环。以β-actin基因作为内参照,采用相对定量2-△△Ct法计算脑组织中TGF-β1、HGF和MMP-9的mRNA的相对表达量。计算公式:目的基因相对表达量=2-△△Ct,△△Ct=(待测组目的基因平均 Ct值-待测组内参基因平均Ct值)-(对照组目的基因平均Ct值-待测组内参基因平均Ct值)。
1.6 HE和免疫组化检查 脑组织置于10%中性福尔马林固定液固定24~48h,石蜡包埋,后切成5µm切片。HE染色观察室周及额叶皮质的病理改变;免疫组化采用即用型非生物素法广谱试剂盒法测定脑组织中TGF-β1、HGF和MMP-9的蛋白表达(具体实验步骤参照抗体和试剂的说明书进行操作),染色以细胞胞浆或胞核中出现黄色或棕黄色颗粒为阳性反应,定性观察其蛋白表达变化。随机观察5个视野(400倍),分别计数有染色的阳性细胞,将各视野中阳性细胞的平均百分数作为该切片的阳性细胞百分数。
1.7 统计学处理 应用GraphPad Prism®(Graph-Pad,Inc.,La Jolla,美国)软件进行统计学分析。实验数据以均数±标准差表示,两组数据均数之间的比较采用t检验,多组数据之间均数的差异采用单因素方差分析;两组数据间率的比较采用Fisher精确概率法;检测水准α=0.05。
2 结果
2.1 实验动物一般情况 实验过程中3只大鼠死于麻醉和手术创伤(实验组1只,对照组2只)。术后早期主要表现为:进食减少,体重减轻,活动减少,攻击性下降,咳嗽,易怒,尿量增加,后腿无力,眼、鼻血性分泌物,驼背等,这些症状随后可缓慢自发消失。两组实验动物之间没有明显差异。
2.2 Morris水迷宫实验结果 在定向航行实验中,实验组大鼠找到平台的潜伏期短于对照组,差异均有统计学意义(t1d=4.536,t2d=2.487,t3d=2.741,t4d=6.430;P 0.05),如表1 所示。在空间探索实验中,实验组动物在目标象限(第一象限)游泳时间长于对照组,两组之间差异有统计学意义(t1=6.845,P<0.05);且实验组在对侧象限(第三象限)游泳时间短于对照组,差异有统计学意义(t3=2.380,P<0.05),如表2所示。

表1 定向航行实验中对照组和实验组不同时间的潜伏期
2.3 MRI检查结果对照组均形成了不同程度的脑积水:重度10只,中度5只,轻度3只,大部分呈现脑室系统明显扩大,室周组织受压、水肿(图1A);而实验组脑室扩大相对较轻(图1B):重度脑积水5只,中度6只,轻度脑积水6只,无明显脑积水2只,大部分无明显室周组织水肿。对照组侧脑室指数为(0.61325±0.11691),实验组侧脑室指数为(0.47625±0.14116),两组间侧脑室指数比较,差异有统计学意义(t=3.205,P<0.05)。
2.4 脑组织中TGF-β1、HGF和MMP-9的mRNA检测 RT-PCR结果,如表3所示,实验组TGF-β1的mRNA表达水低于对照组,两组之间的差异有统计学意义(t=22.359,P<0.05)。而 HGF 和 MMP-9 的mRNA表达水平均高于对照组,差异均有统计学意义(t=17.496,P<0.05和t=16.155,P<0.05)。
2.5 HE和免疫组化检查结果 HE染色示,对照组脑室周围组织肿胀、结构紊乱及胶质增生带,胶质细胞增生和细胞水肿、液化、变性;与此相反,实验组相对较轻,如图2所示。
免疫组化结果提示,对照组和实验组大鼠脑室周围及额叶皮质中TGF-β1的阳性表达率分别为76.2%和30.6%,经Fisher精确概率法检验两组间差异有统计学意义(P<0.05)。而HGF和MMP-9在对照组和实验组的阳性表达率分别为49.2%、91.2%和52.4%、94.8%,经Fisher精确概率法检验差异均有统计学意义(P<0.05)。如图3所示。

图1 MRI检测对照组与实验组大鼠脑积水表现
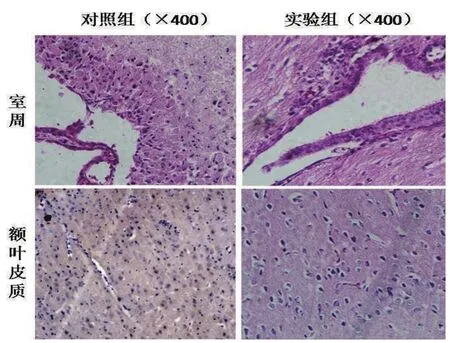
图2 大鼠脑室周围和额叶皮质组织病理学改变(HE×400倍)

表2 空间探索实验中对照组和实验组各象限的游泳时间分布

表3 实验组和对照组中TGF-β1、HGF和MMP-9的mRNA相对表达水平
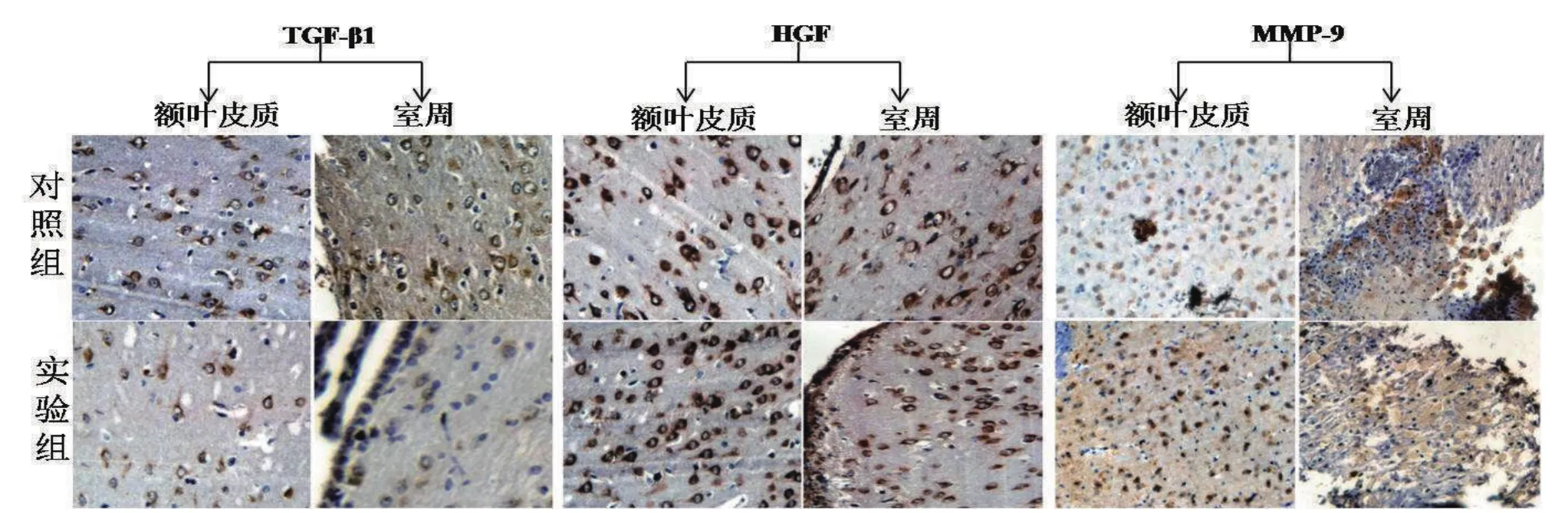
图3 免疫组化显示实验组和对照组中TGF-β1、HGF和MMP-9的表达(ICH×400倍)
3 讨论
TGF-β1可促进ECM蛋白的合成、抑制MMPs的活性和表达,在其他纤维化疾病中得到了广泛研究[12-14],在脑积水形成过程中同样起重要作用。ECM沉积和MMPs活性增加,是纤维化疾病的共同病理特征,脑积水时同样存在ECM的过度沉积,ECM蛋白的降解主要由MMPs介导。研究发现MMP-9的活性高低与脑室出血后脑积水的自行缓解有关,MMP-9高表达的脑积水患者可逃避分流术[15]。Jeong等[16]研究发现HGF可降低脊髓损伤后的胶质瘢痕形成和促进轴突生长,现已证明是一种很有前景的抗纤维化因子,已用于多种纤维化疾病的抗纤维化研究[17-19]等。
本研究中对照组大鼠MRI显示均形成了不同程度的脑积水,病理学检查可见室周组织肿胀、结构紊乱及胶质增生带,明显的胶质细胞增生和细胞水肿、液化;与此相反,实验组大鼠形成的脑积水相对较轻,脑室扩张较小,病理学改变较对照组明显减轻。说明脑积水时存在局部炎症反应和胶质增生,符合纤维化特征,而pHGF具有改善局部炎症和胶质增生,降低纤维化作用,从而延缓脑积水的形成和进展。TGF-β1、HGF和MMP-9在脑积水时表达均升高,可能是因为脑积水时高表达的TGF-β1促进ECM沉积,沉积的ECM反馈性诱导HGF和MMP-9高表达,继而促进ECM降解。免疫组化和PCR结果均显示实验组TGF-β1表达被抑制,HGF和MMP-9表达进一步升高,与pHGF在其他纤维化疾病中的研究报道一致[20-22]。因此,我们推测pHGF是通过下调TGF-β1表达、上调HGF和MMP-9表达,减轻局部炎症反应和胶质增生来发挥抗脑积水的形成作用。但在脑积水形成演变过程中,各时期哪种作用占主导仍需进一步研究。
脑积水时因增大的脑室对周围的组织、血管压迫,形成纤维瘢痕,以及组织缺血缺氧,引起空间学习记忆能力改变[23]。实验发现对照组大鼠空间学习记忆能力明显受损,经pHGF干预的大鼠空间学习记忆能力受损相对较轻,说明pHGF有助于改善空间学习、记忆能力,与HGF干预脑积水有着异曲同工的效果[24]。其作用机理,我们分析可能是通过抑制组织纤维化和胶质增生,影响局部炎症等介质的释放,减轻扩大的脑室对脑组织的压迫,减轻了脑水肿等,直接或间接改善其空间学习记忆能力。
综上所述,外源性pHGF对高岭土诱导的脑积水大鼠具有一定的治疗作用,其作用机制可能是一方面通过抑制TGF-β1表达,促进HGF和MMP-9表达来实现;另一方面减轻CSF循环通道的炎症反应和胶质增生,发挥抗纤维化作用。同时表明脑积水局部干预切实可行,但选择何种高效的干预介质,仍需要进一步探索。
[1]Silverio-Ruiz KG,Martinez AE,Garlet GP,et al.Opposite ef-fects of bFGF and TGF-beta on collagen metabolism by human periodontal ligament fibroblasts[J].Cytokine,2007,39(2):130-137.
[2]宫国旗,孟辉,夏永智,等.大鼠实验性脑室出血后慢性脑积水动物模型的建立及病理学观察[J].第三军医大学学报,2008,30(10):969-972.
[3]Motohashi O,Suzuki M,Shida N,et al.Subarachnoid haemorrhage induced proliferation of leptomeningeal cells and deposition of extracellular matrices in the arachnoid granulations and subarachnoid space[J].Acta neurochirurgica,1995,136(1-2):88-91.
[4]Slobodian I,Krassioukov-Enns D,Del Bigio MR.Protein and synthetic polymer injection for induction of obstructive hydrocephalus in rats[J].Cerebrospinal Fluid Res,2007,4:9.
[5]Visse R,Nagase H.Matrix metalloproteinases and tissue inhibitors of metalloproteinases structure,function,and biochemistry[J].Circulation research,2003,92(8):827-839.
[6]Gong R,Rifai A,Tolbert E M,et al.Hepatocyte growth factor modulates matrix metalloproteinases and plasminogen activator/plasmin proteolytic pathways in progressive renal interstitial fibrosis[J].Journal of the American Society of Nephrology,2003,14(12):3047-3060.
[7]Liu Y,Rajur K,Tolbert E,et al.Endogenous hepatocyte growth factor ameliorates chronic renal injury by activating matrix degradation pathways[J].Kidney international,2000,58(5):2028-2043.
[8]Liu XL,Sato S,Dai W,et al.The protective effect of hepatocyte growth-promoting factor(pHGF)against hydrogen peroxide-induced acute lung injury in rats[J].Medical Electron Microscopy,2001,34(2):92-102.
[9]Dai W,Sato S,Asano G.The protective effect of hepatocyte growth-promoting factor(pHGF)against carbon tetrachlorideinduced acute liver injury in rats.II.Protective effects on cell membrane injury[J].J Nihon Med Sch,2001,68(2):154-164.
[10]Sato S,Dai W,Liu XL,et al.The protective effect of hepatocyte growth-promoting factor(pHGF)against carbon tetrachlorideinduced acute liver injury in rats:an ultrastructural study[J].Medical Electron Microscopy,1999,32(3):184-192.
[11]Kim DS,Oi S,Hidaka M,et al.A new experimental model of obstructive hydrocephalus in the rat:the micro-balloon technique[J].Child's Nervous System,1999,15(5):250-255.
[12]Watanabe T,Tajima H,Hironori H,et al.Sodium valproate blocks the transforming growth factor(TGF)-β1 autocrine loop and attenuates the TGF-β1-induced collagen synthesis in a human hepatic stellate cell line[J].International journal of molecular medicine,2011,28(6):919-925.
[13]Lei B,Hitomi H,Mori T,et al.Effect of Efonidipine on TGF-β 1-Induced Cardiac Fibrosis Through Smad2-Dependent Pathway in Rat Cardiac Fibroblasts[J].Journal of pharmacological sciences,2011,117(2):98-105.
[14]Biernacka A,Dobaczewski M,Frangogiannis NG.TGF-β signaling in fibrosis[J].Growth Factors,2011,29(5):196-202.
[15]Okamoto T,Takahashi S,Nakamura E,et al.Matrix metalloproteinases in infants with posthemorrhagic hydrocephalus[J].Early human development,2008,84(2):137-139.
[16]Jeong SR,Kwon MJ,Lee HG,et al.Hepatocyte growth factor reduces astrocytic scar formation and promotes axonal growth beyond glial scars after spinal cord injury[J].Experimental neurology,2012,233(1):312-322.
[17]Ruppert C,Markart P,Wygrecka M,et al.Role of coagulation and fibrinolysis in lung and renal fibrosis[J].Hamostaseologie,2008,28(1-2):30-32.
[18]Bogatkevich GS,Ludwicka-Bradley A,Highland KB,et al.Down-regulation of collagen and connective tissue growth factor expression with hepatocyte growth factor in lung fibroblasts from white scleroderma patients via two signaling pathways[J].Arthritis&Rheumatism,2007,56(10):3468-3477.
[19]Jones CN,Tuleuova N,Lee JY,et al.Cultivating hepatocytes on printed arrays of HGF and BMP7 to characterize protective effects of these growth factors during in vitro alcohol injury[J].Biomaterials,2010,31(23):5936-5944.
[20]朱雪荣.促肝细胞生长素研究进展与临床应用[J].中国医院用药评价与分析,2007,7(6):415-417.
[21]陈丽平,叶凡,王保兴.促肝细胞生长素对单侧输尿管结扎大鼠肾间质纤维化的干预作用[J].中国血液净化,2009,8(5):260-263.
[22]周丹,王宏伟,吕福祯.促肝细胞生长素对大鼠肺纤维化的干预研究[J].哈尔滨医科大学学报,2008,42(6):578-582.
[23]Owler BK,Pena A,Momjian S,et al.Changes in Cerebral Blood Flow During Cerebrospinal Fluid Pressure Manipulation in Patients With Normal Pressure Hydrocephalus:A Methodological Study[J].Journal of Cerebral Blood Flow&Metabolism,2004,24(5):579-587.
[24]Tada T,Zhan H,Tanaka Y,et al.Intraventricular administration of hepatocyte growth factor treats mouse communicating hydrocephalus induced by transforming growth factor beta1[J].Neurobiol Dis,2006,21(3):576-586.

