卡维地洛联合特布他林对心肌梗死大鼠心功能的影响及其作用机制
刘 艳,高宇平,吕吉元,李学文,王丽霞,阴艳萍
大规模的临床试验证明,β受体阻滞剂可改善心肌梗死患者的预后,降低病死率[1]。卡维地洛是一种非特异性肾上腺素能受体阻滞剂,可阻滞β1-受体、β2-受体、α1-受体,是一种强效氧自由基清除剂[2],除具有阻断交感神经能活性作用外,其特有的抗氧化、抗增殖、抗凋亡作用能够产生更完全的心肌保护作用[3]。长时间激动β1-受体、β2-受体对心肌细胞将产生不同影响:β1-受体诱导细胞肥大和凋亡,β2-受体则促使细胞存活[4];即理论上长时间对β2-受体阻滞有抑制心肌细胞凋亡、抑制心肌重塑的不利作用。本实验旨在研究β2-受体激动剂(特布他林)联合卡维地洛的抗氧化、抗凋亡作用,及其对心肌梗死的影响,从而推断其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠50只,体重250g~300g,由山西医科大学实验动物中心提供。
1.1.2 主要药品、试剂 卡维地洛片(齐鲁制药有限公司),特布他林片(无锡阿斯利康制药有限公司)。谷胱甘肽试剂盒(碧云天生物技术研究所)。辣根过氧化物酶标记的羊抗鼠IgG(Pieree公司)。β-actin抗体(Sanla Cruz)。
1.1.3 主要仪器 HX-100E型小动物呼吸机(成都泰盟科技有限公司)。多通道生理信号采集处理系统(成都仪器厂)。AE33型超声仪(飞利浦公司)。台式离心机(上海安亭仪器厂)。电泳仪和电泳槽(北京六一仪器厂)。转膜仪(Bio-RADCo.LTD)。
1.2 方法
1.2.1 模型制备 SD大鼠10%水合氯醛(300mg/kg),腹腔注射麻醉。连接心电图,气管内插管,连接至动物呼吸机。在胸骨左缘3、4肋间切开约2cm,剥离心包膜,暴露心脏,以7/0双针缝线在左心耳下缘约2mm处结扎左冠状动脉前降支制成心梗模型[5]。假手术组于心脏相同部位穿线但不结扎。
1.2.2 动物分组及给药 实验取模型大鼠38只,随机分为安慰剂组(n=10)、卡维地洛组(n=10)、联合治疗组(n=10)。另设假手术组(n=8)作为对照组。手术1周后开始以灌胃方式给药,卡维地洛组给予卡维地洛生理水溶液8mg/kg,一日两次。联合治疗组给予卡维地洛生理水溶液8mg/kg,特布他林生理水溶液2mg/kg,一日两次。安慰剂组及假手术组均按体重给予适量生理盐水,一日两次。
1.2.3 检测指标 ①超声心动图,干预8周后行超声心动图检查。探头(频率10MHz)在二维超声引导下取左室长轴切面测量左心室舒张末期内径(LVEDd),左室收缩末期内径(LVESd),计算射血分数(EF)和短轴缩短率(FS)。②血流动力学检测。大鼠称重,麻醉,导管内充满肝素,右颈总动脉逆行插管至左心室,另一端连接压力换能器多导生物信号记录仪,记录左室收缩压(LVSP),左室舒张末压(LVEDP),左室峰压上升、下降最大速率(±dp/dt),心率(HR),外周平均动脉压(MBP)。③心肌组织中还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)测定:有创血流动力学测定后,处死大鼠,取适量左室心肌组织,保存于-70℃冰箱。用GSH和GSSG检测试剂盒计算总GSH及GSSG的含量[6]。④心肌组织中bcl-2蛋白质表达:取保存于-70℃冰箱,用 Westem blot法描计,用photoshop7.0软件计算bcl-2蛋白质表达。
1.3 统计学处理 使用SPSS 17.0处理,数据以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较用LSD检验。
2 结 果
2.1 超声心动图检测 安慰剂组LVEDd、LVESd明显大于假手术组(P<0.05),EF、FS则明显低于假手术组(P<0.05)。药物治疗组较安慰剂组LVEDd、LVESd缩小(P<0.05),EF、FS提高(P<0.05)。联合治疗组较卡维地洛组LVEDd、LVESd更小(P<0.05),EF、FS更高(P<0.05)。详见表1。
表1 各组大鼠超声心动图指标测定结果(±s)
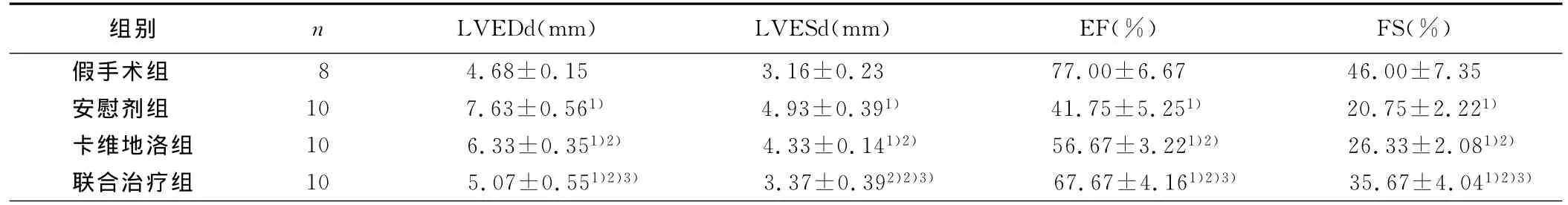
表1 各组大鼠超声心动图指标测定结果(±s)
与假手术组比较,1)P<0.05;与安慰剂组比较,2)P<0.05;与卡维地洛组比较,3)P<0.05
组别 n LVEDd(mm) LVESd(mm) EF(%) FS(%)假手术组8 4.68±0.15 3.16±0.23 77.00±6.67 46.00±7.35安慰剂组 10 7.63±0.561) 4.93±0.391) 41.75±5.251) 20.75±2.221)卡维地洛组 10 6.33±0.351)2) 4.33±0.141)2) 56.67±3.221)2) 26.33±2.081)2)联合治疗组 10 5.07±0.551)2)3) 3.37±0.392)2)3) 67.67±4.161)2)3) 35.67±4.041)2)3)
2.2 血流动力学检测 安慰剂组血流动力学指标较假手术组明显恶化(P<0.01);药物干预组较安慰剂组平均动脉压差异无统计学意义,心功能指标改善(P<0.05);联合治疗组较卡维地洛组心功能指标进一步改善(P<0.05)。详见表2。
表2 各组大鼠血流动力学检测结果(±s)

表2 各组大鼠血流动力学检测结果(±s)
与假手术组比较,1)P<0.05;与安慰剂组比较,2)P<0.05;与卡维地洛组比较,3)P<0.05
组别 n HR(次/min) MBP(mmHg) LVSP(mmHg) LVEDP(mmHg) +dp/dt(mmHg/s) -dp/dt(mmHg/s)假手术组 8 355.00±13.53 103.67±7.09 135.67±5.86 8.07±4.54 3 214.67±33.95 1578.00±66.78安慰剂组 10 299.00±5.071) 85.00±4.581) 112.67±3.061) 20.11±0.401) 2 223.67±29.261) 1066.33±49.661)卡维地洛组 10 310.33±10.601) 89.67±1.531) 123.33±2.521)2) 18.15±0.161)2) 2 488.67±37.011)2)1 358.33±37.811)2)联合治疗组 10 340.00±13.232)3) 90.67±5.131) 133.33±3.062)3) 14.25±1.011)2)3)2 570.67±22.681)2)3)1 515.33±25.322)3)
2.3 心肌组织中 GSH、GSSG及凋亡蛋白(bcl-2)测定 安慰剂组较假手术组GSH明显减少,GSSG明显增加(P<0.01),药物治疗组较安慰剂组GSH明显增加,GSSG明显减少(P<0.01),联合治疗组较卡维地洛组GSH明显增加,GSSG明显减少(P<0.01);安慰剂组与假手术组相比较,bcl-2明显减少(P<0.01),药物干预组与安慰剂组相比较,bcl-2均有增加(P<0.01)。联合治疗组与卡维地洛组相比较,bcl-2进一步增加(P<0.05)。
表3 各组大鼠心肌组织中GSH/GSSG及凋亡蛋白(bcl-2)测定结果(±s)
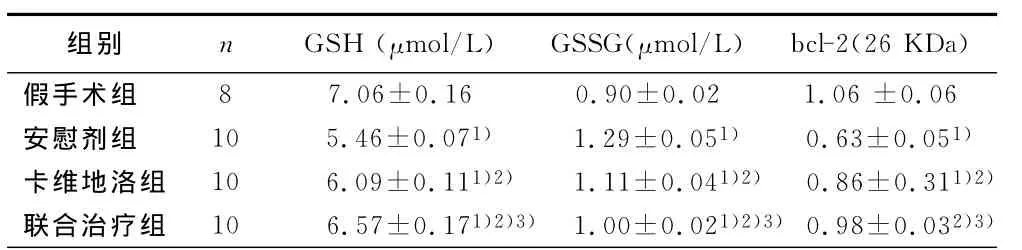
表3 各组大鼠心肌组织中GSH/GSSG及凋亡蛋白(bcl-2)测定结果(±s)
与假手术组比较,1)P<0.01;与安慰剂组比较,2)P<0.01;与卡维地洛组比较,3)P<0.05
组别 n GSH (μmol/L) GSSG(μmol/L) bcl-2(26KDa)假手术组8 7.06±0.16 0.90±0.02 1.06±0.06安慰剂组 10 5.46±0.071) 1.29±0.051) 0.63±0.051)卡维地洛组 10 6.09±0.111)2) 1.11±0.041)2) 0.86±0.311)2)联合治疗组 10 6.57±0.171)2)3)1.00±0.021)2)3) 0.98±0.032)3)
3 讨 论
本实验采用结扎冠状动脉前降支的方法制备大鼠心梗模型,心梗后对心功能影响的主要病理基础是心梗后心肌重塑,即心梗后发生的左心室进行性扩张和外形改变[7]。一般认为心梗后心肌细胞的坏死是导致左心室进行性扩张和外形改变主要病理机制,而近年来研究证明大鼠急性心肌梗死后,梗死区心肌细胞坏死和疤痕形成的同时,梗死/疤痕区、梗死边缘区和非梗死区均有不同比例的心肌细胞发生凋亡[8],因此心梗后的心肌细胞凋亡被认为是心肌细胞坏死之外引起左心室重塑和进行性心功能恶化的一个重要因素[9,10],即阻止心肌细胞凋亡,可减轻左心室重塑,改善心功能[11]。心梗后细胞凋亡的机制有很多,而氧化应激诱导的细胞凋亡在心梗动物模型中得到证实[12],应用抗氧化剂或还原性药物增加谷胱甘肽的合成,或者维持谷胱甘肽在还原状态可阻断自由基诱导细胞凋亡的进展[13],从而减轻左心室重塑,改善心功能。
β受体阻滞剂广泛应用于心梗及其后发生的心力衰竭的治疗,动物实验和临床研究表明[14-16],β受体阻滞剂能降低心肌耗氧量,缩小梗死面积,减轻左心室重塑,改善心功能。β受体阻滞剂发挥上述作用的主要机制是通过β-受体阻滞的作用,减慢心率,降低左心室充盈压和前负荷,降低舒张期室壁张力,减少心肌耗氧量和增加心肌供氧,以及抑制儿茶酚胺对心脏的直接毒性作用等。卡维地洛作为一种非特异性肾上腺素能受体阻滞剂,可阻滞β1-受体、β2-受体、α1-受体,其与美托洛尔相比,能更大程度地增加心肌收缩力,改善心功能,显著降低患者的死亡危险度[17],原因可能在于其特有的抗氧化、抗增殖、抗凋亡作用[3],但长时间对β2-受体的阻滞有抑制心肌细胞凋亡、抑制心肌重塑的不利作用,因此加用适量的β2-受体激动剂加强其抗氧化、抗凋亡作用。
氧化应激和细胞凋亡在急性心梗的发病和疾病的进程中均扮演了重要的角色[18]。GSH和GSSG是组成细胞内重要的氧化还原对,在细胞的氧化应激中发挥重要作用。本研究提示心梗8周后GSH明显减少,GSSG增加,药物治疗组较安慰剂组GSH明显增加,GSSG明显减少,以联合治疗组显著,说明特布他林能够进一步加强卡维地洛的抗氧化作用;bcl-2具有抗细胞凋亡作用,影响着细胞的生存与凋亡[19]。心肌细胞凋亡蛋白(bcl-2)的结果表明:单用卡维地洛或联用特布他林治疗8周后,bcl-2表达均较安慰剂组明显增高,且以联合治疗组显著。因此推测选择性β2AR激动剂可加强非选择性β1AR阻滞剂的抗氧化、抗凋亡作用,从而减轻心肌重塑,进一步改善心功能。但β2AR具体抗氧化、抗凋亡机制尚不完全明了,有待进一步深入研究。相关研究表明β2AR能同时与Gs和Gi发生耦联,且以后者(抑制细胞凋亡作用)为主,因此激动β2AR的综合作用表现为抗凋亡及保护心脏[20]。
[1] CIBIS-Ⅱ Investigators and Committees.The cardiac insufficiency bisoprolol study Ⅱ (CIBIS-Ⅱ):A randomised trial[J].Lancet,1999,353:9-13.
[2] Yue TL,Lysko PG,Barone FC,et al.Carvedilol,a new antihypertensive drug with unique antioxidant activity:Potential role in cerebroprotection[J].Ann NY Acad Sci,1994,738:230-242.
[3] Ruffolo RR,Gellai M,Hieble JP,et al.Thepharmacology of carvedilol[J].Eur J Clin Pharmacol,1990,38(Suppl 2):s82-s88.
[4] Zheng Ming,Han Qide,Xiao Ruiping.Distinctβ-adrenergic receptor subtype signaling in the heart and their pathophysiological relevance[J].Acta Physiologica Sinica,2004,56(1):1-15.
[5] Ahmet I,Krawczyk M,Heller P,et al.Beneficial effects of chronic pharmacol ogical manipulation of beta-adrenoreceptor subtype signaling in rodent dilated ischemic cardiomyopathy[J].Circulation,2004,110(9):1083-1090.
[6] Huang JZ,Chen YZ,Su M,et al.dI-3-n-Butylphthalide prevents oxidative damage and reduces mitochondrial dysfuncyion in an MPP(+)-induced cellular model of Parkinsons disease[J].Neurosci Lett,2010,475(2):89-94.
[7] Pfeffer MA,Braunwald E.Ventricular remodeling after myocardial infarction.Experimental observations and clinical implications[J].Circulation,1990,81:1161-1172.
[8] Kajsutra J,Cheng W,Reiss K,et al.Apoptotic and necrotic myocyte cell deaths are independent contributing variables of infarct size in rats[J].Lab Invest,1996,74(1):86-107.
[9] Sam F,Sawyer DB,Chang DL,et al.Progerssive left ventricular remodeling and apoptosis late after myocardial infarction in mouse heart[J].Am J Physiol Heart Circ Physiol,2000,279(1):H422-428.
[10] Palojoki E,Saraste A,Eriksson A,et al.Cadiomyocyte apoptosis and ventricular remodeling after myocardial infarction in rats[J].Am J Physiol Heart Circ Physiol,2001,280(6):H2726-2731.
[11] Li Q,Li B,Wang X,et al.overexperssion of insulin-like gorwth,factor-1in mice protects from myocyte death after infarction,attenuating ventricular dilation,wall stress,and cardiac hypertrophy[J].J Clin Invest,1997,100(8):1991-1999.
[12] Drexler,H.Nitric oxide synthases in the failing human heart:A doubled-edged sword[J].Circulation,1999,99(23):2972-2975.
[13] Arstall MA,Sawyer DB,Fukazawa R,et al.Cytokine-mediated apoptosis in cardiac myoeytes:The role of inducible nitric oxide syntheses induction and peroxynitrite generation[J].Circ Res,1999,85(9):829-840.
[14] Yaoita H,Sakae A,Maehara K,et al.Different effects of carvedilol,metoprolol,and propranolol on left ventricular remodeling after coronary stenosis or after permanent coronary occlusion in rats[J].Cicrualtion,2002,105(8):975-980.
[15] Omerovic E,Bollano E,Soussi B,et al.Selective beta(1)-blockade attenuates post-infarct remodeling without improvement in myocardial energy metabolism and function in rats with heart failure[J].Eur J Heart Fail,2003,5(6):725-732.
[16] Senior R,Basu S,Kinsey C,et al.Carvedliol prevents remodeling in patients with left ventricular dysfunction after acute myocardial infarction[J].Am Heart J,1999,137(4Ptl):646-652.
[17] Metra M,Giubbini R,Nodori S,et al.Differential effects ofβblockers in patientswith heart failure:A prospective,randomized,double-blind comparison of the long-term ofmeto-prolol[J].Circulation,2000,102:546.
[18] Cesselie D,Jakoniuk l,Barluechi L,et al.Oxidative stess-mediated cardiac cell death is a major determinant of ventricular dysfunction and failure in dog dialed cardiomyopathy[J].Circ Res,2001,89:279-286.
[19] Wu Y,Xing D,Chen WR.Single cell FRET imaging for determina tion of pathway of tumor cell apoptosis induced by photofrin-PDT[J].Cell Cycle,2006,5:729-734.
[20] 李为民,甘润韬.β1肾上腺素能受体阻断剂与β2肾上腺素能受体
激动剂联用对心力衰竭大鼠心功能及心肌细胞凋亡的影响[J].中华心血管病杂志,2007,35(7):615-619.

