5-Aza-CdR抑制HepG2细胞DLK1基因表达及细胞生长
黄铀新,罗耀玲,刘 瑶
(赣南医学院第一附属医院1.核医学科;2.临床医学研究中心;3.消化内科,江西赣州341000)
原发性肝癌(hepatocellular carcinoma,HCC)是一种高度恶性的肿瘤,全世界每年因该病导致的死亡人数过百万,过去的20年中HCC发病仍呈上升趋势[1]。HCC的发生是多步骤、多因素、多基因参与的过程。近年发现大多数肿瘤组织中存在印记基因的印记缺失所致的等位基因高表达现象。遗传印记基因DLK1(delta drosophila homolog-like或 deltalike1 homologue)在HCC中有高表达,且对HCC有特异性,被认为是一个潜在的靶标[2-3]。
DLK1首先在神经母细胞瘤中被发现并克隆,是表皮生长因子(epidermal growth factor,EGF)家族成员之一,参与细胞分化和决定[4-5]。近年来研究证实DLK1在许多肿瘤组织中高表达,通过多种机制参与肿瘤的发生、发展。本研究意在揭示DLK1的印记缺失与肝癌恶性分化程度、转移及复发等恶性生物学特征的关系。本研究在肝癌细胞系HepG2上证实去甲基化药物5-氮杂-2'-脱氧胞苷(5-Aza-CdR)是否能重新诱导DLK1被印记并抑制肝癌细胞的增殖、侵袭等恶性生物学特征,探索去甲基化药物对肝癌的治疗价值。
1 材料与方法
1.1 药物和试剂
5-Aza-CdR(Sigma公司),用 PBS缓冲液(pH 6.8)配制成浓度为5 mmol/L的贮存液,除菌过滤后分装于-20℃保存。Trizol(Invitrogen公司),反转录试剂盒(天根公司)。所有引物均由上海生工公司合成。Matrigel(BD公司),Transwell小室(Coster公司)
1.2 方法
1.2.1 细胞培养:人肝癌细胞系HepG2细胞(中国科学院细胞库)按37℃ 5%CO2培养于含10%胎牛血清(杭州四季青公司)的RPMI-1640培养液中(Gibco公司)。实验使用的细胞均是处于对数生长期的,且活细胞数要在95%以上。
1.2.2 MTT法检测药物作用后细胞的生长:取对数生长期细胞,常规消化后按每孔2×103个(100 μL)接种于96孔培养板中,4 h贴壁后弃完全培养基,分别加入含新鲜配制的终浓度为0.75、1.5、2.5、5 和10 μmol/L 5-Aza-CdR 药液的完全培养基,每孔100 μL,每组设3个复孔;对照组加入等量的不含药液的完全培养基。每隔24 h取出1板加入5 g/L MTT 溶液10 μL,37℃ 继续孵育4 h后加DMSO 150 μL,振荡10 min使其充分溶解结晶,置酶标仪(Thermo Fisher公司)上测定波长470 nm的A值。计算细胞增殖抑制率(inhibition ratio)=(1-实验组A470nm/对照组A470nm)×100%。
1.2.3 RT-PCR检测用药前后DLK1 mRNA的表达:用新鲜配制的终浓度为2.5和5 μmol/L 5-Aza-CdR处理HepG2细胞72 h(每天更换含药液的培养基)后,对照组用不加药液的完全培养基。收集细胞,提取总RNA(按试剂盒说明操作),电泳鉴定总RNA提取效果,定量后进行RT-PCR。DLK1基因的上游引物:5'-GTACTCGGGAAAGGACYGCC-3',下游引物:5'-CTCGCAGAAATTGCCTGAGA-3',扩增 PCR理论长度为151 bp。内参β-actin上游引物:5'-CTA CAATGAGCTGCGTGTGG-3',下游引物:5'-AAGGA AGGCTGGAAGAGTGC-3',扩增 PCR理论长度为416 bp。共同PCR条件为:94℃变性40 s,60℃退火30 s,72℃延伸30 s,共30个循环。PCR产物经3%的琼脂糖凝胶电泳鉴定。实验重复2次。
1.2.4 Western blot检测5-Aza-CdR干预前后DLK1蛋白表达水平:将 PBS、2.5 和5 μmol/L 5-Aza-CdR处理72 h的 HepG2细胞放置冰上,冰PBS洗3遍,加入含PMSF的裂解液,冰上裂解30 min。然后用干净的刮棒将细胞刮下转移到离心管中,4℃ 12 000 r/m离心5 min,上清即为总蛋白。定量后进行SDS-PAGE电泳(各组总蛋白上样量均为40 μg)分离蛋白并电转PVDF膜,通过脱脂奶粉封闭,一抗孵育,洗涤膜,二抗孵育,洗涤膜过程,最后暗室显影,拍照。
1.2.5 流式细胞仪检测细胞周期:收集2.5和5 μmol/L 5-Aza-CdR(每天换药)与 PBS 作用72 h的HepG2细胞,PBS洗涤2次,按9∶1的比例加入70%冰乙醇-20℃固定2 h。PBS冲洗2遍后调整细胞浓度为1×106个/mL,按照PI试剂盒说明(碧云天公司)配制碘化丙啶(PI)染色液(终浓度为200 mg/L RNase A和终浓度为50 mg/L),37℃避光作用30 min后,24 h内上机检测。实验重复2次。
1.2.6 Transwell检测细胞侵袭能力:4℃溶解Matrigel基质过夜,用预冷的无血清1640按1∶5稀释铺胶。每孔中加入稀释好的基质胶40 μL,放入37℃培养箱中,孵育5 h;然后吸出小室中水份,进行水化基底膜30 min。消化细胞(2.5和5 μmol/L 5-Aza-CdR与PBS作用72 h的HepG2细胞)并用无血清1640悬浮,计数,调整浓度为2×106个/mL,每个Transwell小室中加100 μL细胞悬液。24孔板下室加入600 μL含10%胎牛血清的1640培养基。37℃5%CO2培养24 h后,弃去孔中培液,PBS洗2遍,甲醇固定20 min,0.1%结晶紫染色15 min,用清水洗3遍以上,用棉签轻轻擦掉上层未迁移细胞。400倍显微镜下观察、拍照并计数。每个样本计数5个视野,取其平均值。
1.3 统计学分析
将所得实验数据经SPSS 19.0统计学软件分析,结果以均数±标准差(±s)表示,多个样本平均数间的比较采用单因素方差分析。
2 结果
2.1 5-Aza-CdR作用后HepG2细胞的增殖活性降低
5-Aza-CdR呈时间和浓度依赖性抑制HepG2细胞增殖,细胞增殖抑制率与浓度呈正相关(表1)。
2.2 药物作用后DLK1基因mRNA表达水平下降
5 μmol/L 5-Aza-CdR药物处理组细胞的 DLK1
mRNA表达量显著低于PBS作用组(P<0.05)(图1)。
2.3 5-Aza-CdR干预后DLK1蛋白表达水平下降
PBS、2.5 和5 μmol/L 5-Aza-CdR 处理 HepG2细胞72 h后,DLK1蛋白表达水平依次降低(图2)。
2.4 5-Aza-CdR作用后HepG2细胞周期改变
PBS、2.5 和5 μmol/L 5-Aza-CdR 处理72 h后,G1期细胞减少,S期细胞增多(表2)。

图1 不同组mRNA灰度值柱形图比较Fig 1 Relative mRNA of different group(n=3)
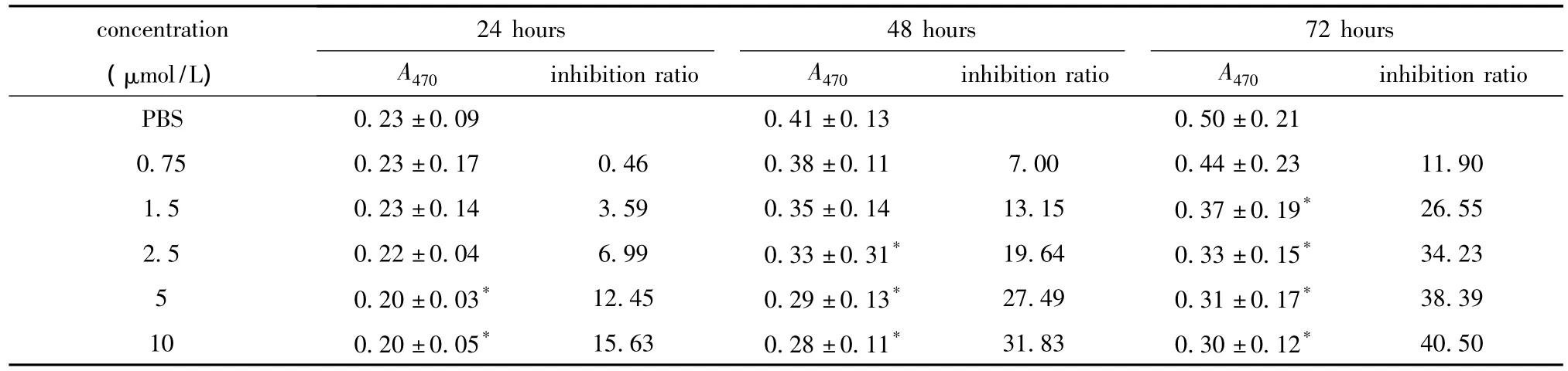
表1 5-Aza-CdR对HepG2细胞的生长抑制作用Table 1 Inhibitory effect of 5-Aza-CdR on HepG2 cell(x ± s,n=3)
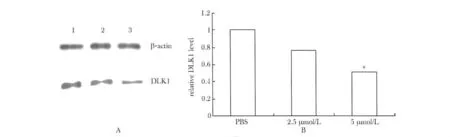
图2 5-Aza-CdR作用HepG2细胞前后DLKI蛋白表达水平Fig 2 The DLK1 protein expression of HepG2 cell treated by 5-Aza-CdR

表25 -Aza-CdR对HepG2细胞周期影响Table 1 Effect of 5-Aza-Cd on HepG2 cell cycle(n=2)
2.5 5-Aza-CdR处理HepG2细胞后侵袭能力减弱
各组穿过膜的细胞数为:PBS组55.4±6.1,2.5 μmol/L 5-Aza-CdR 组为 40.0 ± 3.4,5 μmol/L 5-Aza-CdR组为26.0±3.8。各组间差异显著(P<0.05)。
3 讨论
DLK1基因是一个父源表达,母源沉默(CpG岛的序列上甲基化)的印记基因,定位于人染色体14q32[6],蛋白具有6次跨膜结构,其中细胞外区拥有6串表皮生长因子样(EGF)重复片段,故DLK1属于表皮生长因子(EGF)家族成员之一[7]。DLK1与Notchl配体delta存在高度同源性,借助胞外EGF样的串联结构与Notchl相互作用,进而联系Notch信号传导通路[8],参与细胞的分化,调节细胞外生物活性。当Notch信号传导通路出现异常,由于DLK1与Notch配体的竞争,因此导致DLK1表达异常。近年来研究表明DLK1在多种肿瘤中出现高表达现象。Huang CC[9]等发现DLK1基因在原发性肝癌中印迹缺失,导致DLK1基因过表达。在肝癌组织中,DLK1的表达较癌旁组织明显增加,正常肝组织中未见DLK1的表达。
5-Aza-CdR是胞苷类似物,一种去甲基化制剂,其作用机制是通过与DNA甲基转移酶共价结合 (可逆),从而控制印记基因的表达水平[10]。本研究首先做了5-Aza-CdR作用HepG2细胞后的生长曲线,证实24 h抑制效果很弱,72 h抑制效果才明显,因此后面的实验均采用作用72 h。由于5-Aza-CdR在37℃易分解,只能稳定24 h,所以作用72 h一定要每天更换含药液的培养基。实验采用去甲基化试剂5-Aza-CdR处理,观察对DLK1基因的影响。结果HepG2细胞经5-Aza-CdR处理降低了DLK1基因mRNA的表达水平,且降低的水平呈浓度依赖性。
MTT实验中发现具体抑制率与接种细胞的数量有关,72 h后由于细胞长的太满而抑制率降低。因此96孔板接种的细胞数量最好不超过2×103个。MTT实验得出 5-Aza-CdR 在5 μmol/L与10 μmol/L时抑制效果相差不大,为尽量减少药物本身影响,后续试验均采用5 μmol/L为最大浓度,并选用了一个次之的2.5 μmol/L的浓度做次对照。流式细胞术显示细胞生长停滞在S期;Transwell实验证实5-Aza-CdR作用后肿瘤细胞的侵袭能力明显减弱。在做Transwell实验时一定要注意每组细胞加进孔的数量一定要一致,否则没有意义。由于HepG2细胞侵袭能力强,24孔板中细胞加入量最好不超过3×105个/mL。
总之,此次实验证实了5-Aza-Cd能重新诱导DLK1被印记,并抑制肝癌细胞的增殖、侵袭等恶性生物学特征。
[1]Bosch FX,Ribes J,Cléries R,et al.Epidemiology of hepatocellular carcinoma[J].Clin Liver Dis,2005,9:191 -211.
[2]Huang J,Zhan X,Zhang M,et al.Up-regulation of DLK1 as an imprinted gene could contribute to human hepatocellular carcinoma[J].Carcinogenesis,2007,28:1094 -1103.
[3]Xu X,Liu RF,Zhang X,et al.DLK1 as a potential target against cancer stem/progenitor cells of hepatocellular carcinoma[J].Mol Cancer Ther,2012,11:629 -638.
[4]Begum A,Kim Y,Lin Q,et al.DLK1,delta-like 1 homolog(Drosophila),regulates tumor cell differentiation in vivo[J].Cancer Lett,2012,318:26 -33.
[5] Ditte CA,Stine JP,Louise HJ,et al.Characterization of dlk1+cells emerging during skeletal muscle remodeling in response to myositis,myopathies and acute injury[J].Stem Cells Express,2009,8:12 -19.
[6]Luk JM,Burchard J,Zhang C,et al.CDLK1-DIO3 genomic imprinted microRNA cluster at 14q32.2 defines a stemlike subtype of hepatocellular carcinoma associated with poor survival[J].J Biol Chem,2011,286:30706 -30713.
[7]Baladron V,Ruiz-hidalgo MJ,Bonvini E,et al.The EGF-like homeotic protein dlk affects cell groeth and interacs with growth-modulating molecules in the yeast teo-hybrid system[J].Biochem Biophys Res Commun,2002,291:193-204.
[8]Bordonaro M,Tewari S,Atamna W,et al.The Notch ligand Delta-like 1 integrates inputs from TGFbeta/Activin and Wnt pathways[J].Exp Cell Res,2011,317:1368 -1381.
[9]Huang CC,Chuang JH,Huang LL,et al.The human Deltahkel homologne is implicated in the progression of liver fibrosis in biliary atresia[J].J Pathol,2004,202:172 -179.
[10]Zhu WG,Hileman T,Ke Y,et al.5-Aza-2'-deoxycytidine activates the p53/p21 Waf1/Cip1 pathway to inhibit cell proliferation[J].J Biol Chem,2004,279:15161-15166.

