非小细胞肺癌病灶大小及部位与胸腔淋巴结转移关系探讨
贾春祎,王启文,张立新,张晓凯 (吉林省肿瘤医院胸部肿瘤外二科,吉林 长春 130012)
肺癌是当今世界人类癌症致死的首要原因,确诊后5年生存率只有15%。在中国,20年来能接受手术治疗的非小细胞肺癌患者不到发患者数的1/3,在手术的病例中,亦有40%是局部晚期,术后总体5年生存率仅为40%左右。
非小细胞肺癌的治疗是以手术为主的综合治疗,手术作为唯一有可能彻底治愈非小细胞肺癌的手段,其根治程度不但直接影响预后,同时也是进行准确TNM分期的前提,为术后的辅助治疗提供依据,间接影响预后。对于可手术的非小细胞肺癌患者,病灶的规范性切除、纵隔淋巴结(N1加N2)的系统性清除不但决定手术的根治程度,同时也决定了分期(除外M因素)是否准确。我们回顾了240例行完全性切除的非小细胞肺癌患者的临床资料,来讨论病灶大小、原发部位与发生胸腔内淋巴结转移的关系。
1 资料与方法
1.1 一般资料:2008年1月~2008年12月期间在吉林省肿瘤医院进行手术的376例非小细胞肺癌患者,符合以下条件者入选:①病理证实为原发性非小细胞肺癌;②病灶切除及淋巴结清除符合肺癌完全性肺叶切除标准;③术前未接受新辅助化疗、放疗及其他抗肿瘤治疗;④术后病理分期为I期~IIIA期;⑤病理报告中病灶大小记录精确至1.0 mm、淋巴结清扫数目在6组18个以上,位置描述明确,共240例。包括一般资料即性别、年龄;手术方式即常规开胸手术;病灶部位即左肺或右肺,上叶、中叶或下叶;病灶大小即肿瘤最大径;病理类型即鳞状细胞癌、腺癌、腺鳞癌、大细胞癌及其他。
1.2 判断标准:病灶大小判断以术中实测肿瘤最大径为指标,精确至1.0 mm;淋巴结判断以UICC 2009年第7版肺癌TNM分期系统为标准,N0为区域淋巴结无转移;N1为同侧支气管旁和/或同侧肺门淋巴结转移;N2为同侧纵隔和/或隆突下淋巴结转移。
1.3 分组原则:根据病灶大小分为五组:①肿瘤最大径≤2 cm;②2 cm<肿瘤最大径≤3 cm;③3 cm<肿瘤最大径≤5 cm;④5 cm<肿瘤最大径≤7 cm;⑤肿瘤最大径>7 cm。根据病灶位置分为五组:①左肺上叶;②左肺下叶;③右肺上叶;④右肺中叶;⑤右肺下叶。根据病理类型分为五组:①鳞状细胞癌;②腺癌;③腺鳞癌;④大细胞癌;⑤其他;根据患者年龄分为五组:①年龄≤40岁;②40<年龄≤50;③50<年龄≤60;④60<年龄≤70;⑤年龄>70。根据淋巴结转移分为三组:①N0;②N1;③N2。
1.5 统计分析方法:采用Excel制表,利用SPSS for Windows 17.0统计软件完成统计分析,当P<0.05时差异有统计学意义,P<0.01时差异有显著统计学意义,以均值±标准差(±s)表示。
2 结果
2.1 临床资料分析
2.1.1 一般情况:本研究病例总数为240例,其中男160例,占总数的66.7%;女80例,占总数的33.3%。年龄33~82岁,平均(57.7±9.5)岁。年龄分布情况为:①年龄≤40组4例(1.7%),②40<年龄≤50组46例(19.2%),③50<年龄≤60组90例(37.5%),④60<年龄≤70组74例(30.8%),⑤年龄>70组26例(10.8%)。
2.1.2 病灶大小:本组病例非小细胞肺癌原发灶最大者9.2 cm,最小者0.7 cm。具体分组情况:①组29例,占12.1%(肿瘤最大径≤2 cm);②组64例,占26.7%(肿瘤最大径>2 cm且≤3 cm);③组94例,占39.2%(肿瘤最大径>3 cm且≤5 cm);④组42例,占17.5%(肿瘤最大径>5 cm且≤7 cm);⑤组11例,占4.6%(肿瘤最大径>7 cm)。
2.1.3 肿瘤位置:全组240例非小细胞肺癌原发灶位于左肺的有92例、位于右肺的有148例,所占比例分别为38.3%、61.7%;位于上叶的有114例、位于中叶的有29例、位于下叶的97例,所占比例分别为47.5%、12.1%、40.4%。
2.1.4 组织病理类型:全组病例中鳞状细胞癌95例,占39.58%;腺癌77例,占32.08%;腺鳞癌30例,占12.50%;大细胞肺癌6例,占2.50%;其他组织类型的原发非小细胞肺癌32例,占13.33%。
2.2 性别、年龄、病灶部位与胸腔内淋巴结转移相关性的单因素分析
2.2.1 性别与非小细胞肺癌胸腔内淋巴结转移的相关性:其中男160例,占总数的66.7%;女80例,占总数的33.3%。采用Pearson χ2检验分析性别与非小细胞肺癌胸腔内淋巴结转移的关系,差异无统计学意义(χ2=1.37,P>0.05)。
2.2.2 年龄与非小细胞肺癌胸腔内淋巴结转移的相关性:本组年龄33~82岁,平均(57.7±9.5)岁。年龄分布情况为:①年龄≤40岁组4例(1.7%),②40岁<年龄≤50岁组46例(19.2%),③50岁<年龄≤60岁组90例(37.5%),④60岁<年龄≤70岁组74例(30.8%),⑤年龄 >70岁组26例(10.8%)。采用Pearson χ2检验分析不同年龄与非小细胞肺癌胸腔内淋巴结转移的关系,差异无统计学意义(χ2=11.01,P >0.05)。
2.2.3 病灶部位与非小细胞肺癌胸腔内淋巴结转移的相关性:全组240例非小细胞肺癌原发灶位于左肺92例,占38.3%;右肺148例,占61.7%;位于上叶的有114例、位于中叶的有29例、位于下叶的97例,所占比例分别为47.5%、12.1%、40.4%,病灶位置与纵隔淋巴结转移的位置关系。采用Pearson χ2检验分析不同肿瘤原发部位与发生胸腔内淋巴结转移的关系,差异无统计学意义(χ2=1.25,P=0.29)。
2.3 病灶大小、病理类型与胸腔内淋巴结转移相关性的单因素分析
2.3.1 病灶大小与非小细胞肺癌胸腔内淋巴结转移的相关性:本组非小细胞肺癌原发灶最大者9.2 cm,最小者0.7 cm。具体分组情况:①组29例,占12.1%(肿瘤最大径≤2 cm);②组64例,占26.7%(肿瘤最大径>2 cm且≤3 cm);③组94例,占39.2%(肿瘤最大径>3 cm且≤5 cm);④组42例,占17.5%(肿瘤最大径>5 cm且≤7 cm);⑤组11例,占4.6%(肿瘤最大径>7 cm),见表1。采用Pearson χ2检验分析不同大小的肿瘤与胸腔内淋巴结转移的关系,各组间比较,差异均无统计学意义(P>0.05),见表2;再以①加②和③加④加⑤分成A、B两组分析,即A组病灶直径≤3 cm,B组病灶直径>3 cm,其中A组93例,发生胸腔淋巴结转移率(N1加N2)%为:31/93=33.33%;B组147例,发生胸腔淋巴结转移率(N1加N2)%为:68/147=46.26%;差异有统计学意义(χ2=17.31,P<0.01),见表3、表4。表明当原发非小细胞肺癌病灶最大径>3 cm时,发生胸腔内淋巴结转移几率较最大径≤3 cm时增大。然而,进一步分别以2 cm、5 cm、7 cm作为病灶最大径的临界值分组,差异均无统计学意义(P>0.05)。分析其可能原因如下:①非单因素影响,病灶大小相同而组织学类型不同的非小细胞肺癌之间,由于不同的生物学行为可能导致不同的生长方式和淋巴、血液转移特点;②样本量小,导致统计学分析结果存在误差;③淋巴结清除结果(数量和质量)未必可以正确反应实际的转移情况。
2.3.2 病理类型与非小细胞肺癌胸腔内淋巴结转移的相关性:鳞状细胞癌95例,占39.58%;腺癌77例,占32.08%;腺鳞癌30例,占12.50%;大细胞肺癌6例,占2.50%;其他组织类型的原发非小细胞肺癌32例,占13.33%。采用Pearson χ2检验分析不同病理类型肿瘤与非小细胞肺癌胸腔内淋巴结转移的关系,仅发现腺鳞癌发生N2转移的比率高于鳞状细胞癌和其他类型原发非小细胞肺癌,差异有统计学意义(χ2=4.39,P<0.05);其余各类型间两两比较分析,差异均无统计学意义(P>0.05)。

表1 肿瘤大小和淋巴结转移关系

表3 肿瘤大小和淋巴结转移关系
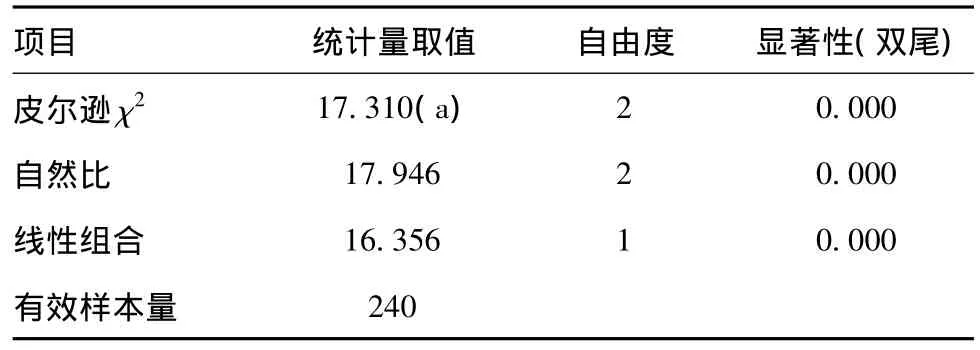
表4 χ2检验
3 讨论
肺癌是目前对人类生命健康威胁最大的恶性肿瘤之一,确诊后只有大约15%的患者能生存5年或以上。肺癌总发病数占全部恶性肿瘤发病的20.0%,死亡占总癌死亡数的23.8%[1]。近年来,随着新的化疗药物、立体定向适型调强放射治疗、特别是靶向治疗药物等一系列新的治疗手段的出现,肺癌尤其是非小细胞肺癌的治疗效果已有了明显改善。但毋庸置疑,手术作为唯一有可能彻底治愈非小细胞肺癌治疗方法,其主导地位不容撼动。但遗憾的是,大多数肺癌患者都是因为出现了咳嗽、血痰、胸痛、发热、气促等症状时才去就诊,而此时已有约75%~80%的患者已属于局部晚期或出现了远处转移,能接受手术根治的不到发患者数的1/3,即使是在手术的病例中,亦有40%是局部晚期,术后总体5年生存率仅为40%左右[2-3]。如何能够使接受手术切除的肺癌患者获得长期生存,一直是困扰胸部肿瘤外科医生的难题,特别是对于恶性肿瘤,术中的区域性淋巴结清除是手术的重要步骤,资料表明在非小细胞肺癌手术中,纵隔淋巴结的清除数目是肺癌的重要预后因素之一[4],但是对于肺癌手术的淋巴结清除采用何种方式为最佳、淋巴结清除的合适数目、以及对于不同大小、不同部位的肿瘤采取同样的淋巴结清除范围是否有同样的临床意义等问题的研究尚无统一认识。
病灶的浸润性生长和远处转移是恶瘤肿瘤的特点,肺癌从原发病灶形成以及由小变大需要一定的倍增时间,理论上说对于生物学行为相同或相近的肿瘤,病灶越大说明生长时间越长,发生区域淋巴结转移的可能性越大,有研究表明,腺癌由1.0 cm生长至3.0 cm平均需要26.5个月[5]。但也可能由于患者本身的一般状态、年龄、性别等差异,以及病变部位的血液、淋巴循环差异,组织学类型差异等因素的影响,临床上经常可以见到原发灶较小但转移较重、原发灶较大但并无转移等情况的发生。Wisnivesky JP的一项关于肺癌数据库的资料研究也说明了这一点,该组研究发现,直径在1.5 cm以下的小病灶肺癌,其淋巴结转移率竟然高达40%。
本研究样本人群全部是经手术证实的I期~IIIA期原发性非小细胞肺癌患者,病灶切除及淋巴结清除符合肺癌完全性肺叶切除标准,即病灶切缘及静脉、动脉、支气管、支气管周围、病灶附近组织阴性;系统淋巴结清除要求要达到6组以上,包括第7组淋巴结(隆突下)在内的3组纵隔淋巴结,以及包括第10组淋巴结(肺门)在内的3组肺内淋巴结;切除的最高组淋巴结镜下阴性;淋巴结无结外侵犯。接受了术前新辅助化疗、放疗的患者,以及淋巴结清扫数目少于6组18个、部位描述不清的患者未列入研究。分别对患者性别、年龄、病灶部位、病灶大小、组织学类型等因素与非小细胞肺癌胸腔内淋巴结转移的相关性进行单因素分析。
分析结果提示,患者性别、年龄以及病灶所在部位与非小细胞肺癌是否发生胸腔内淋巴结转移无显著关系;但肿瘤的不同原发位置与发生N2转移的具体位置(组别)间显示出一定规律:①左肺上叶癌易发生主动脉区(5组、6组)淋巴结转移,其发生率约为24.49%(12/49),特别是在已经出现胸腔内淋巴结转移[N1和(或)N2阳性]的病例中,其发生率高达57.14%(12/21);②右肺上叶癌易发生4组淋巴结转移,其发生率约为24.61%(16/65),在已出现胸腔内淋巴结转移的病例中,其发生率为66.67%(16/24);③左肺下叶及右肺下叶癌均易发生7组淋巴结转移,其发生率约分别为23.26%(10/43)、24.07%(13/54),在已出现胸腔内淋巴结转移的病例中,其发生率分别为62.5%(10/16)、72.22%(13/18)。
本研究结果还表明,鳞状细胞癌、腺癌、腺鳞癌、大细胞肺癌及其他类型非小细胞肺癌之间,仅发现腺鳞癌发生N2转移的比率高于鳞状细胞癌和其他类型原发非小细胞肺癌,差异有统计学意义(χ2=4.39,P<0.05);其余各类型间两两比较分析,差异均无统计学意义(P>0.05)。单因素分析结果发现非小细胞肺癌病灶大小与胸腔内淋巴结转移存在相关性:本组数据中病灶最大者9.2 cm,最小者0.7 cm,以2009年TNM分期(第7版)关于病灶大小的描述分成≤2 cm、>2 cm且≤3 cm、>3 cm且≤5 cm、>5 cm且≤7 cm以及>7 cm共5组,比较不同组别间发生胸腔内淋巴结转移的情况,结果经统计学方法分析,各组间差异无统计学意义;但进一步研究发现,将样本以直径>3 cm和≤3 cm分成两组分析发生胸腔内淋巴结转移情况,差异有统计学意义(χ2=17.31,P<0.01);继而分别以2 cm、5 cm、7 cm作为肿瘤最大径的临界值分组,用上述方法分析其差异,则无统计学意义。表明非小细胞肺癌发生胸腔淋巴结转移的情况与病灶的大小存在相关性,当原发病灶最大径>3 cm时发生胸腔淋巴结转移(N1加N2)的几率高于病灶最大径≤3 cm,但并未证明随着病灶的逐渐增大,发生胸腔内淋巴结转移的几率也随之增加。
综上所述,手术作为唯一有可能彻底治愈非小细胞肺癌多手段,手术中系统的纵隔淋巴结清除是必要的,且对于不同年龄、不同性别、不同部位、不同组织类型的非小细胞肺癌具有相同的临床价值[6],并应注意重点区域的淋巴结清除。特别是当病灶最大直径超过3 cm时,发生胸腔内淋巴结转移几率增大,因此,对于病灶在3 cm以上的肺癌,如术前胸部CT检查怀疑有胸腔内淋巴结阳性的,可根据情况适当选择PET-CT、纵隔镜等检查进一步证实,从而避免无效手术的实施;而且,肺癌手术中系统的肺门、纵隔淋巴结清除不但决定了手术的根治程度,同时也影响术后辅助治疗,是改善肺癌预后的前提。
[1] Ferlay J,Bray F,Pisani P,et al.GLOBOCAN 2002:Cancer incidence,mortality and prevalence worldwide,Version 2.0.IARC Cancer Base No.5.Lyon:IARC Press,2004[J].Valero-Malaria in Colombia,2007,195.
[2] 汤钊猷.现代肿瘤学[M].第2版.上海:复旦大学出版社,2008:859.
[3] 吴在德,吴肇汉.外科学[M].第6版.北京:人民卫生出版社,2004:356.
[4] 徐昌文,吴善芳,孙 燕.肺癌[M].第2版.上海科学技术出版社,1993:61.
[5] Heyneman LE,Herndon JE,Goodman PC,et al.Stage distribution in parients with a small(≤3cm)primary nonsmall cell caicinoma:implication for lung carcinoma screening[J].Cancer,2001,92(12):3051.
[6] Takigawa N,Segawa Y,Okahara M,et al.Prognostic factors for patients with advanced non-small cell cancer:univariate and multivariate analyses including recursive partitioning and amalgamation[J].Lung Cancer,1996,15(1):67.

