维生素E对高脂血症小鼠血管内皮细胞凋亡相关蛋白基因表达的影响
霍 阳,初巍巍,宋 涛,陈 悦,赵跃萍,贾大林
体内大量研究均证实,血管内皮细胞凋亡可能是发生动脉粥样硬化的早期事件,并可促进动脉粥样硬化的形成、斑块侵蚀和急性冠脉综合征的发展[1]。细胞凋亡是生物体的一种与细胞坏死截然不同的自杀程序,是维持细胞群体数量相对恒定的主动耗能过程。Bax蛋白基因需要与其家族中Bcl-2蛋白基因相互协调才能发挥抑制凋亡的效应,形成凋亡调控系统。当Bax同源二聚体形成时,便可诱导细胞的凋亡,随着Bcl-2蛋白表达量上升,Bax二聚体逐渐分开,与Bcl-2蛋白形成更稳定的Bax-Bcl-2异源二聚体,从而中和Bax蛋白诱导细胞凋亡的作用[2]。这种二聚体调控细胞对凋亡的易感性,决定细胞的存亡,两蛋白的比例是决定细胞凋亡抑制作用强弱的关键因素[3]。
维生素E作为人体一种重要的脂溶性抗氧化剂,可改善氧化应激状态,减少脂质氧化,调节脂质代谢,保护血管内皮细胞[4]。张思明等[5]研究表明维生素E水平与血清总胆固醇(TC)、甘油三酯(TG)及血压水平呈负相关。而维生素E是否能通过降低血清TG与TC浓度来抑制血管内皮细胞凋亡值得我们去进一步探索,为今后临床预防高脂血症的并发症提供一定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:50只ICR雄性性成熟小鼠由北京维通利华实验动物技术有限公司提供,6~8周龄,体重为28~32 g,合格证号:SCXK-(京)2007-0001。
1.1.2 主要试剂:维生素E为Sigma公司产品;TG、TC检测所采用的7020全自动生物化学分析仪为日本日立公司产品,TG、TC检测试剂盒为上海复星长征有限公司产品,RT-PCR试剂盒为日本TaKa-Ra公司产品,Bcl-2、Bax、GAPDH引物为日本TaKa-Ra公司产品,Trizol试剂为Introgen公司产品。
1.1.3 实验饲料:高脂饲料由3%胆固醇、10%猪油、0.3%甲硫氧嘧啶、0.4%胆酸钠组成,其与普通饲料均购自北京科澳协力饲料有限公司[合格证号:京动(2000)第015号]。
1.2 方法
1.2.1 实验动物的分组与处理:将50只小鼠随机分为A、B、C、D、E 5组,每组10只,人工控温20~26℃,12 h光照,12 h黑暗,颗粒饲料喂养,自由饮水取食。高脂血症小鼠模型参考[1]。A组:高脂饲料喂养;B组:维生素E 10 mg/(kg·d)+高脂饲料喂养;C组:维生素E 20 mg/(kg·d)+高脂饲料喂养;D组:维生素E 40 mg/(kg·d)+高脂饲料喂养;E组:普通饲料喂养。维生素E均用橄榄油配成混悬液,配好后避光4℃保存,现用现配。连续灌胃4周,最后一次灌胃后禁食10 h,用颈椎脱臼法将小鼠处死并放于冰台上,在无菌条件下抽取静脉血并剪开胸腹腔,迅速分离腹主动脉。
1.2.2 RT-PCR法测定Bax与Bcl-2基因mRNA水平的表达:称取30 mg腹主动脉并按Trizol试剂盒说明书提取出总RNA。鉴定RNA纯度与完整性后按试剂盒说明以(oligo)dT为引物反转录合成cDNA第一链,以2 μl的cDNA为模板按试剂盒说明进行PCR扩增,GAPDH为内参照。
反应条件:94℃、1 min,Tm(根据不同的退火温度定)50 s;72℃、1 min,Tm(根据不同的退火温度定)30 s,进行40个循环。扩增产物20 g/L琼脂糖凝胶电泳40 min,紫外灯260 nm下进行检测。用Quantity one软件分析各目的基因的条带密度,以管家基因GAPDH为内参照计算各个样本的基因条带密度的相对值。各引物由聚丙烯酰胺凝胶电泳(PCGE)纯化,具体基因序列如下:

1.2.3 TG、TC的检测:抽取的静脉血用高速离心机(3000 r/min)离心5 min后,用吸管将上层血清吸出,随后放入容积为1.5 ml的离心管中,并立即放于-30℃冰箱中冷冻保存,检测时按试剂盒说明分别检测TG、TC,所取标本均在1周内测定。
1.3 统计学分析 采用SPSS 10.0软件对数据进行统计学分析,计量资料结果用均数±标准差(±s)表示,采用方差分析,相关性分析使用Spearman相关分析,α=0.05为检验水准。
2 结果
2.1 Bax基因mRNA水平的表达量 A组主动脉内膜Bax基因mRNA水平的表达量高于B、C、D、E组(P<0.05),B、C、D组随着维生素E剂量的增加mRNA水平的表达量逐渐减少,且3组间活性均有统计学差异(P<0.05),B、C、D组mRNA水平的表达量均高于E组(P<0.05),结果见图1、表1。
2.2 Bcl-2基因mRNA水平的表达量 A组主动脉内膜Bcl-2基因mRNA水平的表达量低于B、C、D、E组(P<0.05),B、C、D组随着维生素E剂量的增加表达量逐渐升高,且3组间活性均有统计学差异(P<0.05),B、C、D组表达量均低于 E组(P<0.05),结果见图1、表1。
2.3 Bax与Bcl-2基因mRNA水平的表达量比值A组主动脉内膜Bax、Bcl-2基因mRNA水平的表达量比值高于B、C、D、E 组(P <0.05),B、C、D 组随着维生素E剂量的增加mRNA水平的表达量比值逐渐减少,且3组间活性均有统计学差异(P<0.05),B、C、D组主动脉内膜Bax、Bcl-2基因mRNA水平的表达量比值均高于 E组(P<0.05),结果见图1、表1。

图1 5组小鼠主动脉内膜Bax、Bcl-2基因mRNA水平的表达量
表1 5组小鼠主动脉内膜Bax、Bcl-2基因mRNA水平的表达比较(±s)

表1 5组小鼠主动脉内膜Bax、Bcl-2基因mRNA水平的表达比较(±s)
注:A组:高脂饲料喂养;B组:维生素E 10 mg/(kg·d)+高脂饲料喂养;C组:维生素E 20 mg/(kg·d)+高脂饲料喂养;D组:维生素E 40 mg/(kg·d)+高脂饲料喂养;E组:普通饲料喂养。与 E组比较,aP<0.05;与 A组比较,cP<0.05;与B组比较,eP<0.05;与C组比较,gP<0.05
组别 鼠数 积分光密度值Bax Bcl-2 Bax/Bcl-2 10 0.531 ±0.034 0.731 ±0.024 0.643 ±0.076 A 组 10 1.078 ±0.053a 0.375 ±0.032a 2.713 ±0.052a B 组 10 0.931 ±0.042ac 0.463 ±0.012ac 2.232 ±0.064ac C 组 10 0.929 ±0.053ace 0.542 ±0.007ace 1.741 ±0.054ace D 组 10 0.632 ±0.131aceg0.613 ±0.031aceg0.843 ±0.041 E组aceg
2.4 Bax与Bcl-2基因mRNA水平的表达量关系Bax基因与Bcl-2基因mRNA水平的表达量之间为负相关关系(r= -0.635,P=0.036)。
2.5 血清TG浓度 A组血清中TG的浓度明显高于 B、C、D、E 组(P <0.05),B、C、D 组血清中 TG 的浓度随着维生素E剂量的增加逐渐降低,但B、C、D组间均有统计学差异(P<0.05),B、C、D组血清中TG的浓度均高于E组(P<0.05),结果见表2。
2.6 血清TC浓度 A组血清中TC的浓度明显高于 B、C、D、E 组(P <0.05),B、C、D 组血清中 TC 的浓度随着维生素E剂量的增加逐渐降低,但B、C、D组间均有统计学差异(P<0.05),B、C组血清中TG的浓度均高于E组(P<0.05),D组与E组间血清TG浓度无统计学差异(P>0.05),结果见表2。
表2 5组小鼠血清中甘油三酯、总胆固醇浓度比较(±s,mmol/L)
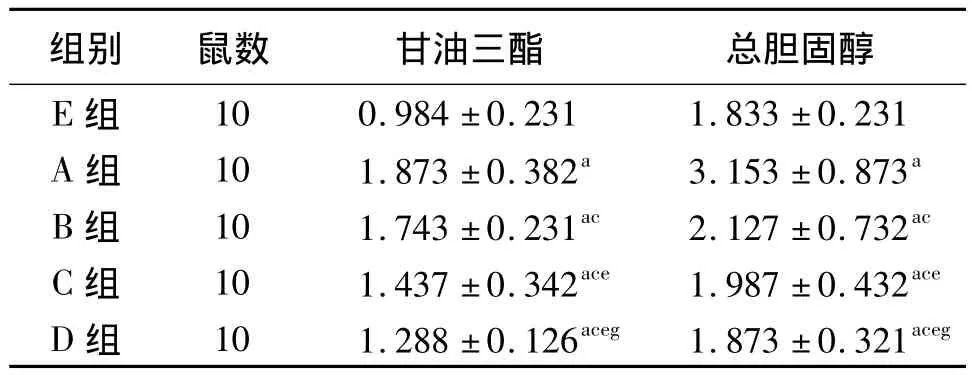
表2 5组小鼠血清中甘油三酯、总胆固醇浓度比较(±s,mmol/L)
注:A组:高脂饲料喂养;B组:维生素E 10 mg/(kg·d)+高脂饲料喂养;C组:维生素E 20 mg/(kg·d)+高脂饲料喂养;D组:维生素E 40 mg/(kg·d)+高脂饲料喂养;E组:普通饲料喂养。与 E组比较,aP<0.05;与 A组比较,cP<0.05;与B组比较,eP<0.05;与C组比较,gP<0.05
组别 鼠数 甘油三酯 总胆固醇E组10 0.984 ±0.231 1.833 ±0.231 A 组 10 1.873 ±0.382a 3.153 ±0.873a B 组 10 1.743 ±0.231ac 2.127 ±0.732ac C 组 10 1.437 ±0.342ace 1.987 ±0.432ace D 组 10 1.288 ±0.126aceg 1.873 ±0.321aceg
3 讨论
高脂血症是影响动脉粥样硬化的主要因素[6-9],可在早期损伤内皮细胞,促进活性氧产生,增加细胞内氧化应激,破坏细胞结构与功能,诱导内皮细胞凋亡或坏死[10-12]。本实验通过高脂饮食喂养4周成功诱导高脂血症小鼠模型,主动脉Bax蛋白mRNA水平的表达量与Bax/Bcl-2明显增高,而Bcl-2蛋白mRNA水平的表达量明显降低,与E组比较高脂血症组凋亡相关基因表达量明显升高,表达高脂血症可诱导血管内皮细胞凋亡,与李蓉[1]等所得的实验结果相同。近年来大量研究表明高脂血症导致血管内皮细胞凋亡主要是由于氧化应激反应所致,长期大剂量脂肪的摄入,体内会产生大量反应性氧类[13]。而维生素E可以有效的捕捉、清除超氧阴离子自由基、单线态氧和过氧化氢等,保护生物膜免受氧化损伤和过氧化损伤,增加机体对自由基的清除能力,是已被确认的自由基清除剂[14]。本实验结果显示,给予维生素E后Bax蛋白mRNA水平的表达量与Bax/Bcl-2均降低,而Bcl-2蛋白mRNA水平的表达量升高,血清TC与TG浓度均降低。
Bax基因发挥抑制凋亡的效应需要与其家族中Bcl-2基因相互协调,从而形成一个凋亡调控系统。当Bax同源二聚体形成,调控细胞对凋亡的易感性,决定细胞的存亡。Bax占优势时细胞死亡,Bcl-2则阻止细胞死亡。Bax不仅与Bcl-2形成二聚体,还可以自身形成二聚体诱导凋亡,两蛋白的比例是决定细胞凋亡抑制作用强弱的关键因素[15]。Bcl-2可在细胞周期的任一阶段抑制细胞凋亡[16-19],抗凋亡的主要机制是:①作为抗氧化剂,调节细胞氧化还原状态,阻断氧化作用对细胞成分的破坏;②影响细胞跨膜转运,改变钙离子分布,钙离子激活内源性内切酶和谷氨肽转移酶;③抑制有促凋亡作用的细胞色素C从线粒体释放到胞浆;④保护细胞,抑制DNA断裂[20-23]。本实验通过给予外源性维生素E后Bcl-2基因表达量增加,说明维生素E与Bcl-2基因有协同效应,共同对抗高脂血症导致的氧化损伤。但是Bcl-2基因表达是通过何种途径使血清TC、TG浓度降低还需我们在今后的科研与临床工作中进一步探索。
本实验进一步证实了高脂血症可导致血管内皮细胞凋亡基因表达,而口服一定量的维生素E能降低其血清TG与TC的浓度,并降低凋亡基因的表达、升高抑制凋亡基因的表达,其具体机理还有待进一步研究,而维生素E这种安全可靠的保健药物的使用为今后临床工作中预防与治疗高脂血症导致的冠状动脉粥样硬化有着重要的指导意义。
[1]李蓉,董晓蕾,赵凌杰,等.吡咯列酮对高脂血症大鼠主动脉内皮细胞凋亡的作用[J].中国心血管杂志,2012,17(2):133-137.
[2]Salomons G S,Brady H J,Verwijs-Janssen M,et al.The Bax alpha:Bcl-2 ratio modulates the response to dexamethasone in leukaemic cells and is highly variable in childhood acute leukaemia[J].Int Cancer J,1997,71(6):959-965.
[3]周桔,罗荣保.Bc1-2蛋白家族和P53基因在细胞凋亡中的调控效应[J].中国组织工程研究与临床康复杂志,2007,11(10):1950-1952.
[4]Hong Z,Hailing L,Hui M,et al.Effect of vitamin E supplement in diet on antioxidant ability of testis in Boer goat[J].Anim Reprod Sci,2010,117(1-2):90-94.
[5]张思明,全贞玉,韩春姬.血浆维生素E水平与血脂及血压水平的相关性[J].延边大学医学学报,2011,34(1):46-48.
[6]闫明先,赵华清,王亚茹,等.高脂饮食对大鼠胰腺腺泡细胞三磷酸肌醇表达及淀粉酶释放影响的体外研究[J].中国综合临床,2012,28(12):1276-1279.
[7]耿亚辉,马娜敏,于世林,等.中青年人群血糖血脂分布特点及相互关系分析[J].首都医科大学学报,2012,33(4):485-487.
[8]王喜福,祖晓麟,王成钢,等.复方丹参滴丸对高脂血症患者红细胞变形性的影响及其机制分析[J].中国医药,2013,8(4):456-458.
[9]李光新,余明敏.阿托伐他汀降脂治疗对急性冠脉综合征疗效及安全性分析[J].中国医药科学,2013,3(3):103-104.
[10]Rodriguez C,Slevin M,Rodriguez-Calvo,et al.Modulation of endothelium and endothelial progenitor cell function by low-density lipoproteins:implication for vascular repair,angiogenesis and vasculogenesis[J].Pathobiology,2009,76(1):11-22.
[11]孟建超.阿托伐他汀联合依折麦布对冠心病高脂血症患者血脂的影响[J].中国医药科学,2013,3(10):91-92.
[12]赵敏,邢武军,姜宇宙.自拟调脂饮对高脂血症大鼠血脂及过氧化物水平的影响[J].中国医药,2013,8(7):915-916.
[13]俸家富,陈渝春.癌肿患者血清抗氧化维生素与脂质的变化[J].现代实用医学,2003,15(9):545-548.
[14]李世健,王明,张龙,等.比较褪黑素与维生素E在对抗早期糖尿病大鼠膀胱氧化性损伤的作用[J].重庆医科大学学报,2013,38(2):143-147.
[15]Kauntz H,Bousserouel S,Gosse F,et al.Silibinin,a natural flavonoid,modulates the early expression of chemoprevention biomarkers in a preclinical model of colon carcinogenesis[J].Int J Oncol,2012,41(3):849-854.
[16]唐笑先,张鹏娟,孟花,等.Bcl-2反义寡核苷酸联合富勒醇对K562细胞凋亡的影响[J].中华肿瘤防治杂志,2009,16(17):1306-1308.
[17]李蓉,韩香,徐忠伟,等.蟾蜍灵对EAhy926细胞增殖、凋亡及Caspase3,Bcl-2表达的影响[J].武警医学院学报,2012,21(2):77-80,封 3,封 4.
[18]胡萌,章必成.凋亡抑制蛋白与肿瘤转移的研究进展[J].临床误诊误治,2012,25(4):67.
[19]郭峰,王军,王坤,等.缺氧刺激对人骨髓间充质干细胞凋亡基因 Bcl-2和 Bax的影响[J].疑难病杂志,2009,8(9):538-540.
[20]Yuan Y,Jiang C Y,Xu H,et al.Cadmium-induced apoptosis in primary rat cerebral cortical neurons culture is mediated by a calcium signaling pathway[J].PLoS One,2013,8(5):e64330.
[21]刘奔,王帅,林涛,等.Bcl-2过表达对多柔比星诱导的膀胱癌细胞凋亡和NF-KB活化影响的观察[J].中华肿瘤防治杂志,2009,16(11):841-844.
[22]胡永红,周爱民,田野,等.川芎嗪对小鼠脑缺血再灌注后Bax、Bcl-2及 NO、NOS的影响[J].疑难病杂志,2010,9(9):648-650,封 3.
[23]尹黎英,李燕红,张冀平,等.阿托伐他汀预处理对大鼠脑缺血再灌注损伤 Caspase-3、Bcl-2表达的影响[J].武警医学院学报,2011,20(8):619-621.

