细粒棘球蚴囊液蛋白质组学的分析研究
张 倩,李居怡,赵嘉庆,王亚娜,朱明星,赵 巍
细粒棘球蚴病(Echinococcosis)又称包虫病,是细粒棘球绦虫的幼虫(即棘球蚴)感染寄生所致的一种人畜共患性寄生虫病[1-5]。该病严重危害人类健康和畜牧业生产,在我国主要流行于新疆、甘肃、青海、宁夏、内蒙古、西藏、陕西和四川西部等畜牧业地区[6-9],目前已经证实我国有25个省区存在感染病例[10]。据调查显示,2004—2008年全国包虫病报告病例累计10 790例,涉及27个省,病例报告的范围呈扩大趋势,其中宁夏回族自治区共报告962例[11-13]。由于缺乏对棘球蚴的生长、发育以及其在人体内生长环境的深入研究和认识,目前包虫病的防治效果并不理想,有关包虫囊液营养代谢成分的研究报道多集中在家畜,如牛、羊等[14-15],而关于人体肝包虫囊液中蛋白成分研究鲜见报道。本研究拟运用蛋白质组学技术对细粒棘球蚴囊液的蛋白质成分进行初步研究,分析棘球蚴生长环境的蛋白质及构成情况,为深入了解细粒棘球绦虫幼虫的生长环境和所需营养物质、蛋白代谢途径以及发育过程奠定基础,亦为寻找有效控制手段提供新的研究思路。
1 材料与方法
1.1 标本来源 取宁夏医科大学附属医院肝胆外科为包虫病患者实施手术后摘除的包囊。
1.2 仪器与试剂 MALDI-TOF质谱仪(Waters)、Bio-Rad电泳仪、Bio-Rad电泳槽、Bio-Rad凝胶扫描仪、Bio-Rad切胶仪、Power Dry LL3000冻干机(Thermo)、SmartSPECTM核酸蛋白微量分析仪(Bio-Rad)、高速冷冻离心机(日本HITACHI)、超声波细胞破碎仪(昆山市超声仪器有限公司)、-85℃超低温冰箱(美国NuAire公司)、超纯水仪(密理博贸易有限公司)、AE100电子天平(梅特勒-托利多)、320pH酸度计(梅特勒-托利多)、LQP-B-4颗粒制冰机(上海安亭科学仪器公司)、ES-135高压灭菌锅(日本TOMY公司)、可移动加样器(天根生化科技(北京)有限公司)、超净工作台(苏州净化设备厂)。
三氯醋酸 (TCA)、碘乙酰胺(Iodoacetamide)、胰蛋白酶(色谱纯)、二硫苏糖醇 (DTT)、CHAPS、PMSF(phenylmethylsulfonyl fluoride)、碳酸氢铵、CHCA、TFA(三氟乙酸),以上均购置于Sigma公司;矿物油(Mineral Oil)、Bio-Lyte 3/10、Ampholyte-40%等购于Bio-Rad公司;乙二胺四乙酸二钠(Na2EDTA·2H2O)、考马斯亮蓝G250、抑肽素 A、亮肽素(leupeptin)、SDS、溴酚蓝(Bromophenol Blue)、Tris-base、Tris-HCl、尿素、甘氨酸、丙烯酰胺(Acrylamide)、甲叉双丙烯酰胺(Bis)、过硫酸铵(Ammonium Persulfate)、TEMED、乙腈(ACN)、B-巯基乙醇等购置 BBI公司,冰乙酸、甘油、NaOH、HCl、丙酮(acetone)、甲醇、异丙醇、95%酒精、磷酸等均为国产。
1.3 方法
1.3.1 提取囊液:无菌条件下分离包虫单个小泡囊,抽取混合囊液,离心后沉淀为原头蚴、上清为原始囊液,于-80℃冰箱冷冻保存备用。
1.3.2 细粒棘球蚴囊液蛋白质提取:从-80℃冰箱取出冷冻保存的原始囊液样本,经室温融化,不经任何处理。取5 ml囊液于冻干机中冻干成粉末,加入适量上样缓冲液,置沸水中加热5 min,混匀后即为SDS-PAGE样品。分别利用直接裂解法、TCA-丙酮沉淀法[16]、Ready PrepTM2-D Cleanup Kit(除盐)、AurumTMSerum Protein Mini Kit(除高峰度蛋白),蛋白浓度测定均采用Bradford法[17]处理提取物。
1.3.3 双向电泳:蛋白样品在经过第一向等电聚焦电泳(7 cm、17 cm 的胶条,pH 3~10、pH 7~10)和第二向SDS-PAGE后,放入考马斯亮蓝溶液染色。
1.3.4 图像采集和分析:根据等电点和分子量不同在凝胶上将蛋白分离。采用GS-800 Calibrated Densitometer投射扫描,用 PDQuest 8.0 2D Analysis Software进行分析。
1.3.5 肽指纹图谱(PMF)的获取:取样品酶解液0.5 μl与基质 0.5 μl(CHCA 5 mg/ml加 45%乙腈,45%甲醇加0.1%TFA)混匀,点在上样板上。设置MALDI-TOF-MS程序,在反射模式,电压2000 V,肽质量片段m/z在800~3000 Da范围内进行分析,获得PMF。
1.3.6 蛋白质PMF检索及蛋白质鉴定:应用最新公布的蛋白质数据库SWISSPROT进行检索,查询结果以分数显示。分数大于阈值时即表示检索结果可信(P<0.05),否则检索结果不可信。
2 结果
2.1 细粒棘球蚴囊液蛋白的SDS-PAGE电泳结果SDS-PAGE电泳显示蛋白质主要分布在43.0~97.4 kD与14.4 kD,这2处蛋白高度表达,各类蛋白表达水平差异较大。这给后期的双向电泳的分离带来很大困难,会导致水平条纹的产生(见图1)。
2.2 细粒棘球蚴囊液二维电泳图谱的处理 囊液二维电泳图谱经 PDQuest 8.0 2D Analysis Software分析后,大概能捕捉到30个蛋白斑点(见图2),大部分蛋白分布在43.0 ~97.4 kD,而14.4 kD 处蛋白丢失较多,蛋白的等电点分布在PI 5~9之间。
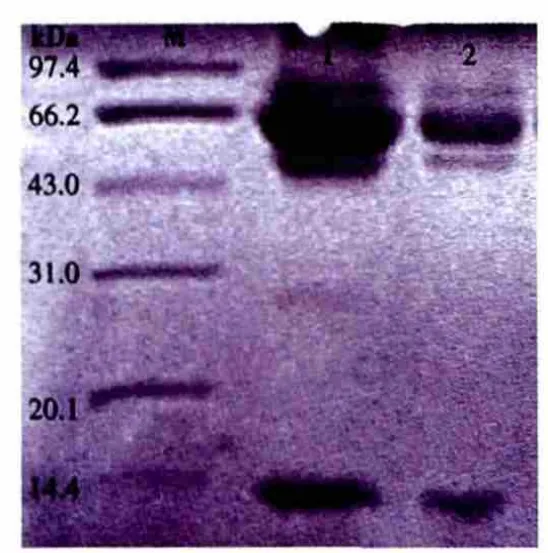
图1 细粒棘球蚴囊液蛋白的SDS-PAGE电泳
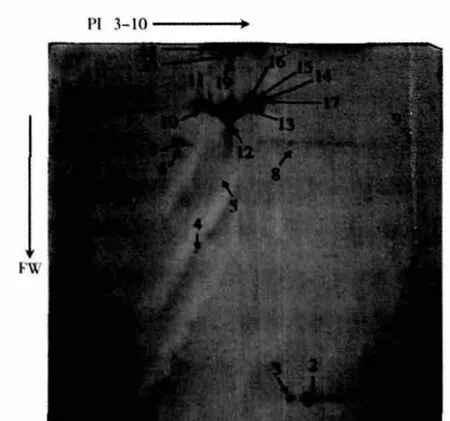
图2 细粒棘球蚴囊液蛋白质二维电泳图谱
2.3 细粒棘球蚴囊液中各种蛋白质的PMF的获取全自动凝胶切胶仪将图2上PDQuest 8.0 2D A-nalysis Software捕捉到的蛋白斑点切下,胶内酶解后MALDI-TOF-MS得到PMF,酶解后30种蛋白,通过质谱获取了21种蛋白,列举蛋白PMF见图3、4。

图3 细粒棘球蚴囊液蛋白质No.3蛋白肽指纹图谱

图4 细粒棘球蚴囊液蛋白质No.12肽指纹图谱
2.4 细粒棘球蚴囊液中各种蛋白质PMF的生物信息学分析 通过MASCOT软件将各蛋白的PMF文件上传到SWISSPROT数据库进行比对,发现No.3、12、16、18检索分数 >阈值70分,结果可信(P<0.05)(图 5、6),而 No.1检索分数为 27分(P >0.05),其他蛋白PMF检索结果评分较低,结果不可靠。从表1的鉴定结果来看,No.3为人 β-血红蛋白;No.12、18为人白蛋白;No.16为人血清铁传递蛋白。因细粒棘球绦虫基因组序列目前还未知,相关的蛋白数据库目前还不完善,所以囊液里面的其他蛋白斑点未能得到有效的鉴定。

图5 细粒棘球蚴囊液蛋白质No.3匹配结果
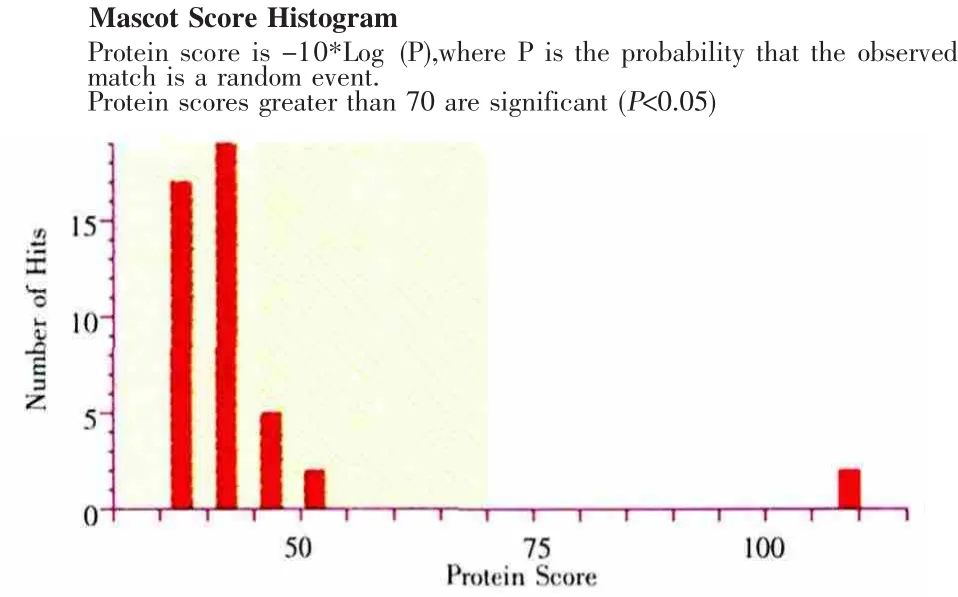
图6 细粒棘球蚴囊液蛋白质No.16匹配结果

表1 细粒棘球蚴囊液蛋白质肽指纹图谱MASCOT检索鉴定结果
3 讨论
蛋白质组学主要是通过双向电泳技术分离生物样品中的蛋白质,进而通过质谱获取每种蛋白的PMF,最终利用生物信息学分析工具将每种蛋白的PMF与已有的蛋白数据库数据进行检索比对,根据MASCOT评分结果对蛋白质结构、功能进行预测[18]。蛋白质组学技术是全面、有效、快速、可信的研究手段,利用它分析囊液的蛋白构成是准确的,并且可以结合生物信息学技术做很好的对比分析。通过各种条件的比较发现采用17 cm、PH 7~10的胶条,上样量为200 μg,TCA-丙酮沉淀法,能够使囊液中的蛋白在二维电泳图谱上得到更有效的分离,蛋白斑点较多、更清晰,但缺陷是有些偏酸性蛋白可能就丢失了;而除高丰度蛋白的方法不利于囊液二维电泳图谱的建立。赵慰先等发现人体棘球蚴囊液中几乎为白蛋白和球蛋白,而其他蛋白含量非常少,其中44%为白蛋白,α-球蛋白及β-球蛋白占39%,而17%为γ-球蛋白,且囊液中的蛋白质具有抗原性[19]。本实验将细粒棘球蚴囊液中的蛋白根据不同的分子量及等电点采用双向电泳进行有效分离,发现囊液中约有30种蛋白,集中在43.0~97.4 kD与14.4 kD,PI在5~9之间。揭示囊液中主要是以白蛋白和球蛋白为主,其他蛋白种类和含量均很少。
经过MALDI-TOF-MS对囊液凝胶上每个酶解后的蛋白进行处理,获取了21种蛋白的PMF,而其余9个斑点未能成功获取,其原因可能是:①PDQuest 8.0 2D Analysis Software 分辨率较高,对于非常微量的蛋白,经切胶酶解后打质谱,因未达到质谱要求浓度级别而未获取;②比较微量的蛋白在酶解时因其含量的损失达不到质谱要求浓度未获取。
目前有关蛋白质的数据库较多,其中SWISSPROT数据库是规模最大、数据最全的,根据酶解方法选择相应的搜索选项,将获取的蛋白PMF与数据库中已知的数据进行比对,根据评分结果的高低,可对未知蛋白做大致的定性分析。Coltorti等[20]研究发现细粒棘球蚴囊液中的白蛋白、球蛋白来自于宿主组织,它是通过扩散的方式进入包虫囊中,并不是通过主动吸收过程,因为血清中的蛋白是囊液中的1000~10000倍。本研究根据MASCOT评分结果初步鉴定出囊液中含有血清铁传递蛋白、白蛋白、β-血红蛋白3种,其他蛋白因评分很低,结果不可信。通过生物信息学手段分析血清铁传递蛋白、白蛋白、β-血红蛋白均来自于人体本身。推测3种蛋白在棘球蚴生长发育过程中可能发挥以下作用:①人血清铁传递蛋白可能是为运输原头蚴生长所需要的铁而发挥作用;②人体白蛋白可能为原头蚴生活提供必要的能源物质;③人血红蛋白可能是为细粒棘球蚴原头蚴运输氧气和二氧化碳,以维持囊液的酸碱平衡。
综上所述,本实验初步建立了细粒棘球蚴囊液双向电泳图谱,为后期研究细粒棘球蚴囊液的蛋白质组成提供基础数据和比对图谱,而囊液里面的其他蛋白未得到有效鉴定,还需进一步深入研究。
[1]潘卫庆,汤林华.分子寄生虫学[M].上海:上海科学技术出版社,2004,9:345-369.
[2]赵宝魁,鲍海华.包虫病的CT和MR诊断及新技术进展[J].中国医药导报,2012,9(15):5-7.
[3]王长友,张国志,王胜,等.腹腔包虫病60例诊治分析[J].中国煤炭工业医学杂志,2012,15(8):1184-1185.
[4]李辉,张雪林.肝囊性包虫病的CT分型及其临床应用价值[J].中国医学影像学杂志,2010,(1):39-42.
[5]巫姜,李涛,张志,等.肝囊型包虫病患者外周血单个核细胞表面程序性死亡受体配体1的表达及其与干扰素-γ的关系[J].中华消化外科杂志,2012,11(3):275-278.
[6]Craig P S.Epidemiology of human alveolar echinococcosis in China[J].Parasitology International,2006,55(S1):221-225.
[7]冯丽萍.肝包虫病的超声声像图特征及其诊断价值[J].中国医学影像学杂志,2009,(1):69-71.
[8]玛地努尔·司马义.卵巢包虫病误诊为卵巢肿瘤7例分析[J].中国医药导报,2010,7(28):123.
[9]牛少雄,牛建华,木拉提,等.紧邻肝内外大血管肝包虫囊肿的外科治疗[J].中华消化外科杂志,2009,8(1):66-67.
[10]朱佑明,李文桂.细粒棘球绦虫分子生物学研究进展[J].中国寄生虫病防治杂志,2005,18(3):217-220.
[11]王立英,伍卫平,朱雪花.2004~2008年全国包虫病疫情分析[J].中国人兽共患病学报,2010,26(7):699-702.
[12]张志刚,庄仕华,王佐.临床罕见的肝包虫残腔结石术前误诊[J].临床误诊误治,2011,24(5):19.
[13]牛鸣,朱金德,蔺军,等.甘肃省肃南县皇城地区包虫病流行病学调查与防治对策[J].中国医药科学,2011,1(24):115-116.
[14]Chemale1 G,Van Rossum A J,Jefferies J R,et al.Proteomic analysis of the larval stage of the parasite Echinococcus granulosus:Causative agent of cystic hydatid disease[J].Proteomics,2003,3(8):1633-1636.
[15]朱昌亮,叶炳辉,朱晓龙,等.棘球蚴囊液、头节和囊壁抗原的二维电泳初步研究[J].中国人兽共患病杂志,1989,5(2):27-29.
[16]Cilia M,Fish T,Yang X,et al.A comparison of protein extraction methods suitable for gel-based proteomic studies of aphid proteins[J].J Biomol Tech,2009,20(4):201-215.
[17]Noble J E,Bailey M J.Quantitation of protein[J].Methods Enzymol,2009,463:73-95.
[18]鲁晓风.多房棘球绦虫原头节蛋白质组学研究[D].厦门大学,2007.
[19]赵慰先.人体寄生虫学[M].北京:人民卫生出版社,1987:514-517.
[20]Coltorti E A,Varela-Díaz V M.IgG levels and host specificity in hydatid cyst fluid[J].J Parasitol,1972,58(4):753-756.

