外源性基质细胞衍生因子-1α对大鼠脑梗死后远隔部位细胞增殖和血管再生的影响☆
凌莉张素平吉章阁黄惠鸿何锐王慕真邓婉青
脑梗死后的血管再生指从预先存在的脑血管中长出新生毛细血管的过程,包括血管内皮细胞的增殖、迁移和分化;细胞外基质降解、管腔形成和毛细血管生成等多个步骤。研究表明,多种外源性促血管再生因子可以促进脑梗死后局部缺血组织的血管再生[1-3]。近年来,国内外学者对脑梗死的研究除继续关注于局部缺血组织外,对远隔部位的继发性损伤也日益重视,发现远隔损伤对脑梗死后期神经功能的恢复有重要影响[4-6]。我们之前的研究发现,脑梗死发生后,除局部缺血组织的新生血管明显增加外,在远离梗死灶的远隔部位亦存在血管再生现象[7],提示外源性给予促血管再生因子有可能通过促进远隔部位的血管再生来减轻远隔损伤,从而加快脑梗死后神经功能的恢复。基质细胞衍生因子-1α(Stromal-derived factor-1,SDF-1α)是一种促血管生成因子。研究表明,SDF-1α可促进下肢动脉闭塞、心肌梗死及脑缺血等疾病局部缺血组织的血管再生[8-10]。迄今为止,尚无SDF-1α对脑梗死后远隔部位影响的报道。本研究采用成年大鼠的局灶性大脑皮层梗死模型,观察连续性侧脑室注射SDF-1α对远离梗死灶的同侧丘脑细胞增殖和血管再生的影响,并探讨其可能的机制。
1 材料与方法
1.1 实验动物的脑梗死模型制作及分组采用220 g~250 g的健康雄性Sprague-Dawley大鼠(广东省医用实验动物中心提供)45只,参考Chen等方法[11]行右侧大脑中动脉皮层支永久性闭塞(middle cerebral artery occlusion,MCAO)并双侧颈总动脉短暂性结扎,制作局灶性大脑皮层梗死大鼠模型。造模时以手术显微镜下观察大鼠的右侧大脑中动脉皮层支远端血流完全消失为造模成功,造模过程中死亡4只,造模不成功5只。所有大鼠于MCAO术前1周在麻醉状态下通过大鼠脑立体定位仪(型号BW-SAd902,中国上海软隆科技公司)安装侧脑室微量给药系统(the trace drug delivery system,TDDS,中国深圳瑞沃德公司),侧脑室的立体定位坐标参照Waston&Paxinos的大鼠脑立体定位图谱,即:AP(前囟向后):+1.0 mm;L(矢状缝右侧旁开):+1.5 mm;H(深度):+4.5 mm。
将36只造模成功的MCAO大鼠随机分为SDF-1α治疗组、溶剂对照组和SDF-1α+CXCR4拮抗剂组,每组各12只。SDF-1α治疗组于MCAO术后1 h起,通过5 μL微量注射器连接至预先留置于右侧侧脑室内的TDDS注射内管,将生理盐水配制的重组大鼠SDF-1α(rm SDF-1α,R&D公司,美国)溶液缓慢注射至右侧侧脑室,1 μg/d,连续6 d。注射完后留置10 min,消毒后将套管帽装回。溶剂对照组通过侧脑室TDDS注射同一剂量和疗程的生理盐水。SDF-1α+CXCR4拮抗剂组则每天于SDF-1α注射前先皮下注射CXCR4拮抗剂AMD3100(R&D公司,美国),1 mg/d,连续6 d。
1.2 5-溴脱氧尿嘧啶核苷腹腔注射标记新增殖细胞为标记新增殖的细胞,各组大鼠从处死前3 d前起每隔12 h经腹腔注射5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine,BrdU,50 mg/kg,Sigma-Aldrich公司,美国)。
1.3 脑梗死体积测定按照文献方法[12],通过苏木素-伊红染色(Hematoxylin and Eosin Staining,HE)计算各组大鼠的相对脑梗死体积,结果以梗死体积占对侧大脑组织的相对百分比表示。
1.4 灌注、取材及制片分别在MCAO术后第7 d和14 d处死大鼠,经10%水合氯醛(3.5 mL/kg)腹腔麻醉后通过升主动脉先后灌注4℃肝素化的生理盐水及4%多聚甲醛。开颅取脑,脑组织后固定6 h,然后置于10%、20%和30%的蔗糖溶液进行梯度脱水。于恒温冰冻切片机行冰冻切片,片厚10 μm,晾干后存放于-80℃冰箱。
1.5 免疫荧光法检测将冰冻切片复温,用0.01M PBS(pH=7.4)漂洗3次;其中行BrdU染色的切片需经2NHCl及0.1M硼酸溶液(pH=8.5)预处理。驴血清封闭1 h后滴加一抗小鼠抗大鼠BrdU(1:600,Sigma公司,美国)和兔抗大鼠laminin(1:400,Sigma公司,美国)于4℃冰箱孵育过夜。0.01M PBS漂洗3次后滴加荧光二抗Alexa Flour 488及594(均为 1:300,Invitrogen 公司,美国),避光室温孵育1.5 h。最后用荧光封片剂封片。阴性对照片均采用0.01M PBS作为一抗替代物。荧光图像通过荧光显微镜(Olympus BX51,日本)采集并使用NIH ImageJ 1.38 for Windows软件进行分析。
1.6 统计学方法全部数据均采用SPSS for windows 17.0进行统计分析,等级资料行Mann-Whitney U非参数检验,计量资料行单因素方差分析(ANOVA)或t检验,检验水准α=0.05。
2 结果
2.1 脑梗死灶定位HE染色显示,所有MCAO大鼠的梗死灶均局限于右侧颞顶叶皮层,梗死大小较为一致且梗死范围不涉及纹状体及丘脑。
2.2 脑梗死体积测定MCAO术后7 d和14 d,SDF-1α治疗组大鼠的脑梗死体积较同时点溶剂对照组减少(术后7 d:12.3%±0.68%vs.20.6%±1.02%、术后14 d:10.4%±0.90%vs.17.8%±0.77%,P<0.05);而SDF-1α+CXCR4拮抗剂组大鼠的脑梗死体积较 SDF-1α组增加(术后 7 d:17.2%±0.84%vs.12.3%±0.68%%、术后 14 d:15.0%±0.86%vs.10.4%±0.90%,P<0.05)。
2.3 SDF-1α治疗促进梗死侧丘脑的细胞增殖在MCAO术后,各组大鼠梗死侧的丘脑腹后外侧核(ventroposterior nucleus,VPN)内均出现BrdU标记的新增殖细胞,术后14 d较7 d时细胞增殖明显。在术后各时间点,SDF-1α治疗组梗死侧丘脑VPN内BrdU+细胞表达较同时点溶剂对照组升高(P<0.05,见图1);而SDF-1α+CXCR4拮抗剂组与同时点SDF-1α治疗组相比,梗死侧丘脑VPN内BrdU+细胞表达则减少(P<0.05,见图1)。
2.4 SDF-1α治疗促进梗死侧丘脑的血管密度增加 Laminin是血管的标记物,免疫荧光检测发现,在MCAO术后第7 d和14 d,与同时点溶剂对照组比较,SDF-1α治疗组梗死侧丘脑VPN内的血管密度增加(P<0.05,见图2);而SDF-1α +CXCR4拮抗剂组与同时点SDF-1α治疗组相比,其梗死侧丘脑VPN内血管密度则减少(P<0.05,见图2)。
2.5 SDF-1α治疗促进了梗死侧丘脑的新生血管细胞表达为了进一步证实外源性SDF-1α对脑梗死后远隔部位血管再生的促进作用,本研究采用BrdU与laminin免疫双标阳性来标记新增殖的血管内皮细胞。在MCAO术后第7 d和14 d,SDF-1α治疗组梗死侧丘脑VPN内BrdU+/laminin+细胞数目较同时点溶剂对照组(P<0.05,见图3)增加;与同时点SDF-1α治疗组相比,SDF-1α+CXCR4拮抗剂组梗死侧丘脑VPN内BrdU+/laminin+细胞数则减少(P<0.05,见图3)。从形态上看,存在BrdU+标记新增殖细胞的血管明显增宽变长,且血管壁变薄。
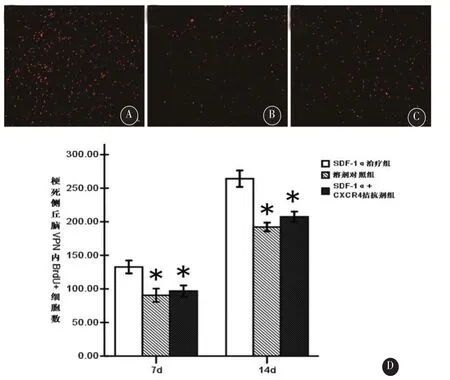
图1 各组大鼠梗死侧丘脑VPN内的细胞增殖A-C为MCAO术后14 d梗死侧丘脑VPN内BrdU+细胞代表性图像:A:SDF-1α组;B:溶剂对照组;C:SDF-1α+CXCR4拮抗剂组。标尺为100μm。D为MCAO术后7 d和14 d三组大鼠梗死侧丘脑VPN内BrdU+细胞数误差限直条图。*:与同时点SDF-1α治疗组比较,P<0.05
3 讨论
SDF-1是CXC趋化因子家族的一个成员,来源于骨髓基质细胞,分为SDF-1α和SDF-1 β两个亚型。SDF-1通过与其特异性受体CXCR4结合介导细胞的增殖、迁移及骨髓造血干细胞的动员等多种生物学效应。近年来,作为一个促血管再生因子,SDF-1α在缺血性疾病中的治疗性血管再生作用备受关注。研究发现,下肢缺血、心肌梗死及脑梗死等缺血性疾病发生后,SDF-1α可内源性地表达上调,而外源性SDF-1α治疗能有效地促进局部缺血组织的血管再生[8-10],其机制可能与SDF-1/CXCR4信号通路调控骨髓来源的内皮祖细胞动员并归巢至局部缺血组织[13]有关。
此外,除了专注于局部缺血脑组织的研究,国内外学者对脑梗死后继发性的远隔损伤也日益重视。越来越多的研究表明,脑梗死发生后,在远离梗死灶的部位(如梗死侧丘脑、黑质、脊髓等)存在继发性损伤和血管再生,这些对脑梗死后长期的神经功能恢复有着重要影响[4-6]。而新近研究发现脑梗死患者外周血的SDF-1α水平与卒中的严重程度及卒中后长期的神经功能恢复有密切关系[14-15]。因此,本研究探讨外源性SDF-1α对脑梗死后远隔部位的可能影响。我们从在大鼠急性脑梗死后1h从侧脑室连续性注入SDF-1α,发现大鼠的脑梗死体积较溶剂对照组及SDF-1α+CXCR4拮抗剂组减少,表明SDF-1α治疗可减少脑梗死体积,且对急性脑梗死的神经保护作用可被其特异性受体CXCR4拮抗剂阻断。本研究结果显示,远离梗死灶的同侧丘脑VPN内BrdU表达升高及血管密度增加,提示SDF-1α治疗可促进脑梗死后远隔部位的细胞增殖及血管再生。除血管密度增加外,本研究还发现SDF-1α治疗组梗死侧丘脑VPN的血管呈现出变宽变长的形态,增宽的血管壁上附着较多有BrdU标记的新生细胞核且新生的血管内皮细胞数目增加,这些进一步证实了外源性SDF-1α治疗对脑梗死后远隔部位的促血管再生作用。这种促血管作用在MCAO术后14 d时较7 d时更为明显,与继发性远隔损伤发生在脑梗死后稍晚期在时间上是一致的。结合SDF-1α治疗可减少脑梗死体积,我们推测,SDF-1α治疗对脑梗死的神经保护作用可能与其促进远隔部位的细胞增殖和血管再生从而减轻远隔损伤有关,而CXCR4拮抗剂可抑制梗死侧丘脑VPN的细胞增殖和血管再生,提示外源性SDF-1α部分通过激活SDF-1α/CXCR4信号通路来促进远隔部位的细胞增殖和血管再生。

图2 各组大鼠梗死侧丘脑VPN的血管密度 A、B、C分别为术后14 d时 SDF-1α组、溶剂对照组及SDF-1α+CXCR4拮抗剂组大鼠梗死侧丘脑VPN的laminin+表达(绿色)。标尺为100μm。E为MCAO术后7 d和14d三组大鼠梗死侧丘脑VPN内血管密度的误差限直条图。*:与同时点SDF-1α治疗组比较,P<0.05

图3 各组大鼠梗死侧丘脑VPN内的新生血管内皮细胞表达 A、D及G分别为MCAO术后14 d时SDF-1α组、溶剂对照组及SDF-1α+CXCR4拮抗剂组大鼠梗死侧丘脑VPN内laminin+表达(绿色),B、E及H分别为术后14 d时以上三组BrdU+表达(红色);C、F及I为术后14 d时以上三组BrdU+/laminin+的新生血管内皮细胞(黄色)。标尺为50μm。J为MCAO术后 7 d和14d三组大鼠梗死侧丘脑VPN内BrdU+/laminin+标记的新生血管内皮细胞误差限直条图。*:与同时点SDF-1α治疗组比较,P<0.05
本研究采用成年大鼠的局灶性大脑皮层梗死模型,术中闭塞右侧大脑中动脉皮层支,梗死灶仅局限于右侧颞顶叶皮层。丘脑由大脑后动脉供血,故其不受MCAO影响。由此可知,外源性SDF-1α促进的梗死侧丘脑VPN的细胞增殖和血管再生,不是缘于MCAO造成的直接损伤所引发的局部代偿,而是对急性脑梗死后远隔部位继发性损伤的一种有效防治措施,有可能对脑梗死后期神经功能的恢复起积极的作用。
本研究的结果发现,大鼠急性脑梗死发生后,连续性侧脑室注入SDF-1α可减少脑梗死体积,并促进远离梗死灶的同侧丘脑VPN内细胞增殖及血管再生,其作用可能部分通过SDF-1/CXCR4轴实现。我们的研究从促进脑梗死后远隔部位细胞增殖和血管再生的角度为减轻脑梗死后远隔损伤、促进神经功能恢复提供了新的思路。
[1]Avraham Y,Dayan M,Lassri V,et al.Delayed leptin administration after stroke induces neurogenesis and angiogenesis[J].J Neurosci Res,2013,91(2):187-195.
[2]Wang Z,Tsai LK,Munasinghe J,et al.Chronic valproate treatment enhances postischemic angiogenesis and promotes functional recovery in a rat model of ischemic stroke[J].Stroke,2012,43(9):2430-2436.
[3]Ling L,Hou Q,Xing S,et al.Exogenous kallikrein enhances neurogenesis and angiogenesis in the subventricular zone and the peri-infarction region and improves neurological function after focal cortical infarction in hypertensive rats[J].Brain Res,2008,1206:89-97.
[4]Zhang J,Zhang Y,Xing S,et al.Secondary neurodegeneration in remote regions after focal cerebral infarction:a new target for stroke management?[J].Stroke,2012,43(6):1700-1705.
[5]Dang C,Liu G,Xing S,et al.Longitudinal Cortical Volume Changes Correlate With Motor Recovery in Patients After Acute Local Subcortical Infarction[J].Stroke,2013[Epub ahead of print].
[6]梁志坚,张中伟,曾进胜,等.DTI态观察脑梗死后颈髓皮质脊髓束继发性损害[J].中国神经精神疾病杂志,2010,36(1):10-13.
[7]Ling L,Zeng J,Pei Z,et al.Neurogenesis and angiogenesis within the ipsilateral thalamus with secondary damage after focal cortical infarction in hypertensive rats[J].J Cereb Blood Flow Metab.2009,29(9):1538-1546.
[8]Grochot-Przeczek A,Dulak J,Jozkowicz A.Therapeutic angiogenesis for revascularization in peripheral artery disease[J].Gene,2013,525(2):220-228.
[9]Tang J,Wang J,Song H,et al.Adenovirus-mediated stromal cell-derived factor-1 alpha gene transfer improves cardiac structure and function after experimental myocardial infarction through angiogenic and antifibrotic actions[J].Mol Biol Rep,2010,37(4):1957-1969.
[10]Shyu WC,Lin SZ,Yen PS,et al.Stromal cell-derived factor-1 alpha promotes neuroprotection,angiogenesis,and mobilization/homing of bone marrow-derived cells in stroke rats[J].J Pharmacol Exp Ther,2008,324(2):834-849.
[11]Chen ST,Hsu CY,Hogan EL,et al.A model of focal ischemic stroke in the rat:reproducible extensive cortical infarction[J].Stroke,1986,17(4):738-743.
[12]Swanson RA,Morton MT,Tsao Wu G,et al.A semiautomated method for measuring brain infarct volume[J].J Cereb Blood Flow Metab,1990,10(2):290-293.
[13]Yamaguchi J,Kusano KF,Masuo O,et al.Stromal cell-derived factor-1 effects on ex vivo expanded endothelial progenitor cell recruitment for ischemic neovascularization[J].Circulation,2003,107(9):1322-1328.
[14]Schutt RC,Burdick MD,Strieter RM,et al.Plasma CXCL12 levels as a predictor of future stroke[J].Stroke,2012,43(12):3382-3386.
[15]Kim YS,Baek W,Kim MK,et al.Association between serum stromal cell-derived factor-1α and long-term outcome of acute ischemic stroke[J].Eur Neurol,2012,67(6):363-369.

