栀子ERF基因的克隆及其在果实成熟过程中的表达
高蓝 卢静雯
植物激素通过调节有关基因的表达来调控植物的生长发育和植株对逆境胁迫的应答反应。其中乙烯可以调控植物的生长发育。如花的发育[1],果实的成熟过程[2],以及对病源侵染[3,4]、低氧[5]、低温及干旱等逆境胁迫的应答反应[6]。在一些植物中,已知被植物激素乙烯调节的相关基因含有顺式作用元件GCC盒(AGCCGCC序列)[7]。乙烯反应元件因子(ERF)可以辨认结合GCC盒[8],是乙烯信号传导中涉及的一类转录因子,已在多种植物中被分离鉴定。如烟草中的NtERF[9]、拟南芥的AtERF[10]、番茄的 leERF 和 Pti[3,11]、矮牵牛(Petuniahybrida)的 PhERF[1]、水稻的 OsERF[12]和大豆的GmEREBP1[13]等。ERF转录因子家族都含有一个保守的由60个左右氨基酸组成的结构域(ERF结构域),与拟南芥中的蛋白APETALA2的AP2结构域相似[14],是AP2/ERF转录因子家族中的ERF亚类,与DNA以单体的形式结合。ERF结构域含有3个反平行的β-折叠和一个α-螺旋结构[15],其中这3个β-折叠结构在识别顺式作用元件的过程中具有重要作用。全基因组分析表明,拟南芥有122个ERF蛋白基因,水稻有139个ERF蛋白基因[12]。对各种植物的ERF的功能和表达研究则相对不多,如在拟南芥中只有少数ERF蛋白已经确认参与了对胁迫或对乙烯的应答反应[10,16]。在番茄中,已知Pto蛋白激酶是对丁香假单胞杆菌番茄致病变种(Pseudomonas syringae pv.Tomato)的抗性蛋白,Pti4、Pti5和Pti6蛋白可结合于Pto蛋白激酶基因的顺式作用元件,促进该激酶的表达[3]。苹果的MdERF3,MdERF4,MdERF5和MdERF6因子在灰霉病菌(Botrytis cinerea)感染时表达增加,并可受乙烯的诱导[4],瞬间在烟草中表达MdERF3可增加含GCC盒的几丁质酶的表达。在番茄中的LeERF1与果实的成熟相关,过表达ERF可增进番茄果实的软化和成熟[2]。
ERF类转录因子参与植物的多种生理过程和生长发育的调节,对于相关基因的分离及其表达和功能的研究有重要意义。本研究从栀子中分离GjERF的cDNA,并分析其在栀子不同组织和发育时期转录水平的表达,旨为研究其作用机理奠定基础。
1 材料与方法
1.1 材料
栀子(Cardenia jasminoides)培养于广东药学院,随着栀子果实的发育,采摘果肉为无色(发育期Ⅰ)及果肉为橙黄色(发育期Ⅱ)的栀子果实。并采摘栀子的成熟叶片。果实及叶片均经液氮中速冻后,冷冻于-80℃。
1.2 方法
1.2.1 栀子cDNA文库的构建及随机测序获得GjERF基因序列 从栀子果实(发育期Ⅱ)中以CTAB[17]改良法提取总RNA,在液氮中研磨栀子果实,加入65℃ CTAB提取液(2% CTAB(W/V),2% PVPK30(W/V),100mmol/L Tris-HCl(pH8.0),25mmol/L EDTA(pH8.0),2.0mol/L NaCl)和 4%(V/V)β-疏基乙醇,保温30min。接着以12000×g 在4℃离心10min,上清液加等体积苯酚∶氯仿∶异戊醇(25/24/1,V/V)抽提,接着以12000×g离心20min。水相加等体积4mol/L LiCl溶液沉淀RNA,4℃过夜。以12000 ×g离心20min,RNA沉淀以DEPC水溶解,接以0.1体积的3mol/L NaOAC(pH5.2)和2倍体积的无水乙醇在-20℃沉淀1h。最后以12000 ×g离心20min,RNA沉淀以75%乙醇洗涤,挥干后以DEPC水溶解。总RNA用于构建cDNA文库,采用CreatorTMSMARTTMcDNA文库构建试剂盒(Clontech公司,美国)构建栀子果实的cDNA文库,按试剂盒说明书提供的方法操作。栀子的cDNA插入在质粒pDNR-LIB中,转入Escherichia coli strain DH5α。
在cDNA文库中,随机挑取单克隆,分别对每个单克隆进行菌落PCR。挑取单克隆加入到25μL的超纯水中,在PTC-200 PCR仪(MJ Research,USA)上加热至95℃裂解5min,制得裂解液。接着以M13引物对用于检测pDNR-LIB中的插入序列(CreatorTMSMARTTMcDNA文库构建试剂盒中提供),即对以上裂解液进行PCR扩增反应。采用PrimeStarTMHS DNA polymerase(TaKaRa公 司, 大连宝生物公司),反应条件为:94℃变性5min,40轮循环的 94℃ 30s,60℃ 30s,72℃ 2min,最后72℃延伸7min。扩增产物以1.2%的琼脂糖凝胶电泳检测,将片段长度大于750bp的相应的单克隆挑出进行液体培养,送华大基因完成测序。在随机测序的序列中获得了GjERF序列。
为了获得GjERF基因的ORF序列,设计了以下引物,5'端引物为5'-GGAATTCCATATGTGTGGA GGTGCAATCATCGACG-3',含有NdeI酶切位点。 3'端引物为5'-CCGACTCGAGTTAATACAGCAGATTAT TAGGCTGCTGGGCT-3',含有Xho I酶切位点。将含有目的基因的菌种加入含氯霉素抗性的LB培养液,在37℃,150r/min摇床培养过夜。接着以4000r/min离心菌液5min。挑取菌体沉淀加入到50μL的超纯水中,95℃裂解5min,制得裂解液。做菌落PCR,得到目的DNA。PCR反应条件为94 ℃变性5min,接 35轮循环的 94℃ 30s,63.5℃ 30s,72℃ 1.5min,最后72℃延伸7min。扩增产物以1.2%的琼脂糖凝胶电泳检测。
1.2.2 序列分析和空间结构预测 基因序列中的ORF以及预测编码蛋白的保守域的搜索以ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/)和 BLAST进行。多重序列比对以在线ClustalW2(http://www.ebi.ac.uk/clustalw/index.html)进行。进化分析以Mega 4软件中的neighbor-joining算法完成。空间结构预测以SWISS-PDB软件在线分析完成。
1.2.3 GjERF基因的转录水平表达分析 分别取栀子发育期Ⅰ和Ⅱ的果实及栀子的成熟叶片,3种样品按1.2.1方法提取总RNA,以Prime Script one step RT-PCR试剂盒(TaKaRa,大连宝生物公司),按试剂盒说明书将GjERF的mRNA反转录为cDNA。引物为:正向:5'-GCTTCCAAGCTCAGCCTTACTA-3',反 向:5'- AGATCATCCAGCATCCAGAGAC-3'。RTPCR的内标为栀子的RPS25-1(核糖体小亚基的25-1蛋白,GenBank登录号GU797554),其扩增引物为:正向:5'- CAGAAGAAGAAGAAGTGGAGCAA-3',反向:5'- GTTCTTGAACCACTTGATGGTCT-3'。扩增反应进行二次,PCR反应条件均为:94℃变性5min,接 35轮循环的 94℃ 30s,55℃ 30s,72℃ 1min,最后72℃延伸10min。
2 结果
2.1 栀子GjERF基因的克隆
从栀子果实cDNA文库中随机筛选获得栀子乙烯反应元件结合蛋白ERF的cDNA,命名为GjERF,GenBank登录号为HQ599862。该基因全长962bp,5'端非翻译区长82bp,3'端非翻译区长100bp,预测ORF为780bp,编码259个氨基酸,分子量为28.6kD,等电点为6.764。GjERF基因的ORF扩增结果见图1。
2.2 GjERF蛋白序列分析和空间结构预测
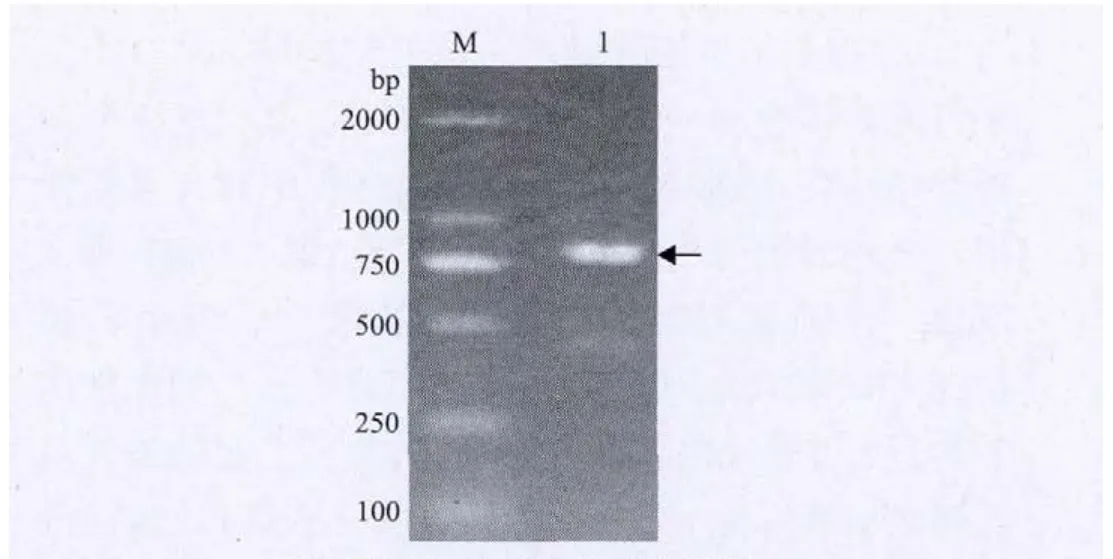
图1 GjERF 的ORF扩增电泳图
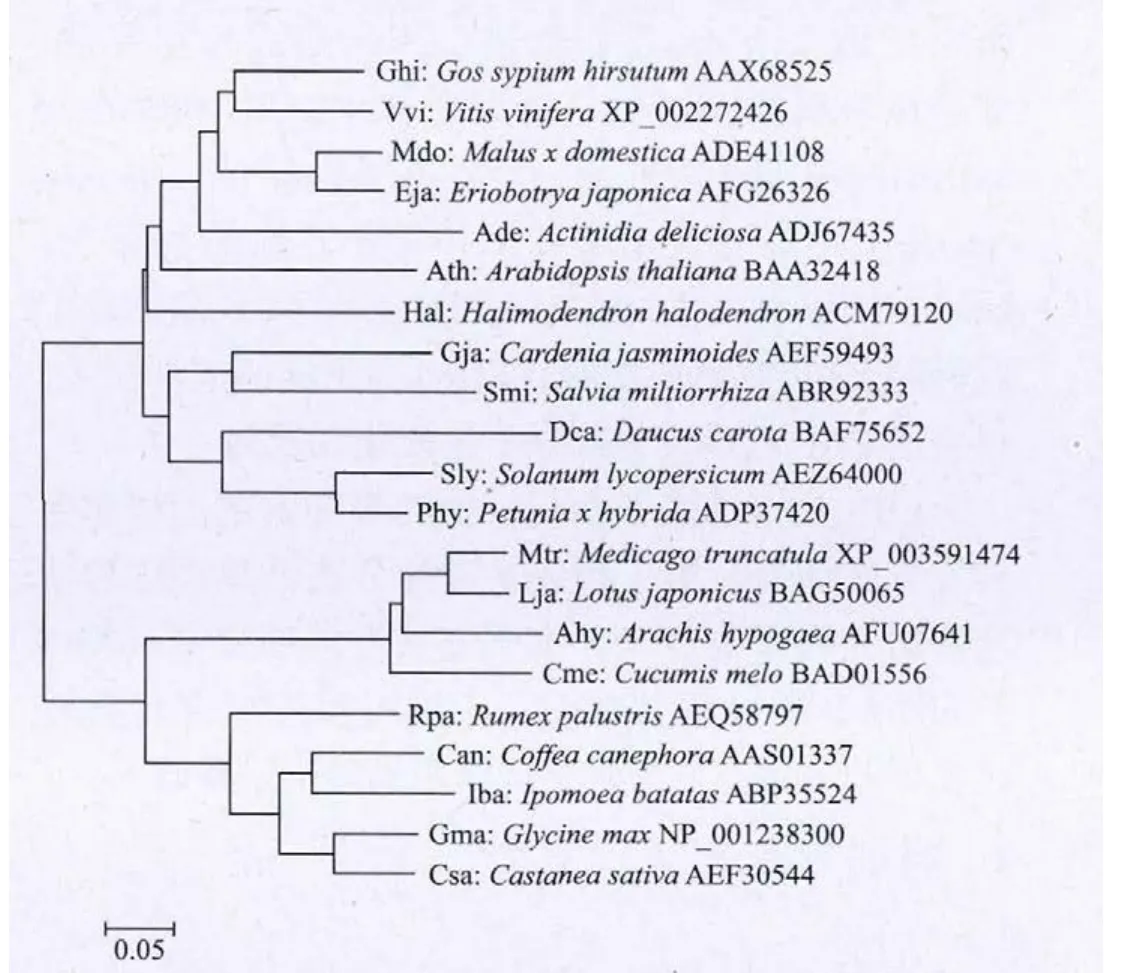
图2 GjERF的聚类分析
通过BLAST分析,GjERF的蛋白质序列含有AP2/ERF结构域,与多种植物的ERF相似。经ClustalW2比对和MEGA4.0分析,得到GjERF与20条在BLAST比对中与GjERF最相似的ERF的亲缘关系图,见图2。GjERF与唇形超目唇形科的丹参(Salviamiltiorrhiza)的ERF关系最近(序列相似度50.57%),栀子和丹参同属唇形超目。GjERF与金缕梅超目山毛榉科的欧洲栗(Castanea sativa)的关系较远(序列相似度25.86%)。将GjERF与丹参、棉花(Gossypiumhirsutum)、葡萄(Vitis vinifera)、番茄(Solanum lycopersicum)的ERF,以及来自拟南芥(Arabidopsis thaliana)AtERF1的ERF结构域(在PDB中的编号为1GCC_A,序列范围145-206)进行了比对,序列相似度分别为50.57%、49.09%、48.39%、44.09%和16.54%;而GjERF的AP2/ERF结构域(序列范围75-133)与这几种植物ERF的AP2/ERF结构域的相似度则在68.25%-86.89%范围,而在此结构域中推测与DNA有相互作用的氨基酸残基则在所有参比的ERF中完全相同,见图3。以1GCC_A为模板,由Swiss-model预测的GjERF中AP2/ERF结构域的二级结构也在图中标出。按照GjERF的序列结构,其N端具有未知功能的MC结构域(MCGGAII),因为这个显著特征,将其划分为ERF因子中的第Ⅶ类。

图 3 GjERF与5个ERF的序列对比
以来自拟南芥的AtE-RF1的ERF结构域(序列范围145-206)与DNA的GCC盒双链的复合物(即1GCC_A)为模板,该复合物中的DNA编码链序列为:5'-GCTAGCCGCCAGC-3',划线序列为GCC盒核心序列,另一条为互补链。1GCC_A的蛋白序列与GjERF的ERF结构域(序列范围75-133)的相似度为75.44%,由该复合物作为模板预测的GjERF的ERF结构域的3D结构,见图4。

图4 1GCC-A中ERF结构域与DNA复合物的空间结构及预测的GjERF中ERF结构域的空间结构
在1GCC_A结构中,拟南芥的ERF结构域与GCC盒通过3个β折叠在DNA的大沟处相互作用。从N到C端方向的第二个β-折叠几乎与α-螺旋平行,也与DNA编码链的5'到3'方向平行。主要涉及的作用有,结构域中的精氨酸的胍基与GCC盒中的鸟嘌呤经氢键互相作用,而精氨酸的骨架结构则与嘧啶碱基有疏水性相互作用。色氨酸与嘌呤碱基有疏水性相互作用。这些精氨酸和色氨酸残基除与碱基作用外,还与糖磷酸骨架有疏水性相互作用。DNA分子则在大沟的CG碱基对有约20℃的弯曲,有利于蛋白质与DNA之间的相互作用。预测的GjERF的空间结构与1GCC_A相似。
2.3 GjERF基因在果实发育过程中的表达
GjERF在栀子成熟叶片,发育期Ⅰ和Ⅱ的果实中的转录水平的表达,见图5。以特异引物扩增cDNA,以栀子RPS25-1作为内标。可看到,GjERF在叶片中的表达水平比在果实中高,随着果实的发育过程,GjERF转录水平的表达维持不变。

图5 GjERP在叶片和果实两个发育时期(Ⅰ和Ⅱ)转录水平的表达
3 讨论
ERF类转录因子作为AP2/ERF类转录因子中的一类,参与植物多种基因的表达从而调节植物的生长发育和对乙烯、生物和非生物性胁迫的反应。按照其蛋白质一级结构上的特点,有几种分类方法将ERF 类转录因子进一步分类[11,12,18,19]。其中 Nakano等[12]将拟南芥的122个ERF蛋白分为12族,包括Ⅰ-Ⅴ,Ⅵ-Ⅹ,Ⅵ-L和Xb-L。其中第Ⅶ类ERF类转录因子在其蛋白序列N端具有MC结构域。
在对第Ⅶ类ERF的研究中发现其在植物不同组织中的表达往往不同,并有多个ERF参与果实的成熟和衰老过程[20]。如番茄的LeERF2属于第Ⅶ类,它可被乙烯诱导,随果实的成熟转录水平的表达增加,在成熟抑制的番茄突变体Nr(Never-ripe),nor(non-ripening)和 rin(ripening inhibitor)中几乎不表达[20]。苹果(Malus domestica)的 MdERF1主要在成熟果实中表达,在其它组织中很少表达[21]。从李(Prunus salicina)中分离得到的PsERF2a和PsERF2b随果实的发育过程的表达则没有呈现递增或递减的规律,而是在花中高水平表达[22]。在猕猴桃(Actinidia deliciosa)中,AdERF4,AdERF5和AdERF6的表达则是AdERF4、AdERF 6随果实的发育成熟表达逐渐下降。另外,AdERF4在叶中的表达仅次于果实发育初期的水平;AdERF5的表达水平在所有组织和果实发育过程中均很低,相对的在花和成熟果实中有少量表达[23]。葡萄中的第Ⅶ类的VvERF057、VvERF058和VvERF059在葡萄由转熟期到全熟期的表达没有任何变化,而第Ⅸ类的两个ERF转录因子VvERF078和085则与几丁质酶,β-1,3-葡聚糖酶和甜蛋白随葡萄果实的发育过程同步表达[24]。对甜瓜品种河套蜜瓜果实中的第Ⅶ类ERF因子CMeERF2的表达的研究发现,随着果实的发育成熟过程及乙烯含量的增加而逐渐增加,在受粉后38d内其转录水平较低,乙烯含量较少;在受粉后40d时,果实内源乙烯含量达到峰值,其转录水平也达到峰值;在受粉后45d之后,随着果实内源乙烯水平的下降,其转录水平也下降。同时,也发现不属于第Ⅶ类ERF因子的CMeERF1的表达也有类似的规律[25]。所以第Ⅶ类ERF因子与果实的发育过程的关系也是复杂的,有时并不相关,而其它亚类的ERF因子也有可能与果实的发育成熟过程有关。本研究获得的GjERF基因在栀子叶片中的表达强于在果实中的表达,并不随果实的发育而增强,显示其表达与果实的发育无关并具有组织特异性。随着对植物AP2/ERF转录因子基因的克隆及基因的表达和功能的研究,将更有助于对植物的抗逆机制和生长发育的调控机理的深入了解。这是首次在栀子中分离ERF类转录因子及考察其在不同组织和发育时期表达的报道。
4 结论
克隆了栀子的GjERF基因,该基因预测编码第Ⅶ类ERF转录因子。该转录因子的ERF结构域预测可与顺式作用元件GCC盒发生相互作用。GjERF在栀子叶中的转录水平的表达强于在果实中的表达,并不随果实的发育而改变其表达水平。
[1] Liu J, Li J, et al.Identification and expression analysis of ERF transcription factor genes in petunia during flower senescence and in response tohormone treatments[J].J Exp Bot, 2011, 62:825-840.
[2] Li Y, Zhu B, et al.LeERF1 positivelymodulated ethylene triple response on etiolated seedling, plant development and fruit ripening and softening in tomato[J].Plant Cell Rep, 2007, 26(11):1999-2008.
[3] Zhou J, Tang X, Martin GB.The Pto kinase conferring resistance to tomato bacterial speck disease interacts with proteins that bind a ciselement of pathogenesis-related genes[J].EMBO J, 1997, 16(11):3207-3218.
[4] Akagi A, Dandekar AM, Stotz HU.Resistance of Malus domestica Fruit to Botrytis cinerea depends on endogenous ethylene biosynthesis[J].Phytopathology, 2011, 101(11):1311-1321.
[5] Gibbs DJ, Lee SC, Isa NM, et al.Homeostatic response tohypoxia is regulated by the N-end rule pathway in plants[J].Nature, 2011,479(7373):415-418.
[6] Shinozaki K, Yamaguchi-Shinozaki K, Seki M.Regulatory network of gene expression in the drought and cold stress responses[J].Curr Opin Plant Biol, 2003, 6(5):410-417.
[7] Ohme-Takagi M, Shinshi, H.Ethylene-inducible DNA binding proteins that interact with an ethylene-responsive element[J].Plant Cell, 1995, 7(2):173-182.
[8] Hao D, Ohme-Takagi M, Sarai A.Uniquemode of GCC box recognition by the DNA-binding domain of ethylene-responsive elementbinding factor(ERF domain)in plant[J].J Biol Chem, 1998,273(41):26857-6861.
[9] Fischer U, Dröge-Laser W.Over expression of NtERF5, a newmember of the tobacco ethylene response transcription factor family enhances resistance to tobaccomosaic virus[J].Mol Plant Microbe Interact, 2004, 17(10):1162-1171.
[10] Oñate-Sánchez L, Singh KB.Identification of Arabidopsis ethyleneresponsive element binding factors with distinct induction kinetics after pathogen infection[J].Plant Physiol, 2002, 128(4):1313-1322.
[11] Tournier B, Sanchez-Ballesta MT, Jones B, et al.Newmembers of the tomato ERF family show specific expression pattern and diverse DNA-binding capacity to the GCC box element[J].FEBS Lett,2003, 550(1-3):149-154.
[12] Nakano T, Suzuki K, Fujimura T, et al.Genome-wide analysis of the ERF gene family in Arabidopsis and rice[J].Plant Physiol, 2006,140(2):411-432.
[13] Zhang G, Chen M, Chen X, et al.Phylogeny, gene structures, and expression patterns of the ERF gene family in soybean(Glycinemax L.)[J].J Exp Bot, 2008, 59(15):4095-4107.
[14] Okamuro JK, Caster B, et al.The AP2domain of APETALA2defines a large new family of DNA binding proteins in Arabidopsis[J].Proc Natl Acad Sci USA, 1997, 94(13):7076-7081.
[15] Allen MD, Yamasaki K, Ohme-Takagi M, et al.A novelmode of DNA recognition by a beta-sheet revealed by the solution structure of the GCC-box binding domain in complex with DNA[J].EMBO J,1998, 17(18):5484-5496.
[16] Sakuma Y, Liu Q, Dubouzet JG, et al.DNA-binding specificity of the ERF/AP2domain of Arabidopsis DREBs, transcription factors involved in dehydration- and cold-inducible gene expression[J].Biochem Biophys Res Commun, 2002, 290(3):998-1009.
[17] Bekesiova I, Nap JP, Mlynarova L.Isolation ofhigh quality DNA and RNA from Leaves of the carnivorous plant Drosera rotundifolia[J].Plant Mol Biol Rep, 1999, 17(3):269-277.
[18] Allen MD, Yamasaki K, Ohme-Takagi M, et al.A novelmode of DNA recognition by a beta-sheet revealed by the solution structure of the GCC-box binding domain in complex with DNA[J].EMBO J,1998, 17(18):5484-5496,
[19] Fujimoto SY, Ohta M, Usui A, et al.Arabidopsis ethyleneresponsive element binding factors act as transcriptional activators or repressors of GCC box-mediated gene expression[J].Plant Cell, 2000, 12(3):393-404.
[20] Zhang Z, Zhang H, Quan R, et al.Transcriptional regulation of ethylene response factor LeERF2 in the expression of ethylene biosynthesis genes controls ethylene production in tomato and tobacco[J].Plant Physiol, 2009, 150(1):365-377.
[21] Wang A, Tan D, Takahashi A, et al.MdERFs, two ethyleneresponse factors involved in apple fruit ripening[J].J Exp Bot,2007, 58(13):3743-3748.
[22] El-Sharkawy I, Sherif S, Mila I, et al.Molecular characterization of seven genes encoding ethylene-responsive transcriptional factors during plum fruit development and ripening[J].J Exp Bot, 2009,60(3):907-922.
[23] Yin XR, Allan AC, Chen KS, et al.Kiwifruit EIL and ERF genes involved in regulating fruit ripening[J].Plant Physiol, 2010, 153(3):1280-1292.
[24] Licausi F, Giorgi FM, Zenoni S, et al.Genomic and transcriptomic analysis of the AP2/ERF superfamily in Vitis vinifera[J].BMC Genomics, 2010, 11:719.
[25] 高峰, 怡荣, 郝金凤, 等.甜瓜乙烯应答因子基因在果实发育成熟过程中的表达特性[J].西北植物学报, 2012, 32(5):886-889.

