甘蔗脱落酸胁迫成熟诱导蛋白基因(SoASR)的克隆和表达分析
黄杏 杨丽涛 张保青 宋修鹏 李杨瑞 王盛
甘蔗(Saccharum officenarum L.)作为我国最主要的糖料作物,起源于热带及亚热带地区,属喜温作物。近年来,频发的寒害冻害对甘蔗的生产造成了巨大的损失[1-3]。脱落酸(abscisic acid,ABA)是植物对逆境胁迫的防卫机制成员之一[4,5]。在逆境条件下,它与ABA结合蛋白的结合能力增强,并感知和传递环境信号,以启动植物体内的应激反应,提高植物抗御各种逆境因子的胁迫能力[6-8]。在低温胁迫过程中,内源ABA含量显著增加,表明ABA参与植物低温胁迫信号转导[9,10]。目前已发现有150多种基因可受ABA的诱导,其中包括在植物器官中受环境胁迫诱导表达的基因[11]。脱落酸胁迫成熟诱导蛋白(ABA-/stress-/ripening-induced protein,ASR)是一类亲水性极强的小分子热稳定蛋白,其表达调控受脱落酸、胁迫及成熟的诱导[12]。前人关于ASR的研究主要集中在果实成熟和衰老方面[13,14],随着对ASR研究的不断深入,发现它与干旱、盐胁迫及低温等非生物胁迫之间也存在着一定的应答关系[15-17],但目前对此基因的研究还仅限于百合[18]、葡萄、香蕉等少数植物,且从分子角度研究甘蔗的ASR与环境胁迫间的关系鲜有报道。本课题组在前期甘蔗抗寒抗旱的蛋白质组学研究中也发现,渗透和低温胁迫下甘蔗体内ASR蛋白的表达量发生了显著的变化[19]。在此基础上,本研究运用同源克隆和RT-PCR技术克隆了甘蔗脱落酸胁迫成熟诱导蛋白(ASR)基因;构建了其原核表达载体,在大肠杆菌中诱导表达;同时利用荧光定量PCR技术分析了ASR基因在低温胁迫和ABA处理下的表达模式,为进一步探索ASR基因在逆境胁迫中的生子生物学功能和甘蔗抗寒分子机理奠定基础。
1 材料与方法
1.1 材料
试验于2011年3 月至2011年12 月在广西大学亚热带农业生物资源保护与利用国家重点实验室完成。以抗寒性强的甘蔗品种桂糖28号(GT28)和抗寒性弱的甘蔗品种园林6号(YL6)作为研究材料。将两个甘蔗品种的单芽种茎进行脱毒处理后放进沙盘中进行沙培。待甘蔗长出2-3叶时,将蔗苗从沙中移出,选取长势一致的甘蔗苗移栽至20cm×25cm(直径×高)的营养盆中,每盆装混合土4kg(土∶有机肥∶沙=6∶3∶1,W/W),每盆种植2株,并把营养盆移至智能温室大棚,按日常管理生长40d,然后转入人工气候室(温度为28℃,光强为250-300μmol/m2·s,12h 光 周 期, 相 对 湿 度 60%-70%)培养10d,甘蔗长到5-6叶期时,分组进行处理。第一组处理为低温+喷施ABA(100μmol/L ABA),记为LA;第二组处理为低温+喷施清水,记为L(注:喷施程度以叶面喷施欲滴为度,于甘蔗苗进行低温处理前12h喷施)。低温处理下,温度为0℃,光强为 250-300μmol/m2·s,12h光周期,相对湿度60%-70%。分别在处理0、1、7和14d剪取甘蔗+1叶,用液氮速冷后存于-80℃冰箱备用。
大肠杆菌DH5α、凝胶回收试剂盒购自Bioer公司;Dream Taq酶、pMD18-T载体试剂盒、IPTG、X-gal、IPTG、dNTPs均购自TaKaRa宝生物工程有限公司;质粒小量抽提试剂盒购自上海生工,引物合成及测序由上海生工完成。pET-30a(+)载体和大肠杆菌BL21(DE3)由本实验室保存。DNA Ligation连接试剂盒、EcoRⅠ、Hind Ⅲ 购自Fermentas公司。
1.2 方法
1.2.1 总RNA提取和cDNA合成 甘蔗叶片总RNA提取按北京康为世纪生物科技有限公司Trizol说明书进行,cDNA合成用TaKaRa宝生物工程有限公司M-MLV逆转录酶,逆转录引物为Oligo(dT)18:5'-GGCCACGCGTCGACTAGTAC(T)18-3',具体步骤按说明书进行,完成后取4μL PCR产物用1.0%琼脂糖凝胶电泳检查并用紫外分光光度计检测cDNA 浓度,最后将各处理cDNA浓度稀释至同一浓度。
1.2.2 SoASR 基因的克隆与生物信息学分析 以NCBI中已报道的玉米、水稻等物种的ASR 基因为参照,运用NCBI BLAST搜索其对应的核酸序列,选取同源性较高的核酸序列进行比对分析并利用DNAMAN软件设计该基因上游简并引物ASR:5'-ATG(T/G)C(T/C/G)(C/G)A(G/A)GAG(C/A)A(G/T)CA(C/T)CACCA-3',下游引物为逆转录加尾引物 3 side:5'-GGCCACGCGTCGACTAGTAC-3'。获得该基因全长后在其编码框首尾设计引物F:5'-ATGGCCCAAGAGAAGCACCACCACC-3'和 R:5'-TCAGCCGAAGAAGTGGTGCTTCTTC-3'进行扩增以验证序列准确性。扩增ASR 基因的PCR体系为25μL,模板为不同处理cDNA 等量的混合样,具体操作按照Dream Taq酶说明书进行。PCR扩增参数为:95℃预变性 5min ;95℃ 40s,58℃ 50s,72℃延伸2min,35个循环;72℃延伸8min。所有PCR产物经1.5 % 的琼脂糖凝胶电泳检测,回收纯化目的条带后连接pMD18-T载体(TaKaRa)后转化DH5α(Trans Gen)感受态细胞,筛选阳性克隆,送上海生工测序。
用BioXM 2.6预测基因氨基酸序列;利用NCBI在线分析软件检索各基因与其他物种的同源性;用MEGA 4.0软件构建每个基因与其他物种氨基酸序列的进化树;在线软件(http://isoelectric.ovh.org/)分析基因氨基酸序列的蛋白质分子量和等电点大小;用WoLF PSORT在线软件分析基因亚细胞定位;用SOSUI signal软件预测基因信号肽;用ExPASy Proteomics Server在线软件预测基因的亲水性和跨膜结构;用SOPMA软件预测基因的二级结构;用Motif Scan在线软件分析基因蛋白质功能结构域。
1.2.3 SoASR基因的原核表达 以pET-30a(+)为表达载体,根据SoASR基因ORF,设计SoASR表达载体构建引物SoASR pET-30aF:5'-CGGAATTCA TGGCCCAAGAGAAGCACCACCACC-3',SoASR pET-30aR:5'-CCAAGCTTTCAGCCGAAGAAGTGGTGCTTC TTC -3'(下划线部分分别为N端EcoRⅠ酶切位点和C端Hind Ⅲ酶切位点),进行PCR扩增后回收纯化后和pET-30a载体分别用EcoRⅠ+Hind Ⅲ进行双酶切,回收酶切产物,用DNA Ligation 连接试剂盒连接目的基因与载体,获得重组质粒,转化大肠杆菌BL21(DE3),Kan抗性筛选,进行测序和双酶切鉴定。
将重组菌株在LB 液体培养基中37℃培养至OD600约0.4-0.6,以空载体 pET-30a(+)(BL21)为对照,加入IPTG至终浓度到1mmol/L和2mmol/L,37℃下分别诱导0、2、4和6h,收集菌液各2mL。将所收集菌液于5000r/min离心5min,弃去上清,在向沉淀中加入200μL 3×上样缓冲液,沸水浴5min,冰上冷却后,取20μL进行SDS-PAGE 电泳分析(SDS-PAGE 的浓缩胶浓度为5%,分离胶浓度为12.5%)。电泳结束后用0.5%考马斯亮蓝R-250进行染色,成像分析。
1.2.4 SoASR基因的实时荧光定量表达分析 根据获得的SoASR 基因全长序列设计荧光定量PCR特异性引物SoASR QF:5'-GAGTACACGGAGACCACGGT-3'、SoASR QR :5'-TCTCGTAGAGTGCGAAGGC-3',以甘蔗25S rRNA基因(BQ536525)为内参,设计内参引物25S rRNA QF:5'-GTCAGAAAAGTTACCACAGGGA-3'、25S rRNA QR:5'-GGTAAAACTAACCTGTCTCACGA-3'。荧光定量PCR反应在ABI Stepone Plus型荧光定量PCR仪上进行,反应体系为20μL,方法参照天根公司荧光定量试剂盒Real Master Mix(SYBR Green Ⅰ)说明书。反应参数:95℃ 5min;95℃ 45s,55℃ 45s,72℃ 20s,40个循环。按照2-ΔΔCT法计算出基因表达水平的相对表达量。
2 结果
2.1 总RNA提取及检测
取4μL甘蔗叶片总RNA经1.0%凝胶琼脂糖凝胶电泳检测。图1结果表明RNA带型完整清晰,18S和28S两条带比较完整且较亮,5S则隐约可见,并无杂质污染,说明所提取的甘蔗RNA质量较好。紫外分光光度计测定,RNA的OD260/OD280值在1.85-1.95之间,OD260/OD230值在2.0-2.2之间,说明提取的总RNA 完整度和纯度都较高,可进行后续试验。

图1 甘蔗叶片总RNA琼脂糖检测
2.2 SoASR 基因全长cDNA克隆
以混合甘蔗叶片cDNA为模板,用简并引物ASR引物和3 side通用引物进行PCR扩增,扩增得到一条750bp左右的片段(图2),经过回收、克隆和测序后在NCBI进行比对,结果为甘蔗ASR基因cDNA全长。其cDNA全长序列为753bp,包含启始密码子ATG和终止密码子TAA,命名为SoASR,GenBank登录号为JX470187。该基因cDNA序列包含一个429bp的ORF,编码142个氨基酸,另外包含324bp的3'非编码区,3'非编码区还包括一个18bp ploy(A)尾巴。
2.3 SoASR基因生物信息学分析
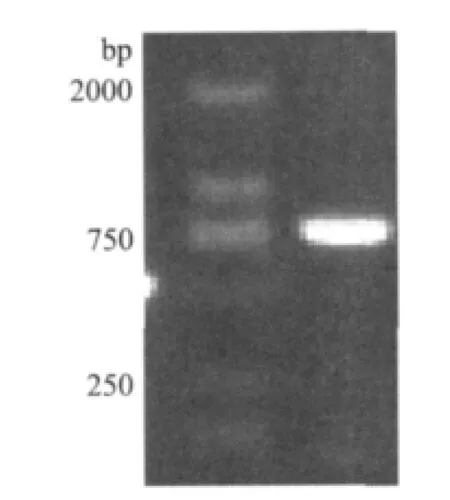
图2 甘蔗SoASR基因PCR扩增结果
生物信息学分析显示,SoASR蛋白分子量大小为25.9kD,等电点为6.1。Glu、Ala的出现频率较高,分别为19.0%和14.1%;Met、Arg频率较低,为0.07%。亚细胞定位显示其主要位于细胞核。该基因氨基酸序列不含信号肽,是一类可溶性蛋白,没有跨膜区域;疏水性最小值为-5.7,最大值为4.5;该基因氨基酸序列未发现糖基化位点,含有1个Ser、2个Thr和3个Tyr磷酸化位点。该基因二级结构预测显示:含有81个α-螺旋,占57.04%;随机卷曲31个,占21.83%;延伸链15个,占10.56%;β-转角15个,占10.56%。该基因氨基酸序列功能结构域分析表明,40-43、46-49两个为酪蛋白激酶Ⅱ磷酸化位点,72-77、2-32两个为N-肉豆蔻酰化位点,6-13为富含组氨酸结构域,53-132为脱落酸/WDS诱导蛋白结构域(图3)。

图3 SoASR基因编码区核苷酸序列及推导出的氨基酸序列
用MEGA 4.0软件构建了甘蔗SoASR基因与其它12个物种氨基酸序列的进化树。结果(图4)表明,13个不同物种ASR基因被聚为4个组,草莓和盐角草为一组,水稻单独为一组,银杏和云杉为一组,其余为一组,而甘蔗SoASR与大蕉、玉米和高粱聚为一小组,同源性为79%、93%和88%,说明甘蔗和玉米、高粱等的亲缘关系较近。
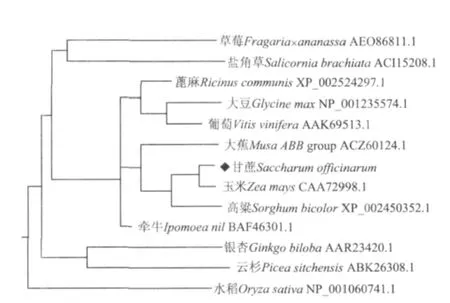
图4 甘蔗SoASR基因与其它物种ASR基因的氨基酸序列同源性分析
2.4 SoASR基因原核表达载体构建及诱导表达
大量提取pMD18T-SoASR和pET-30a(+)质粒并进行纯化,利用EcoRⅠ+Hind Ⅲ分别进行双酶切,回收插入目的片段和表达载体,按DNA Ligation连接试剂盒说明进行连接,获得重组质粒pET30a-SoASR。以重组表达质粒pET30a-SoASR 为模板,PCR扩增出429bp 左右的片段,并将重组质粒阳性克隆测序,结果(图5- A)表明插入片段与克隆序列完全一致,ORF 正确。在此基础上,又用EcoRⅠ+Hind Ⅲ双酶切重组质粒pET30a-SoASR,可切得约5 460bp的pET-30a(+)载体片段和429bp 左右SoASR基因片段(图5- B),表明SoASR 基因已插入载体质粒中,SoASR基因的原核表达载体pMD18TSoASR构建成功。
将鉴定后的pET30a-SoASR和空载体pET-30a(+)转入表达菌BL21(DE3)中,用1mmol/L和2mmol/L的IPTG进行诱导表达,表达产物SDS-PAGE电泳结果如图6。在2 个不同浓度和不同时间的IPTG 诱导下,均能诱导出融合蛋白,而对照则没有融合蛋白表达。在分子量约为32.0kD的位置上存在1 条融合蛋白诱导表达的条带,与SoASR编码蛋白分子量理论值基本相符,表明原核表达载体构建正确。

图5 重组质粒pET30a-SoASR PCR和双酶切验证结果

图6 SoASR在大肠杆菌中表达的SDS-PAGE电泳图谱
2.5 SoASR基因在低温胁迫和ABA处理下的表达分析
由图7可知,低温胁迫下,SoASR基因在未喷ABA处理的两个甘蔗品种中表达趋势不同,在GT28L中其表达趋势为先升后降,在胁迫1d时达到最大,分别为胁迫0、7和14d的7.4倍、4.6倍和11.2倍;在YL6L中其表达呈下降趋势,并在胁迫14d时降到最低,为0d的13.5%。加ABA处理的两个甘蔗品种SoASR基因的表达都呈下降趋势,在胁迫14d时降到最低,分别为未进行低温处理前的13.5%和2.8%,相比之下,YL6LA的降幅要大于GT28。外喷ABA后,SoASR基因的表达明显被诱导,在胁迫0d时,GT28LA为GT28L的9.6倍,YL6LA为YL6L的2.9倍。
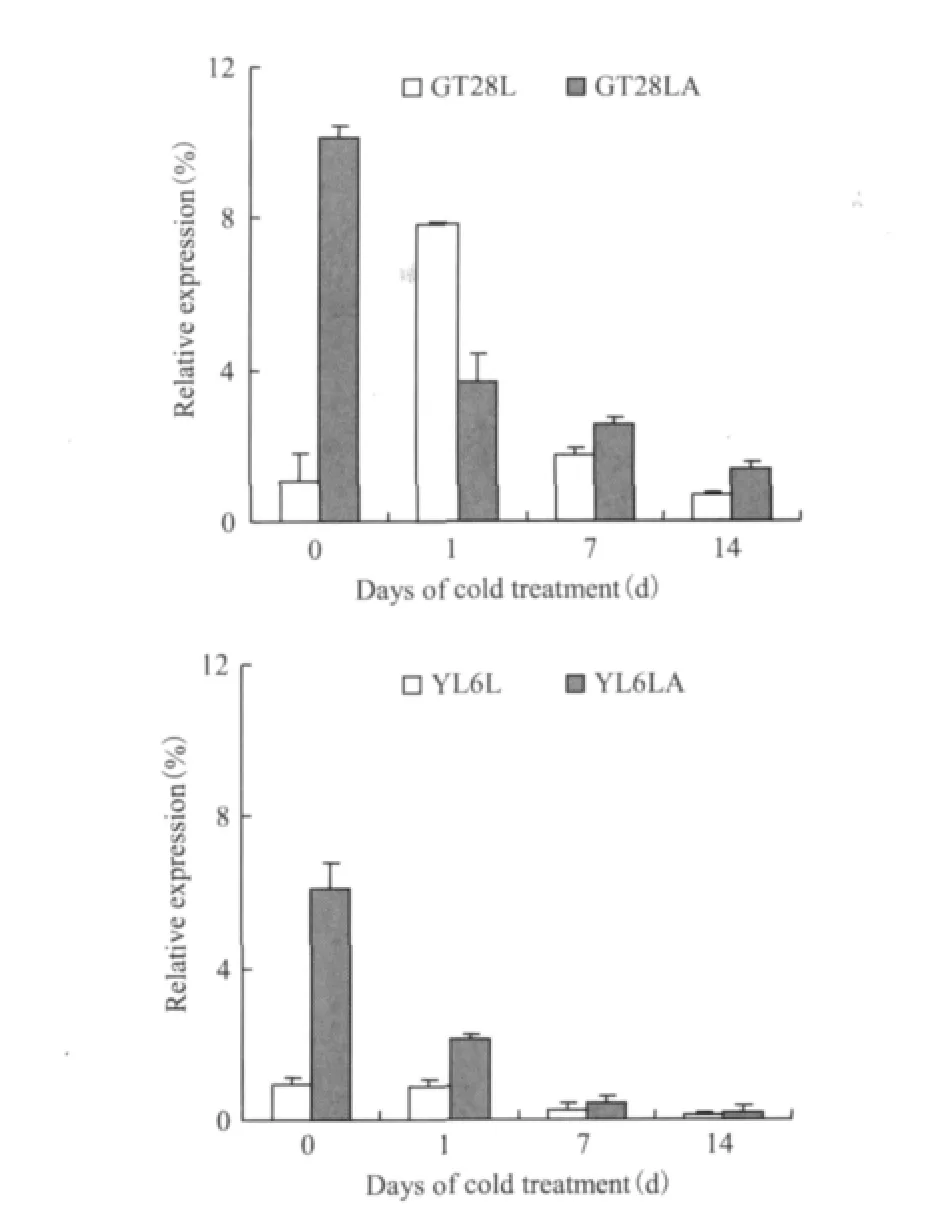
图7 两个甘蔗品种SoASR基因在低温胁迫和ABA处理下的表达
3 讨论
脱落酸(ABA)作为一种重要的植物应答逆境胁迫的调节因子,在植物抵御如低温等不良胁迫反应中起着重要的作用。虽然目前大量研究证实ABA途径及ABA诱导合成的关键基因受各类胁迫的影响,但ABA响应低温胁迫的应答机制还不清楚。克隆甘蔗ASR蛋白,可为进一步研究ABA在甘蔗抗逆胁迫中的作用提供理论基础。本研究发现,甘蔗SoASR基因虽与玉米、水稻的同源性较高但与其它物种的同源性较低,说明ASR基因在进化过程中变异较大。同时,SoASR基因氨基酸序列不含信号肽,也未有跨膜区域和糖基化位点;亚细胞定位确定其位于细胞核。有研究表明植物大约1/3 ASR定位于细胞核,其它大多数分散在细胞质中;而ASR作用主要在细胞核中,并通过核定位信号参与多个核质运输途径[12]。但现有研究证明,ABA参与逆境胁迫时作为信号分子功能通过ABA受体将其运到效应部位,进而诱导植物提高抗逆性[12,20],因此,推测ASR基因是通过其氨基酸序列中的磷酸化位点,即酪蛋白激酶Ⅱ磷酸化位点进行蛋白磷酸化来介导ABA信号转导的,使蛋白激酶总活性增加来减少活性氧的生成,起到抗氧化防护作用[21]。通过对SoASR基因在低温胁迫和ABA处理下表达的研究,发现低温胁迫下SoASR基因在抗寒性强品种GT28中上调表达,并在胁迫1d迅速达到峰值,而在抗寒性弱的品种YL6中却一直表现为下调表达。推测SoASR基因可能在甘蔗抗寒过程中发挥了信号传导作用,进而能将更多的信号传送出去,通过蛋白质磷酸化参与ABA诱导下游基因表达,从而起到保护作用[22,23];而在YL6中表达的下调,也就阻碍了其信号转导和下游基因的表达调控,从而表现出低抗寒力。外喷ABA处理后,SoASR基因在两个甘蔗品种中的表达都明显上调,这样可加强ASR基因通过磷酸化和去磷酸化来介导ABA信号传导途径,提高甘蔗自身抗氧化防护的能力。这在草莓上也有相似的报道[24]。由此可见,SoASR基因与甘蔗的抗寒性密切相关,下一步将通过抗体制备和转基因等方面的研究,进一步探讨SoASR基因在甘蔗低温胁迫中的作用机制。
4 结论
采用同源克隆和RT-PCR技术克隆了甘蔗SoASR 基因全长429bp的完整编码序列,GenBank登录号为JX470187,编码142个氨基酸的蛋白。原核表达结果表明该基因以融合蛋白形式表达,相对分子量约为32.0kD。结果表明,低温胁迫下该基因在抗寒性不同的品种中表达特性不同,但在抗寒性不同的品种中该基因的表达都受ABA的诱导,推测SoASR 基因在甘蔗抗寒机制中发挥某种作用。
[1] 李杨瑞, 方锋学, 吴建明, 等.2010/2011榨季广西甘蔗生产冻害调查及防御对策[J].南方农业学报, 2011, 42(1):37-42.
[2] 李杨瑞, 杨丽涛.20世纪90年代以来我国甘蔗产业和科技的新发展[J].西南农业学报, 2009, 22(5):1469-1476.
[3] 邓展云, 刘海斌, 张革民, 等.2007/2008年榨季广西甘蔗霜冻发生危害规律的调查[J].中国糖料, 2009(1):47-50.
[4] Huang D, Wu W, Abrams SR, et al.The relationship of drought related gene expression in Arabidopsis thaliana tohormonal and environmental factors[J].Journal of Experimental Botany, 2008, 59:2991-2997.
[5] Depuydt S, Hardtke CS.Hormone signalling crosstalk in plant growth regulation[J].Current Biology, 2011, 21:R365-R373.
[6] Shen YY, Wang XF, Wu FQ, et al.The Mg-chelatase H subunit is an abscisic acid receptor[J].Nature, 2006, 443:823-826.
[7] Boneh U, Biton I, Schwartz A, et al.Characterization of the ABA signal transduction pathway in Vitis vinifera[J].Plant Science,2012, 187:89-96.
[8] Raghavendra AS, Gonugunta VK, Christmann A, et al.ABA perception and signalling[J].Trends in Plant Science, 2010, 15:395-401.
[9] 江玲, 侯名语, 刘世家, 等.水稻种了低温萌发生理机制的初步研究[J].中国农业科学, 2005, 38(3):480-485.
[10] 王兴, 于晶, 杨阳, 等.低温条件下不同抗寒性冬小麦内源激素的变化[J].麦类作物学报, 2009, 29(5):827-831.
[11] 王磊, 赵军, 范云六.玉米Cat1基因顺式元件ABRE2结合蛋白ABP9的基因克隆及功能分析[J].科学通报, 2002, 47(15):167-171.
[12] Yang CY, Chen YC, Jauh GY, et al.A lily ASR protein involves abscisic acid signaling and confers drought and salt resistance in arabidopsis[J].Plant Physiology, 2005, 139:836-846.
[13] Fernando C, Alisdair RF, Norberto DL.Heard it through the grapevine? ABA and sugar cross-talk:the ASR story[J].Trend in Plant Science, 2004, 9(2):57-59.
[14] Rossi M, Carrari F, Cabrera PC, et al.Analysis of an abscisic acid(ABA)-responsive gene promoter belonging to the Asr gene family from tomato inhomologous andheterologous systems[J].Mol Gen Genet, 1998, 258:1-8.
[15] Maskin L, Gubesblat GE, Moreno JE, et al.Differential expression of themembers of the Asr gene family in tomato(Lycopersicon esculentum)[J].Plant Sci, 2001, 161:739-746.
[16] Jeanneau M, Gerentes D, Foueillassar X, et al.Improvement of drought tolerance inmaize:towards the functional validation of the ZM-ASR1 gene and increase of water use efficiency by overexpressing C4-PEPC[J].Biochimie, 2002, 84:1127-1135.
[17] Kalifa Y, Gilad A, Konrad Z, et al.The water- and salt-stress regulated Asr1 gene encodes a zinc-dependent DNA- binding protein[J].Biochem J, 2004, 381:373-378.
[18] Huang JC, Lin SM, Wang CS.A pollen-specific and desiccationassociated transcript in Lilium longiflorum during development and stress[J].Plant Cell Physiol, 2000, 41:477-485.
[19] Zhou G, Yang LT, Li YR, et al.Proteomic analysis of osmotic stress-responsive proteins in sugarcane leaves[J].Plant Mol Biol Rep, 2012, 30(2):349-359.
[20] Cakir B, Agasse A, Gaillard C, et al.A grape ASR protein involved in sugar and abscisic acid signaling[J].Plant Cell, 2003, 15(9):2165-2180.
[21] 许树成, 丁海东, 鲁锐, 等.ABA在植物细胞抗氧化防护过程中的作用[J].中国农业大学学报, 2008, 13(2):11-19.
[22] 许树成, 祝雪兰, 张丽.蛋白激酶组在玉米叶片ABA 和H2O2诱导抗氧化防护中的作用[J].植物分类与资源学报, 2011,33(3):275-286.
[23] 吴忠义, 陈伽, 朱美君.脱落酸(ABA)受体的研究进展[J].植物学通报, 1998, 15(4):36-40.
[24] 刘雅萍, 张希, 葛安静, 等.草莓ABA 结合蛋白基因的克隆及序列分析[J].中国农学通报, 2011, 27(10):260-265.

