早期肠内营养支持联合生长抑素对胰腺手术患者术后康复的影响
杨 垚
重庆医科大学附属成都第二临床学院 成都市第三人民医院普外科,四川成都 610072
胰腺分泌功能对于血糖和营养物质的吸收和分解有着重要的作用,当胰腺癌发生后鹿的饮食和生活习惯方面要多加强注意[1]。胰腺癌在手术之后早期的消化系统和内分泌系统的影响较大,其属于恶性程度最高的肿瘤类型之一,5年生存率约为3%[2]。胰腺癌是胰腺常见的恶性肿瘤,其大多是以胰头癌比例较高,手术是治疗胰腺癌的有效防范,但是由于胰腺癌术前可能出现营养不良状态,术中的创伤和术后禁食,可能严重影响患者术后功能的恢复[3]。胰腺癌在近年来发生率明显升高,患者往往出现厌食、腹部饱胀感、疼痛及上消化道梗阻进而引起影响营养物质的摄入和吸收,患者往往在术后出现不程度的营养不良和免疫功能降低等[4]。为提高胰腺癌术后机体免疫能力和生活质量,现对胰腺手术患者临床情况进行汇总分析:
1 资料与方法
1.1 一般资料
选取成都市第三人民医院2008年1月~2013年2月收治的胰腺癌患者60例临床资料进行汇总分析,依据肠道营养措施不同进行临床分组。肠内营养组30例,其中男19 例,女 11 例,年龄 35~75 岁,平均(52.3±11.4)岁;病理学分型:导管细胞癌5例,腺泡细胞癌3例,高分化腺癌12例,中分化腺癌8例,黏液性囊腺癌2例;病程1~11个月;癌灶位置胰腺头部14例,胰腺壶腹周围癌16例。肠外营养组30例,其中男18例,女12例,年龄36~77岁,平均(53.8±11.8)岁;病理学分型:导管细胞癌 6例,腺泡细胞癌4例,高分化腺癌11例,中分化腺癌8例,黏液性囊腺癌1例;病程2~12个月;癌灶位置胰腺头部15例,胰腺壶腹周围癌15例。两组年龄、性别构成比例、病理学分型、病灶位置、病程等一般资料比较,差异均无统计学意义 (P>0.05),具有可比性。
1.2 方法
1.2.1 肠外营养组 给予100 g/L葡萄糖1500 mL,同时交替为患者静脉滴注白蛋白和血浆。
1.2.2 肠内营养组 患者在手术结束后首先给予常规的生长抑素(四川天台山药业,0.25 mg/支)3~5 d,和 250~500 mL生理盐水持续的静脉滴注,12 h/次。手术过程中放置鼻肠管,保持鼻肠管顶端达到十二指肠降段或者胃肠吻合口远侧25~30 cm以下,在手术后6 h开始实施早期的肠内营养支持,连续肠内营养支持3~5 d,最长时间不超过7 d,起初先将葡萄糖盐水1~2 d通过鼻肠管滴入,保持滴入速度在 20~60 mL/h,总量为 500~1000 mL/d,然后滴注肠内营养剂瑞素(华瑞制药公司),低速根据患者临床耐受情况进行调整,总量保持在500~1200 mL/d。
1.3 观察指标
1.3.1 观察两组胰腺癌患者术后1、15 d血红蛋白 (Hb)、血浆蛋白(PP)、血清白蛋白(ALB)情况。
1.3.2 观察两组胰腺癌患者氮平衡、肌酐升高指数、血浆皮质醇、血糖、血浆胰岛素情况。
1.3.3 观察两组胰腺癌术后 1、15 d免疫球蛋白IgA、IgG、IgM变化情况。
1.4 统计学方法
采用统计软件SPSS 17.0对数据进行分析,正态分布计量资料以均数±标准差(±s)表示,两独立样本的计量资料采用t检验;计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组胰腺癌患者术后1、15 d血红蛋白、血浆蛋白、血清白蛋白情况
肠内营养组术后15 d Hb、PP、ALB均明显优于肠外营养组,差异均有统计学意义(t=3.81、3.06、2.82,P <0.05)。 见表1。
表1 两组胰腺癌患者术后1、15 d血红蛋白、血浆蛋白、血清白蛋白情况(g/L,±s)

表1 两组胰腺癌患者术后1、15 d血红蛋白、血浆蛋白、血清白蛋白情况(g/L,±s)
注:与肠外营养组术后 15 d 比较,▲P < 0.05;Hb:血红蛋白;PP:血浆蛋白;ALB:血清白蛋白
肠外营养组术后1 d术后15 d肠内营养组术后1 d术后15 d 30 30 115.4±10.0 130.8±9.8 116.7±9.2 121.4±9.3▲55.1±3.7 60.4±4.1 54.8±4.2 63.8±4.5▲29.4±5.4 32.6±5.6 29.5±6.1 36.9±6.2▲组别 例数HbPPALB
2.2 组胰腺癌患者氮平衡、肌酐升高指数、血浆皮质醇、血糖、血浆胰岛素情况
肠内营养组氮平衡、肌酐升高指数、血浆皮质醇、血糖、血浆胰岛素均明显优于肠外营养组,差异均有统计学意义(P < 0.05)。 见表2。
表2 两组胰腺癌患者氮平衡、肌酐升高指数、血浆皮质醇、血糖、血浆胰岛素情况(±s)
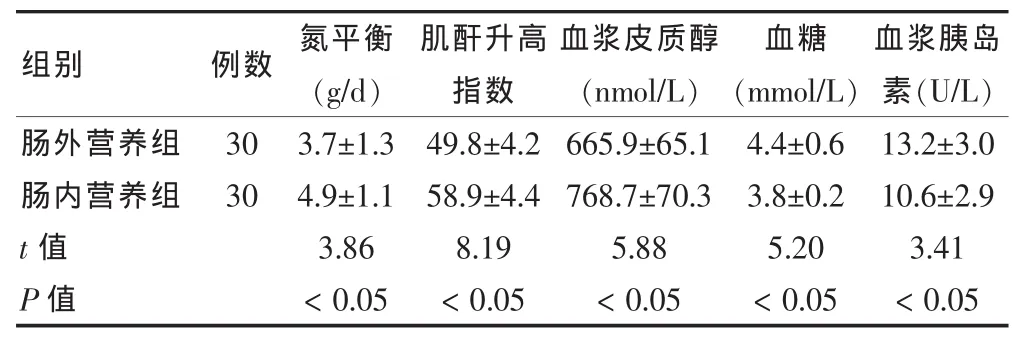
表2 两组胰腺癌患者氮平衡、肌酐升高指数、血浆皮质醇、血糖、血浆胰岛素情况(±s)
肠外营养组肠内营养组t值P值30 30 3.7±1.3 4.9±1.1 3.86<0.05 49.8±4.2 58.9±4.4 8.19<0.05 665.9±65.1 768.7±70.3 5.88<0.05 4.4±0.6 3.8±0.2 5.20<0.05 13.2±3.0 10.6±2.9 3.41<0.05组别 例数 氮平衡(g/d)肌酐升高指数血浆皮质醇(nmol/L)血糖(mmol/L)血浆胰岛素(U/L)
2.3 胰腺癌术后1、15d免疫球蛋白IgA、IgG、IgM的变化情况
肠内营养组术后15 d免疫球蛋白IgA、IgG、IgM明显优于肠外营养组,差异均有统计学意义 (t=2.60、3.70、3.76,P < 0.05)。 见表3。
表3 胰腺癌术后1、15d免疫球蛋白IgA、IgG、IgM的变化情况(g/L,±s)

表3 胰腺癌术后1、15d免疫球蛋白IgA、IgG、IgM的变化情况(g/L,±s)
注:与肠外营养组术后15 d比较,★P<0.05
肠外营养组术后1 d术后15 d肠内营养组术后1 d术后15 d 30 30 2.3±0.4 2.6±0.2 2.2±0.3 2.9±0.6★10.3±1.4 12.2±1.1 10.2±2.0 13.8±2.1★0.9±0.4 1.4±0.3 0.8±0.4 1.8±0.5★组别 例数IgAIgGIgM
3 讨论
胰腺是人体重要的消化器官,其解剖位置深在,结构特殊,具有复杂的内分泌和外分泌功能。胰腺分泌的胰液主要成分是胰蛋白酶、糜蛋白酶、胰淀粉酶、胰脂肪酶等各种酶蛋白[5]。胰腺的外分泌功能的调节包括体液调节和神经调节,其过程较为复杂,胃肠激素之间会相互影响,神经和激素之间有很好的协同作用,迷走神经或者胆碱能神经等共同组成调节胰腺外分泌功能的基础[6-7]。神经调节中以迷走神经对于胰腺外分泌调节具有重要的临床意义,在体液调节方面,主要参与胰腺外分泌调节激素和活性肽类物质较多。胰腺的外分泌功能主要受到头期、胃期、肠期的刺激调节[8-9]。头期主要是中枢神经系统的控制,反射穿出的迷走神经,其直接作用在胰腺,另外也可以通过胃酸分泌对胰腺进行刺激,释放促胰液素和胆囊收缩素释放,进而在胰腺起作用[10-11]。胃期通过迷走神经-迷走神经反射-胃胰反射途径,作用于胰腺,促进胰腺分泌,胃酸在进入十二指肠后,对小肠黏膜进行刺激,促进促胰液素和胆囊收缩素的分泌,进而促进胰腺液体分泌增加[12-13]。其中肠期胰液分泌是胰腺分泌活动中最为重要的环节,食物在进入小肠之后,蛋白质、脂肪和胃酸通过复杂的网络系统,主要包括激素、神经递质产生局部胰肠反射,从而刺激胰腺分泌[14-15]。肠道黏膜主要是以腔内的营养作为主要的营养底物,肠道黏膜屏障和免疫屏障可能受到损伤,可能导致肠道内的菌群发生失调,肠道功能紊乱,不利于术后功能状态恢复[16-17]。胰腺癌患者本身就伴有不同程度的营养不良,患者在术后往往处于高代谢状态,同时肝脏合成利用氨基酸的能力明显降低,患者机体对于蛋白质的分解速度加快,往往可能出现负担平衡,严重影响患者的机体状态。目前针对胰腺外分泌调节机制较多,尤其是针对胰腺术后肠道营养支持方式的探讨也随之增多。肠外营养对于一些胰腺癌较为严重患者是一种机体常用的重要的营养支持方式,但是肠外营养很容易发生感染等并发症,价格昂贵,患者的接受能力较差。肠内营养是通过鼻肠管将营养液滴注到肠内,可以有效地促进消化液的分泌,提高肠道的消化和吸收功能,有效地促进肠道蠕动和肠道功能的恢复,并且肠内营养可以降低肛门排气和排便时间,有效地巩固手术治疗效果。肠内营养支持作为临床常用的方式,其更加符合人体消化的生理过程。肠内营养在控制术后感染、保护胃肠道黏膜屏障、临床支持效果、安全性、可行性等方面均有较大的优势。胃肠外营养向肠内营养过渡,更加有利于维持肠道内微生态环境保持稳定性,保护肠道黏膜屏障,对患者的低蛋白血症进行纠正,显著地改善患者的营养状况,防止术后感染的发生,降低胰腺癌死亡率。有研究认为,胰腺的早期肠内营养合适时机多是在胰腺术后72 h或者在患者排气后[18],但是也应注意早期应用肠内营养也可能产生一些列的并发症,如胃瘫、肠梗阻、肠瘘、胰瘘、血管出血等。有研究表明,肠内营养的操作简便、安全,符合患者生理状态需要和临床治疗的要求,患者容易接受,并且克服了以往肠外营养价格昂贵的缺点,利于患者术后早期肠蠕动的恢复,改善肠道黏膜功能的同时降低了术后恶心呕吐、腹泻、高血糖的发生[19]。但是同时也要注意对患者机体血糖状态和生命体征的观察,根据患者状态酌情应用胰岛素。本组中肠内营养剂为低脂无需消化可吸收的瑞素,一种以整蛋白为基础的肠内营养制剂,其中每100 mL含蛋白质3.8 g,脂肪3.4 g,饱和脂肪酸1.6 g,不饱和脂肪酸1.3g,中链三酰甘油 1.2 g,碳水化合物 13.8 g,糖 0.5 g,其通过鼻空肠营养管输入。瑞素中谷氨酰胺、精氨酸及短链脂肪酸不仅是免疫功能调节剂,同时也是肠黏膜营养底物,能够对肠道内毒性物质进行清除,促进肠道黏膜生长。有资料显示,瑞素不仅可以为肠道修复提供充足的底物,提高肠道内血液循环,利于肠道正常功能的恢复,同时期含有机体正常代谢需要的各种氨基酸和有益菌,利于肠道黏膜细胞的正常供给的恢复,在短时间内改善肠道黏膜的形态和功能,促进肠道神经肌肉活性的恢复,更加有效地改善肠道黏膜屏障功能,并且可以提高胰腺癌术后患者的机体耐受能力,降低胰腺癌对机体的负面影响[20-22]。同时通过肠内营养,瑞素可以有效地促进其在门静脉吸收,从而利于肝脏功能的恢复,对胃酸进行中和,调整肠道内pH值,增加门静脉系统血液循环,提高患者机体免疫能力。生长抑素属于在人体胃肠道的激素,其可以对机体不同脏器生理功能进行抑制,尤其是对于胃肠道腺体分泌功能进行抑制,这种药理特性可以有效地救治肠梗阻、肠外瘘、食道静脉曲张破裂出血等。本组中通过肠内营养联合生长抑素,可以有效地减少胃肠道和胰腺生理性分泌,促进胃肠道减压,改善机体组织血液循环状态和血管的通透性,降低因胰腺癌术后的应激状态的负面影响,利于机体内状态的维护,利于患者围术期平安度过。术后密切观察生命体征,主要是每15~30分钟对血压、脉搏、呼吸频率、血氧饱和度等进行观察。一些患者往往由于胰腺癌手术患者往往因病情发展可能无法自理,可能出现一些紧张、沮丧、自卑等负面情绪,护理人员要加强患者的心理疏导工作,尽可能帮助患者宣泄负面情绪,提高患者面对胰腺癌术后恢复的信心,从而配合治疗。保持胰腺癌患者病房内清洁、安静的环境,加强患者手术切口皮肤护理,加强患者的饮食指导,尽可能应用高能量、高蛋白的食物,注意根据患者的病情特点调整体位变化,做好功能恢复护理工作。胰腺癌患者出院后要养成良好的生活习惯,尤其是要规律起居,切不可长期熬夜,注意多休息,尽量不要进行负重性活动。本研究结果表明,肠内营养组术后15 d Hb、PP、ALB均明显优于肠外营养组,氮平衡、肌酐升高指数、血浆皮质醇、血糖、血浆胰岛素均明显优于肠外营养组,提示肠内营养支持可以促进肠道生理功能的恢复,对肠道黏膜屏障功能形成一定程度的保护,防止术后并发症的发生,加快机体康复,保证围手术期体液和电解质平衡状态,改善氮平衡、肌酐升高指数、血浆皮质醇、血糖、血浆胰岛素水平,维持机体内循环稳定状态,在一定程度上和生长抑素的治疗具有很好的协同和强化作用,提高了胰腺癌手术患者术后的恢复效率。另外本研究还发现,肠内营养组术后15 d免疫球蛋白IgA、IgG、IgM明显优于肠外营养组,提示手术后胃肠功能运动恢复和胃肠移行性复合运动波,一般是在手术后6 h可以恢复。手术后胃肠道麻痹只是局限在胃和结肠,术后数小时内小肠功能已经逐步开始恢复,此时进行肠道营养支持,可以更好地促进机体免疫功能的恢复。
综上所述,临床观察胰腺癌术后应用肠内全营养素联合生长抑素,可以明显改善胰腺癌术后患者的营养状况,利于术后患者机体状态的恢复和免疫功能的改善,降低感染等并发症的发生,提高临床治疗效率,同时肠内营养患者营养素平衡全面,安全价廉,合理方便,对术后患者尽早康复提供了有效的保证。
[1]吴兴茂,吉凯强,汪海源,等.全肠内营养对急性重症胰腺炎的胰腺坏死性感染的预防作用的研究[J].中国现代医学杂志,2013,23(4):101-104.
[2]曾轶晖,盖娟娟.中药联合肠内营养支持治疗重症急性胰腺炎的疗效观察[J].中国医药导刊,2010,12(5):824-824,827.
[3]汤跃连.完全胃肠外营养及早期肠内营养对重症急性胰腺炎的疗效比较[J].中国医药导刊,2011,13(5):773-774.
[4]蔺军,刘丕.早期肠内营养对重症急性胰腺炎炎症因子和肠通透性的影响[J].江西医药,2011,46(4):308-309.
[5]张金良,陈强谱,重症急性胰腺炎患者应用肠内营养和肠外营养所致并发症的比较系统回顾和Meta分析[J].中华普通外科学文献,2011,5(3):59-61.
[6]朱利微,徐淑云,赵庆伟,等.重症急性胰腺炎营养支持治疗的研究[J].当代医学,2011,17(7):101.
[7]姜雯,郝伟,张风芝.不同方式营养支持对重症急性胰腺炎患者血浆 DAO 及 D-乳酸水平的影响[J].山东医药,2010,50(43):105-106.
[8]张勇胜,舒晓亮,钟静霞,肠外与肠内联合营养治疗重症急性胰腺炎[J].第二军医大学学报,2011,32(7):737-740.
[9]张丽梅.不同肠内营养途径治疗急性胰腺炎的临床疗效比较[J].中国健康月刊,2011,30(5):123-124.
[10]吕萍,文娇,刘慧希,等.个体化营养支持治疗重症急性胰腺炎20例效果观察[J].齐鲁护理杂志,2011,17(9):6-8.
[11]冯秀生,尹福忠,索晓铭,等.早期肠内外营养支持治疗重症急性胰腺炎 51 例疗效的对比研究[J].实用医技杂志,2011,18(2):191-192.
[12]李颖,方喜,吴俊伟.肠内营养对急性胰腺炎患者肠黏膜通透性及细菌移位的影响[J].中国现代普通外科进展,2010,13(12):945-949.
[13]金如燕,王笑微,章赛珍,等.双泵在胰腺癌合并糖尿病患者术后早期肠内营养中的应用[J].解放军护理杂志,2009,26(7):11-13.
[14]王广胜.胰腺癌术后肠内营养护理的应用[J].中国医药导报,2013,10(9):133-135.
[15]赵亮,于永福,李慧.肠内营养支持治疗在肺癌化疗病人中的临床应用[J].肠外与肠内营养,2011,18(5):281-283.
[16]李爱霞,张叶锋,张转玲.胰腺癌术后早期肠内营养治疗的护理体会[J].当代医学,2011,17(1):120-121.
[17]苏惠芳,庞旭峰,李舰.胰腺癌术后肠内营养护理[J].实用医药杂志,2010,27(8):719-720.
[18]莫瑞祥,杨威,张慧明,等.早期肠内营养在47例重症急性胰腺炎中的应用[J].广西医学,2012,34(10):1362-1364.
[19]许文华.对重症急性胰腺炎患者髓内营养护理研究[J].中国医药导报,2011,8(11):101-102.
[20]张晓芳,邵冰峰,田思源.胰腺癌术后早期肠内营养的效果观察及护理[J].护理实践与研究,2012,9(22):62-63.
[21]周家德.益生菌联合早期肠内营养治疗重症急性胰腺炎疗效观察[J].现代医院,2012,12(5):70-71.
[22]曾悦,陆伦根,胰腺疾病和肠内营养支持治疗[J].中华临床医师杂志:电子版,2011,5(12):3405-3408.

