3,5,6,8-四氢-噻喃并[4′,3′:4,5]噻吩并[2,3-d]嘧啶-4-酮衍生物的合成及其性质研究
解 海,陈希尧,王尚芝,韩生华,刘 文,郝校飞
(1.山西大同大学化学与环境工程学院,山西大同037009;2.上海市计量测试技术研究院,上海201203)
3,5,6,8-四氢-噻喃并[4′,3′:4,5]噻吩并[2,3-d]嘧啶-4-酮衍生物的合成及其性质研究
解 海1,陈希尧2,王尚芝1,韩生华1,刘 文1,郝校飞1
(1.山西大同大学化学与环境工程学院,山西大同037009;2.上海市计量测试技术研究院,上海201203)
邻氨基噻酚甲酸乙酯1,与三苯基膦、六氯乙烷在三乙胺催化作用下发生反应,以95%的产率得到膦亚胺2,膦亚胺2与芳基异氰酸酯发生氮杂-Wittig反应,生成碳二亚胺3,再与仲胺作用得到中间体4,而后在醇钠的催化下关环制得3,5,6,8-四氢-噻喃并[4′,3′:4,5]噻吩并[2,3-d]嘧啶-4-酮衍生物5,产率为67%~87%。
噻吩并[2,3-d]嘧啶-4-酮;氮杂Wittig反应;碳二亚胺
含有噻吩嘧啶酮结构框架的稠杂环化合物具有广谱的生物活性,大量文献报道该类化合物表现为良好的抗病毒[1]、抗菌[2]、抗惊厥[3]、抗组胺[4]、抗疟疾[5]等生物活性。尽管有大量文献报道新型噻吩嘧啶酮衍生物,但噻喃并噻吩嘧啶酮类化合物却很少报道。最近,aza-Wittig反应被广泛地应用于新型含氮杂环化合物的合成,该反应原料简单易得、反应条件温和、反应选择性好,已成为一种高效合成氮杂环化合物的新方法[6],本文主要采用aza-Wittig反应来合成具有潜在生物活性的3,5,6,8-四氢-噻喃并[4′,3′:4,5]噻吩并[2,3-d]嘧啶-4-酮衍生物。
根据文献报道的合成方法[7],应用噻吡喃酮、氰乙酸乙酯、硫粉在吗啡啉催化作用下可制得氨基酯1,1再与三苯基膦、六氯乙烷在弱碱三乙胺催化作用下,室温即可顺利得到膦亚胺中间体2。膦亚胺2与异氰酸酯反应,得到的碳二亚胺3与仲胺反应,生成类胍中间体4,4经醇钠催化关环,即得到噻吩并嘧啶酮5。该方法原料简单易得、反应条件温和,实验操作简单,收率也较高,合成路线见图1,化合物见表1。
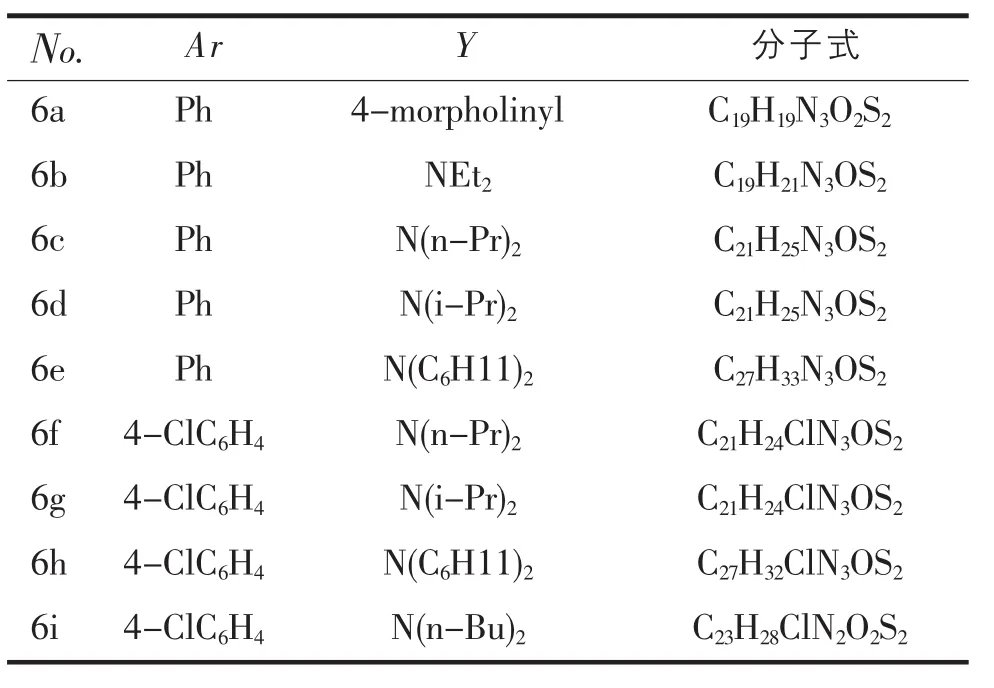
表1 化合物5的制备
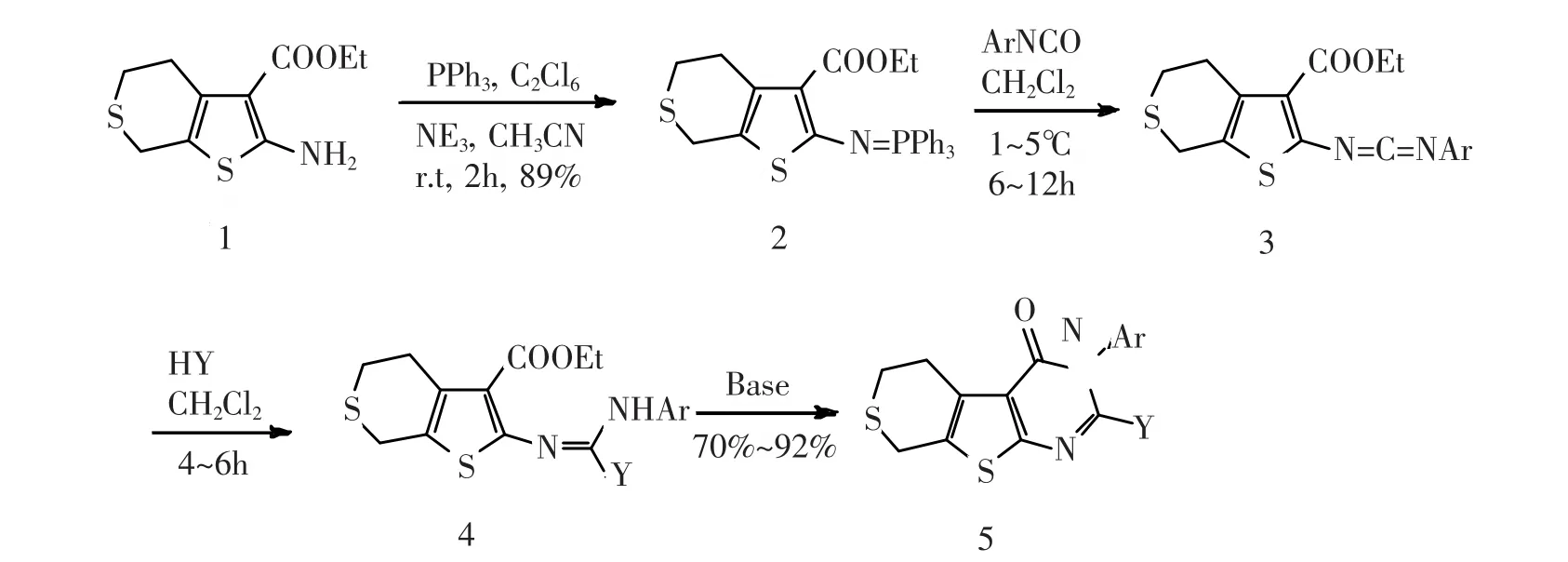
图1 化合物5的制备
1 实验
1.1 仪器及试剂
熔点用北京第三光学仪器厂生产的X-4型熔点仪测定,温度计未经校正;红外使用Perkin-Elemer PE2983红外光谱仪测定;1H NMR用Varian Mercury 600型600 MHz核磁共振仪测定,TMS为内标;MS使用Finnigan Trace质谱仪测定。元素分析使用Vario EL III元素分析仪测定。
所用试剂为化学纯或分析纯。
1.2 膦亚胺2的制备
在100mL的圆底烧瓶中,将氨基酯 (1,2.43 g,10 mmol),三苯基磷 (7.86 g,30 mmol)和六氯乙烷(7.11 g,30mmol)依次加入到50mL乙腈溶液中,在冰水浴条件下逐滴滴加三已胺 (3.03 g,60 mmol),室温反应30 min,将反应液倒入水中,水溶液中立即析出大量黄色固体,过滤,用乙醇洗涤干燥,得中间体膦亚胺2的黄色固体4.77 g(收率95%,154~ 156℃)
1.3 3,5,6,8-四氢-噻喃并 [4′,3′:4,5]噻吩并
[2,3-d]嘧啶-4-酮5的制备
在0~5℃及干燥氮气保护下,将芳基异氰酸酯(1.6mmol)逐滴滴加到膦亚胺2(0.75 g,1.5mmol)的二氯甲烷溶液(10 mL)中,在0~5℃ 搅拌反应6~8 h,减压脱去大部分溶剂,加入V乙醚∶V石油醚= 1∶2(25 mL)的混合溶剂,重结晶以除去三苯氧膦,过滤,滤液在减压下脱去大部分溶剂即得碳二亚胺3。将所得碳二亚胺3溶于二氯甲烷(15mL)中,滴加仲胺 (6mmol),在室温下搅拌反应0.5 h,所得到的类胍中间体4无需进一步纯化,可直接进行下一步操作。脱去所得类胍中间体4的溶剂,加入重新蒸馏过的绝对无水乙醇(10mL)和几滴乙醇钠的无水乙醇溶液 (1mol/L),在室温下搅拌反应5~6 h,减压脱去大部分溶剂,残余物以甲醇或二氯甲烷/石油醚重结晶,即得3,5,6,8-四氢-噻喃并[4′,3′:4,5]噻吩并[2,3-d]嘧啶-4-酮衍生物5。
6a:3-phenyl-2-(4-morpholinyl)-3,5,6,8-tetrahydro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d] pyrimidin-4-one,产率85%,白色晶体,熔点243~ 245℃,IR(KBr):1 683(C=O),1 551,1 493,1 420 cm-1。1HNMR(CDCl3,600 MHz)δ (ppm):7.26~7.51(m,5H,Ar-H),3.79(s,2H,CH2),3.25(t,J=4.8 Hz,2H,CH2),2.92(t,J=4.8 Hz,2H,CH2),3.41 (t,4H,2OCH2),3.1(t,J=3 Hz,4H,2NCH2).MS:m/z(%)= 385(100)[M+],352(24),294(8),196(19),77(24)。
6b:2-diethylamino-3-phenyl-3,5,6,8-tetrahydro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d] pyrimidin-4-one,产率79%,黄色晶体,熔点 190~ 191℃,IR(KBr):1 686(C=O),1 551,1 493,1 420 cm-1。1HNMR(CDCl3,600 MHz)δ(ppm):7.27~7.49 (m,5H,Ar-H),3.78(s,2H,CH2),3.25(t,J=4.8 Hz,2H,CH2),2.91(t,J=5.1 Hz,2H,CH2),3.07(t,J=6.6 Hz,4H,2CH2),0.81(t,J=6.3 Hz,6H,2CH3)。MS:m/z (%)=371(100)[M+],356(6),299(6),196(18),77(12)。
6c:2-(dipropylamino)-3-phenyl-3,5,6,8-tetrahydro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d] pyrimidin-4-one,产率85%,红色晶体,熔点 133~ 134℃,IR(KBr):1 675(C=O),1 551,1 493,1 421 cm-1。1H NMR(CDCl3,600 MHz)δ (ppm):7.26~7.48(m,5H,Ar-H),3.78(s,2H,CH2),3.24(t,J=4.8 Hz,2H,CH2),2.91(t,J=7.8 Hz,2H,CH2),2.95(t,J=3.6 Hz,4H,2CH2),1.22~1.26(m,4H,2CH2),0.72(t,J=7.2 Hz,6H,2CH3)。MS:m/z(%)=399(100)[M+],370 (15),357(28),91(5),77(9)。
6d:2-diipropylamino-3-phenyl-3,5,6,8-tetrahydro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d] pyrimidin-4-one,产率87%,黄色晶体,熔点 193~ 194℃,IR(KBr):1679(C=O),1552,1 493,1420 cm-1。1H NMR(CDCl3,600MHz)δ(ppm):7.23~7.47(m,5H,Ar-H),3.78(s,2H,CH2),3.24(t,J=4.8Hz,2H,CH2),2.90 (t,J=10.8 Hz,2H,CH2),3.49(t,J=6.6 Hz,2H,2CH),1.05(d,J=3.3Hz,12H,4CH3)。MS:m/z(%)=399(75) [M+],356(100),342(15),100(20),77(9)。
6e:2-dicyclohexanylamino-3-phenyl-3,5,6,8-tetrahydro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d] pyrimidin-4-one,产率86%,黄色晶体,熔点 221~ 223℃,IR(KBr):1 680(C=O),1 551,1 493,1 421 cm-1。1HNMR(CDCl3,600 MHz)δ (ppm):7.36~7.45(m,5H,Ar-H),3.78(s,2H,CH2),3.24(t,J=4.8 Hz,2H,CH2),2.90(t,J=6 Hz,2H,CH2),1.04~1.08(m,6H,3CH2),3.01(t,J=2.4 Hz,2H,2NCH),1.32~1.34 (m,4H,2CH2),1.54~1.56 (m,J=4.8 Hz,4H,2CH2),1.71~1.73(m,8H,3CH2)。MS:m/z(%)=479 (55)[M+],396(100),299(8),180(15),77(5)。
6f:2-di-n-propylamino-3-(4-chlorophenyl)-3,5,6,8-tetrahy-dro-4H-thiopyrano[4′,3′:4,5]thieno [2,3-d]pyrimidin-4-one,产率85%,红褐色晶体,熔点174~176℃,IR (KBr):1 678(C=O),1 596,1 551,1 420 cm-1。1HNMR(CDCl3,600 MHz)δ(ppm):7.21~7.46(m,4H,Ar-H),3.78(s,2H,CH2),3.23(t,J =3.6 Hz,2H,CH2),2.91(t,J=5.4 Hz,2H,CH2),2.95(t,J=6.6 Hz,4H,2CH2),1.22~1.26 (m,4H,2CH2),0.75(t,J=7.2 Hz,6H,2CH3)。MS:m/z(%)= 433(100)[M+],390(22),333(13),280(24),100(9)。
6g:2-diipropylamino-3-(4-chlorophenyl)-3,5,6,8-tetrahy-dro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d]pyrimidin-4-one,产率76%,红褐色晶体,熔点240~242℃,IR(KBr):1 678(C=O),1 596,1 493,1 420 cm-1。1HNMR(CDCl3,600 MHz)δ(ppm):7.18~ 7.45(m,4H,Ar-H),3.78(s,2H,CH2),3.23(t,J=4.8 Hz,2H,CH2),2.91(t,J=10.8 Hz,2H,CH2),3.47(t,J=6.6 Hz,2H,2CH),1.07~1.08 (m,12H,4CH3)。MS:m/z(%)=433(63)[M+],390(100),333(18),122(4),100(21)。
6h:2-dicyclohexanylamino-3-(4-chlorophenyl)-3,5,6,8-tetrahydro-4H-thiopyrano[4′,3′:4,5] thieno[2,3-d]pyrimidin-4-one,产率81%,黄色晶体,熔点 221~223℃,IR(KBr):1 684(C=O),1 551,1 491,1 420 cm-1。1HNMR(CDCl3,600 MHz)δ (ppm):7.22~7.47(m,4H,Ar-H),3.80(s,2H,CH2),3.24(t,J=2.1 Hz,2H,CH2),2.92(t,J=5.4 Hz,2H,CH2),1.08~1.09(m,J=3.6 Hz,6H,3CH2),3.01(t,J=2.4 Hz,2H,2NCH),1.39~1.41(m,4H,2CH2),1.56~1.59 (m,4H,2CH2),1.73~1.76 (m,8H,3CH2)。MS:m/z(%)=513(29)[M+],430(91),180 (21),98(14),83(43)。
6i:2-di-n-butylamino-3-(4-chlorophenyl)-3,5,6,8-tetrahy-dro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d]pyrimidin-4-one,产率67%,红褐色晶体,熔点190~191℃,IR(KBr):1 684(C=O),1 551,1 492,1 420 cm-1。1HNMR(CDCl3,600MHz)δ(ppm):7.20~ 7.50(m,4H,Ar-H),3.78(s,2H,CH2),3.08(t,J=6.9 Hz,2H,CH2),2.97(t,J=7.5 Hz,2H,CH2),2.91(t,J =5.4 Hz,2H,CH2)3.24(t,J=13.5 Hz,2H,CH2),1.11~1.26(m,4H,2CH2).0.82~0.89(m,4H,2CH2),0.74(t,J=6.9 Hz,6H,CH3)。MS:m/z(%)=461 (100)[M+],404(26),333(15),128(9),57(13)。
2 结果与讨论
2.1 反应条件
制备本文的膦亚胺2,滴加三乙胺时要控制滴加速度,以免反应体系大量放热,反应体系升温变黑,在反应起始最好使用冰水浴。而且膦亚胺对水和空气不是很稳定,在去除三乙胺盐酸盐的后处理过程中,尽可能避免水洗时间过长,用无水乙醇洗涤膦亚胺2应尽量少用乙醇,避免收率过低。膦亚胺2应保存在真空干燥器中。由于碳二亚胺极易发生聚合或水解,因此制备碳二亚胺3时反应不宜在过高的温度下进行,以0~5℃ 为佳。同时,此反应需要通氮气保护,否则会发现溶液颜色变得更深,副反应变多,产率大幅降低。
2.2 3,5,6,8-四氢-噻喃并[4′,3′:4,5]噻吩并
[2,3-d]嘧啶-4-酮5的波谱特征
在产物5的IR光谱谱图中分析看,嘧啶酮环的C=O的强伸缩振动峰出现在1 675~1 684 cm-1左右。在1HNMR谱图中,苯环-H的单吸收峰出现在7.2~7.5,与其他的吸收峰能较好的区分;与噻吩环相连的硫杂环己烷的SCH2氢的δ在3.8左右,为一很清楚的单峰;硫杂环己烷剩余的2个CH2的δ在2.91和3.25左右,一般受邻位CH2的偶合裂分,表现出三重峰。从其MS数据可以看出所有的化合物都有较强的分子离子峰,其主要断裂大多出现在嘧啶酮环及其支链上。这些特征都证实了化合物5的分子结构是正确的。
[1]Thakur C S,Jha B K,Dong B,et al.Small-molecule activators of RNase Lwith broad-spectrum antiviral activity[J].Natk Acad Sci,2007,104(23):9585-9590.
[2]Hafez H N,El-Gazzar A B.A Desugn and synthesis of 3-pyrazolyl-thiophene,thieno[2,3-d]pyrimidines as new bioactive and pharmacological activities[J].Bioorg Med Chem Lett,2008,18(19):5222-5227.
[3]Al-Omran F,El-Khair A A.Novel synthesis of thieno[2,3-b]pyridine and substituted 2-thienylthiourea derivatives as antibiotic agents[J].JHeterocycl Chem,2004,41:909.
[4]Shishoo C.J,Shirsath V S,Rathod IS,et al.Design,synthesis and antihistaminic(H1)activity of some condensed 3-aminopyrimidin-4(3H)-ones[J].Eur JMed Chem,2000,35(3):351-358.
[5]Kikuchi H,Yamamoto K,Horoiwa S.Exploration of a New Type of Antimalarial Compounds Based on Febrifugine[J].Med Chem,2006,49:4698-4706.
[6]Palacios F,Alonso C,Aparicio D,et al.The aza-Wittig reaction:an efficient tool for the construction of carbon-nitrogen double bonds[J].Tetrahedron,2007,63:523-575.
[7]Ahmed E K.Synthesis of new fused heterocycles by annelation of thiopyrano[4′,3′,4,5]thieno[2,3-d]pyrimidines.Monatsh[J]. Chem,1995,126:953-959.
〔责任编辑 杨德兵〕
Synthesis and Properties of 3,5,6,8-Tetrahydro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d]pyrim idin-4-ones
XIE Hai1,CHEN Xi-yao2,WANG Shang-zhi1,HAN Sheng-hua1,LIUWen1,HAO Xiao-fei1
(1.School of Chemical&Environmental Engineering,ShanxiDatong University,Datong Shanxi,037009;(2.Shanghai Institute ofMeasurementand Testing Technology,Shanghai,201203)
Ethyl 2-amino-4,7-dihydro-5H-thieno[2,3-c]thiopyran-3-carboxylate 1,reacted with triphenyl-phosphine,hexachloroethane and triethylamine,iminophosphorane 2 is obtained in 95%yield.Further aza-Wittig reactions of iminophosphorane 2 with aromatic isocyanates gave the carbodiimides 3,which were reacted with secondary amines to give 2-dialkylamino-3,5,6,8-tetrahydro-4H-thiopyrano[4′,3′:4,5]thieno[2,3-d]pyrimidin-4-ones 5 in the presence of catalytic amounts of EtONa in 67%~87%yields.
thieno[2,3-d]pyrmidin-4-one;aza-Wittig reaction;carbodiimide
TG161
A
1674-0874(2013)06-0028-03
2013-10-20
山西大同大学博士科研启动项目[2012-B-06]
解海(1978-),男,山西山阴人,博士,讲师,研究方向:有机合成化学。

