掺杂金属离子的氢氧化镍的电化学性能
高晓蕊,蒋康乐
(河北工程大学理学院,河北 邯郸 056038)
在金属氢化物镍(MH/Ni)电池中,正极材料Ni(OH)2的理论比容量为289 mAh/g,而负极储氢合金的比容量可达330 mAh/g 以上[1]。Ni(OH)2一般有α 和β 两种晶型,其中β-Ni(OH)2在电极上被氧化时,形成β-NiOOH,在过充电时,会进一步形成γ-NiOOH[2],导致电池失效。α-Ni(OH)2能可逆地循环转变为γ-NiOOH,而且α-Ni(OH)2的密度略小于γ-NiOOH,因此在充放电过程中不会发生电极膨胀;同时,γ-NiOOH中Ni 的平均价态大于3.5,在α-Ni(OH)2和γ-NiOOH的循环转变过程中,交换的电子数量较多。相对于β-Ni(OH)2电极,α-Ni(OH)2电极预计有更高的理论容量,是目前研究的热点。采用化学沉淀或电化学浸渍制备的α-Ni(OH)2在强碱中极易转化成β-Ni(OH)2,导致容量衰减。为此,人们常用其他金属离子(如Co2+[3]、Al3+[4]、Zn2+[5]、Fe3+[6]和稀土离子[7]等)部分取代Ni(OH)2中的Ni2+,形成能稳定存在的层状氢氧化物(LDHs)。LDHs 的结构通式为:[NixMy(OH)2(x+y)]An-y/n·mH2O(M 为取代金属离子,A 为层间带n 个负电荷的阴离子,m 为结晶水量)。LDHS 的阴离子交换能力较强,即层间阴离子可被其他阴离子取代。
本文作者通过共沉淀和后续水热处理方法,向Ni(OH)2中分别掺杂Al3+、Zn2+以及同时掺杂Al3+和Zn2+,考察掺杂金属离子对Ni(OH)2电极材料结构及电化学性能的影响。
1 实验
1.1 材料的合成
用共沉淀结合水热处理法合成:在氮气保护下,将32 ml 1.0 mol/L NaOH(上海产,AR)缓慢滴加到32 ml 0.5 mol/L Ni(NO3)2(上海产,AR)或32 ml 0.5 mol/L Ni(NO3)2+8 ml 0.5 mol/L Zn(NO3)2(上海产,AR)混合溶液中,在100℃下搅拌18 h 后,将悬浊液转移到数个聚四氟乙烯衬里的单只容积为25 ml 的高压釜中,在180℃下静置24 h。将悬浊液抽滤,再用去离子水、丙酮(上海产,AR)先后洗涤3~5 次,并在65℃下干燥,制得样品。
1.1.2 [Ni4AlZnx(OH)10+2x]OH 样品的合成
依次用共沉淀结合水热处理法及离子交换法合成:在氮气保护下,将1 mol/L NaOH 缓慢滴加到32 ml 0.5 mol/L Ni(NO3)2、8 ml 0.5 mol/L Al(NO3)3(上海产,AR)和8 ml 0.5 mol/L Zn(NO3)的混合溶液中,直到pH 值约为7.5,得到的悬浊液在100℃下搅拌18 h 后,转移到数个聚四氟乙烯衬里的高压釜中,在180℃下静置24 h。再将悬浊液抽滤,用去离子水、丙酮先后洗涤3~5 次,在65℃下干燥24 h后,得到[Ni4AlZnx(OH)10+2x]NO3样品。取1 mmol 该样品,加入50 ml 去离子水,搅拌成悬浊液,在氮气保护下,向其中缓慢滴加3 mol 1 mol/L NaOH,在室温下搅拌8 h 后,将悬浊液抽滤,用去离子水、丙酮先后洗涤3~5 次,并在65℃下干燥24 h,得到最终产物[Ni4AlZnx(OH)10+2x]OH 样品。x=0 的样品记作Ni4Al-OH;x=1 的样品记作Ni4AlZn-OH。
1.2 样品的结构与组成分析
用D/max 2000/PC X 射线衍射仪(日本产)对样品结构进行分析,CuKα,λ=0.154 06 nm,扫描速度为0.02 (°)/s,步长为0.02 °,管压40 kV,管流70 mA。
1.3 电极的制备
将50 mg 样品与160 mg 镍粉(上海产,≥96.0%)、40 mg钴粉(上海产,≥99.5%)混合均匀,滴加适量的聚四氟乙烯(山东产,33.0%)和去离子水,研磨成糊状,粘附在泡沫镍(1.7 mm 厚,110 PPI,长沙产,Φ=1.5 cm)两侧,在80℃下干燥4 h。将干燥好的电极以20 MPa 的压力压制1 min,得到圆形电极片(含50 mg 活性物质)。测试前,将电极片在7 mol/L KOH(上海产,AR)溶液中浸泡24 h。
1.4 电化学性能测试
用2001CT 电池测试系统(武汉产)的三电极体系进行恒流充放电测试,以镍丝(上海产,>99.9%)为导线,镍片(上海产,>99.9%)为对电极,自制Hg/HgO(7 mol/L KOH)为参比电极,7 mol/L KOH 溶液为电解液。电极先以5 mA的电流充电4 h、放电至0 V,进行5 次活化,再以40 mA 的电流充电30 min、20 mA 的电流放电至0 V,循环250 次。
用CHI660b 电化学工作站(上海产)进行循环伏安和交流阻抗测试。电极恒流充放电200 次后,进行循环伏安测试,电位为0~0.70 V,扫描速度为0.10 mV/s;电极恒流充放电20 次后,在放电深度(DOD)为100%时,进行阻抗测试,频率为10-3~105Hz,用Zview2 软件对结果进行拟合。
用式(1)计算单个镍原子的交换电子数目(NEE)。

式(1)中:Cexp为放电比容量(Ah/g),n 为1 g 活性物质所含Ni 原子的物质的量,F 为法拉第常数。
2018珠海航展,万众瞩目。歼20三机编队,四机编队,以新涂层、新队形,高姿态亮相。歼10B推力矢量“超机动”,惊艳登场。运20“胖妞”亦飞临珠海,长空劲舞。一系列最新研制的军民两用设备设施,集中展示了我国高新技术产业、军工产业的巨大进步。
2 结果与讨论
2.1 结构与组成分析
图1 为β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 及Ni4AlZn-OH的XRD 图。
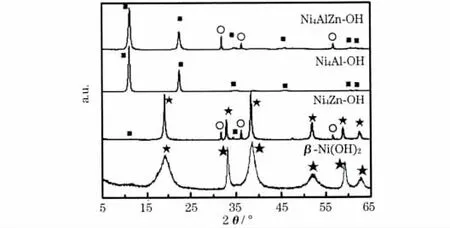
图1 β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的XRD 图Fig.1 XRD patterns of β-Ni(OH)2,Ni4Zn-OH,Ni4Al-OH and Ni4AlZn-OH
对比图1 与α-Ni(OH)2的标准谱(JCPDS:38-715)及β-Ni(OH)2的标准谱(JCPDS:1-1047)可知:Ni4Zn-OH 样品主要以β-Ni(OH)2的形式存在,与文献[8]的结果一致。经过水热处理后,样品出现了ZnO 相,原因是Ni4Zn-OH 样品中的Zn(OH)2在高温下脱水生成了ZnO[9],导致Ni4Zn-OH 样品实际上是由Ni4Zny(OH)10+2y和ZnO 两相组成。Al3+掺杂的Ni(OH)2及共同掺杂Al3+和Zn2+的Ni(OH)2,显示了α-Ni(OH)2的结构特征,均为层状氢氧化物,其中Ni4Al-OH的化学式为[Ni4Al(OH)10]OH,Ni4AlZn-OH 样品经高温水热处理后,也出现了[Ni4AlZny(OH)10+2y]OH 和ZnO 两相。
2.2 充放电性能
为了考察不同金属离子掺杂的Ni(OH)2的循环性能,对电极进行恒流充放电测试,结果见图2。
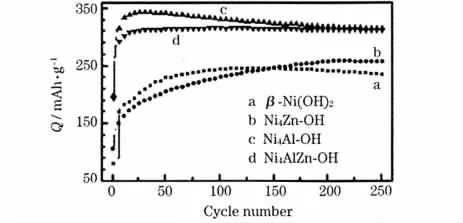
图2 β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的循环性能Fig.2 Cycle performance of β-Ni(OH)2,Ni4Zn-OH,Ni4Al-OH and Ni4AlZn-OH
从图2 可知,在开始的充放电过程中,Ni4Zn-OH 的放电比容量最低,但随着循环的深入,放电比容量逐渐增大,在第140 次循环左右超过了β-Ni(OH)2,说明Ni4Zn-OH 的活化速度慢于β-Ni(OH)2和Ni4Al-OH。Ni4Al-OH 样品在第28 次循环的放电比容量达到最大值343 mAh/g,显示出较快的活化速度,但衰减速度也较快,第255 次循环的放电比容量与Ni4AlZn-OH 基本相同,为309 mAh/g,容量衰减率为10%。Ni4AlZn-OH 虽然放电比容量低于Ni4Al-OH,但循环稳定性好,第125 次循环的放电比容量达到最大值315 mAh/g,循环255 次的容量衰减率仅为2%。
实际上,在充放电过程中,活性成分为Ni 原子,Al 和Zn是惰性物质,起辅助作用。比较NEE,可说明这些掺杂离子在充放电过程中所起的作用。4 种样品的NEE 见图3。
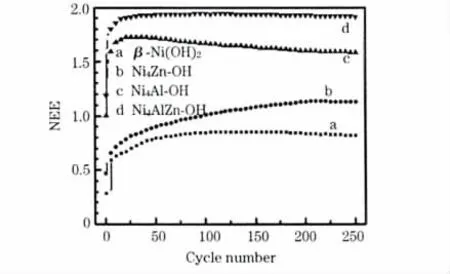
图3 β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的NEE 与循环次数的关系Fig.3 Relation between number of exchange electrons(NEE)of single nickel atom and cycle number for β-Ni(OH)2,Ni4Zn-OH,Ni4Al-OH and Ni4AlZn-OH
从图3 可知,在充放电过程中,Ni4AlZn-OH 具有较高的NEE,最大值为1.93 个,说明Ni4AlZn-OH 中Ni 原子的利用率较高。β-Ni(OH)2的理论最高氧化价态为+3 价,因此NEE 最高为1 个,实验得到的最大值为0.85 个。Ni4Zn-OH含有α 和β 两相,α-Ni(OH)2在充电过程中,Ni 原子可被氧化成超过+3 价的价态,因此NEE 有可能超过1 个,而实验得到的Ni4Zn-OH 电极的最大值为1.13 个。实验得到,Ni4Al-OH 电极中的NEE 为1.76 个。综合上述分析可知:Al3+、Zn2+的掺杂,都可提高活性物质的利用率。
β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 在第28次循环时的充放电曲线见图4。
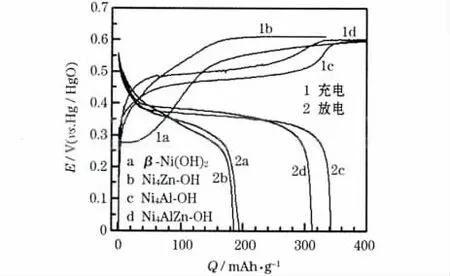
图4 β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 在第28 次循环时的充放电曲线Fig.4 Charge-discharge curves of β-Ni(OH)2,Ni4Zn-OH,Ni4Al-OH and Ni4AlZn-OH in the 28th cycle
从图4 可知,各样品的充电电压平台相差不大,均在0.59 V 附近,且变化平缓。β-Ni(OH)2及Ni4Zn-OH 的放电比容量较小,分别为195.8 mAh/g 和185.9 mAh/g,放电平台电压相对较低;Ni4Al-OH 及Ni4AlZn-OH 的放电比容量较大,分别为343 mAh/g 和312 mAh/g,且具有较平坦的放电平台,放电中值电压较高,其中Ni4AlZn-OH 的放电中点电位最高,说明同时掺杂Al3+和Zn2+,可提高Ni(OH)2电极材料的放电电位。
2.3 循环伏安分析
β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的循环伏安曲线见图5。
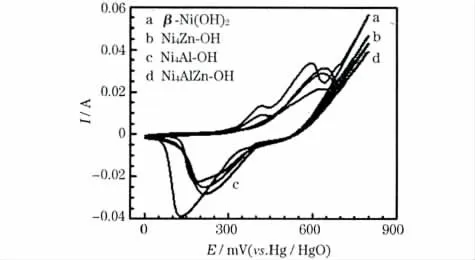
图5 β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的循环伏安曲线Fig.5 CV curves of β-Ni(OH)2,Ni4Zn-OH,Ni4Al-OH and Ni4AlZn-OH
一般认为,在氧化峰处发生Ni2+氧化成高价镍的反应;在还原峰处发生该反应的逆反应。Ni4Al-OH 和Ni4AlZn-OH的循环伏安曲线只有1 个氧化峰(630~650 mV)和1 个还原峰(214 mV),氧化峰对应的氧化态均为γ-NiOOH,还原峰对应的还原态均为α-Ni(OH)2;β-Ni(OH)2和Ni4Zn-OH 的循环伏安曲线各出现了2 个氧化峰和1 个还原峰,其中2 个氧化峰分别位于420 mV 附近和590~635 mV,说明样品有两个氧化态。XRD 分析已经证实β-Ni(OH)2和Ni4Zn-OH 为β-Ni(OH)2的结构,如果是正常的充放电循环,样品的氧化态应为β-NiOOH,氧化峰位于420 mV 附近;由于电极膨胀,导致了另一个氧化态的出现,即为γ-NiOOH,分别对应于596 mV和631 mV,与文献[10]报道的结果一致。
氧化峰电位(Ea)和还原峰电位(Ec)之差ΔE 反映了电极电化学反应的可逆性,ΔE 越大,电极反应的可逆性越差。比较氧化态γ-NiOOH 与还原态Ni(OH)2可知,β-Ni(OH)2和Ni4Zn-OH 电极的ΔE 较大,分别为465 mV 和442 mV,说明电极反应的可逆性不好。Ni4Al-OH 和Ni4AlZn-OH 电极的ΔE 较小,分别为430 mV 和422 mV,说明电极反应的可逆性较好。由此可知:Al3+和Zn2+的掺杂对氢氧化镍电极的电化学反应都有明显的影响,电极反应的可逆性得到了提高,其中Ni4AlZn-OH 电极的ΔE 最小,即电极反应可逆性最好,与图2 得到的结果一致。
2.4 电化学阻抗分析
β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的电化学阻抗谱(EIS)见图6A;图6B 为整个电极过程的等效电路图,其中:Rs代表电极过程的溶液电阻,Qc代表电极过程的双电层电容,Rt代表发生电化学过程的电荷转移电阻,Wo为Warburg阻抗。
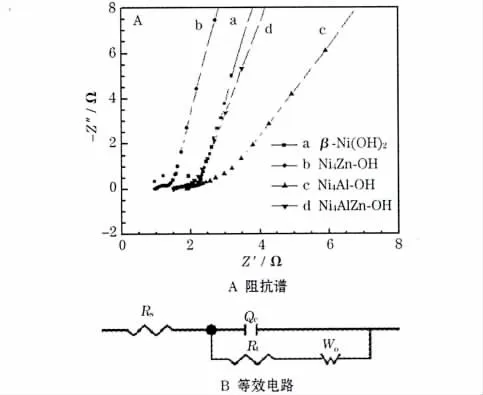
图6 β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的电化学阻抗谱和等效电路图Fig.6 Electrochemical impedance spectra (EIS) of β-Ni(OH)2,Ni4Zn-OH,Ni4Al-OH and Ni4AlZn-OH and the equivalent circuit
图6 中,交流阻抗谱由高频区的圆弧和低频区的斜线组成。高频区的圆弧对应镍电极的电荷转移过程,半径为电荷转移阻抗;低频区的斜线反映了质子扩散过程,斜率反映了质子扩散的难易。从定性的角度来讲,圆弧半径越小说明电荷转移阻抗越小,斜线斜率越小说明扩散越容易[11]。
不同电极材料的交流阻抗谱差别很大。β-Ni(OH)2在很宽的频率范围内表现为一个相当大的圆弧,表明电化学内阻很大;具有较大的斜线斜率,表明该电极主要受电荷转移的控制。
用ZView.2 软件拟合电化学阻抗谱得到的参数见表1。
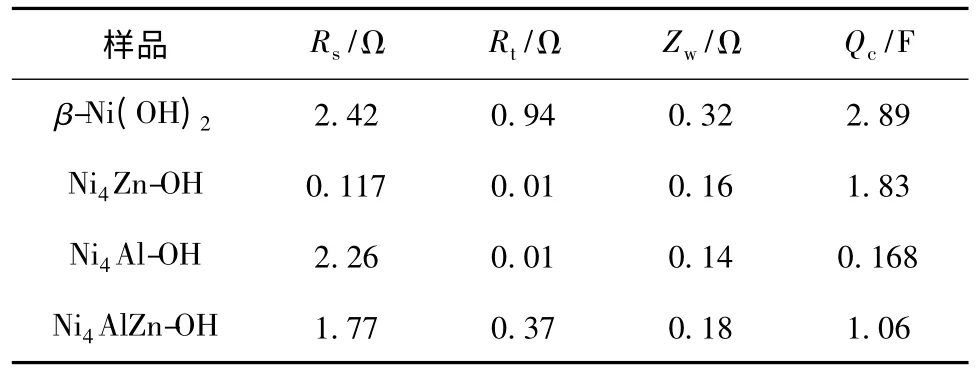
表1 β-Ni(OH)2、Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH 的阻抗拟合参数数值Table 1 Fitted EIS data for electrodes with β-Ni(OH)2,Ni4Zn-OH,Ni4Al-OH and Ni4AlZn-OH
从表1 可知,β-Ni(OH)2的Rs、Rt、Zw和Qc均为最大值,说明电子在电极与溶液表面之间的扩散速度较慢,同时在氧化还原的过程中,β-Ni(OH)2不能够形成稳定的结构,质子扩散的阻力较大。Ni4Zn-OH、Ni4Al-OH 和Ni4AlZn-OH电极在高频区的圆弧减小,表明电化学内阻降低。对于Ni4Al-OH,在低频区为一条接近45 °的斜线,Rt及Zw分别为0.01 Ω 和0.14 Ω,电荷转移阻抗和质子扩散阻抗均较小。
3 结论
通过共沉淀和后续水热处理的方法合成了不同金属掺杂的Ni(OH)2,并对它们进行了结构和电化学性能分析。
Al3+单独掺杂的和Al3+、Zn2+共同掺杂的Ni(OH)2为α-Ni(OH)2结构,Zn2+单独掺杂的Ni(OH)2为β-Ni(OH)2结构。电化学性能测试结果表明:经过255 次循环,Al3+、Zn2+共同掺杂的Ni(OH)2显示了良好的电化学循环稳定性和较高的放电容量。
[1]WANG Dian-long(王殿龙),LIU Ying(刘颖),DAI Chang-song(戴长松),et al.影响MH/Ni 电池正极放电容量的因素[J].Battery Bimonthly(电池),2004,34(1):64-66.
[2]JI Yi-gang(季益刚),ZHOU Yi-ming(周益明),SHAO Yang(邵阳),et al.β-Ni(OH)2的制备及电化学性能[J].Battery Bimonthly(电池),2006,36(6):456-458.
[3]Zhao Y L,Wang J M,Chen H,et al.Different additives-substituted alpha-nickel hydroxide prepared by urea decomposition[J].Electrochim Acta,2004,50(1):91-98.
[4]ZHOU Huan-bo(周环波),ZHOU Zhen-tao(周震涛).Al 掺杂纳米Ni(OH)2的结构及电性能[J].Battery Bimonthly(电池),2005,35(3):180-182.
[5]Gao X R,Lei L X,Hu M,et al.Structure,morphology and electrochemical performance of Zn-doped[Ni4Al(OH)10]OH[J].J Power Sources,2009,191(2):662-668.
[6]LEI Li-xu(雷立旭),ZHANG Wei-feng(张卫峰),HU Meng(胡猛),et al.层状复合金属氢氧化物结构性质及其应用[J].Chinese Journal of Inorganic Chemistry(无机化学学报),2005,21(4):451-463.
[7]JIANG Zhong-gui(蒋忠桂),HU Meng(胡猛),GAO Xiao-rui(高晓蕊),et al.Y 取代的Ni(OH)2的电化学性能[J].Battery Bimonthly(电池),2008,38(2):82-84.
[8]Li W Y,Zhang S Y,Chen J.Synthesis,characterization,and electrochemical application of Ca(OH)2-,Co(OH)2-,and Y(OH)3-coated Ni(OH)2tubes[J].J Phys Chem B,2005,109(29):14 025-14 032.
[9]Tessier C,Guerlou-Demourgues L,Faure C,et al.Structural and textural evolution of zinc-substituted nickel hydroxide electrode materials upon ageing in KOH and upon redox cycling[J].Solid State Ionics,2000,133(1-2):11-23.
[10]Zhou H B,Zhou Z T.Preparation,structure and electrochemical performances of nanosized cathode active material Ni(OH)2[J].Solid State Ionics,2005,176(23-24):1 909-1 914.
[11]Armstrong R D,Charles E A.Some aspects of the A.C.impedance behaviour of nickel hydroxide and nickel/cobalt hydroxide electrodes in alkaline solution[J].J Power Sources,1989,27(1):15-27.

