血清质谱结合多反应监测方法应用于慢性乙肝肝纤维化分期相关小分子蛋白标志物的筛选
张清清,王美玲,贾晓芳,张丽军,王兴鹏,陆伦根,徐铭益
1.上海交通大学附属第一人民医院消化内科,上海 200080;2.复旦大学附属公共卫生临床中心蛋白组学平台
在中国,慢性病毒性乙型肝炎(CHB)是最常见的导致肝纤维化和肝硬化的疾病[1]。早期诊断肝纤维化可以有效地改善慢性乙肝患者的预后。至今为止,一些临床蛋白组学研究在慢性肝病肝纤维化疾病中开展,但是尚未鉴定或验证出单个特定的肝纤维化诊断标志物蛋白[2]。质谱结合多反应监测(MRM)技术可用于检测特定的肽序列,具有高度选择性和灵敏性,可有效地定量分析小分子蛋白质。本研究旨在CHB患者中应用血清蛋白组学的质谱结合MRM方法,初步寻找肝纤维化分期相关小分子蛋白诊断标志物。
1 材料与方法
1.1 临床队列建立 建立前瞻性临床队列共126例CHB病例。CHB病例入选标准:按照中华医学会制定的《慢性乙型肝炎防治指南》[3]所规定的慢性乙型病毒肝炎感染诊断标准,有乙型肝炎或HBsAg阳性史超过6个月,现HBsAg和(或)HBV-DNA仍为阳性者;排除条件:艾滋病毒或慢性丙肝病毒感染,饮酒量>30 g/d,代谢性或其他类型的肝损,或者已接受肝病治疗,肝活检组织不符合标准。入选对象均于肝穿刺前一周内取清晨空腹静脉血。取血后即送血常规、生化、乙肝病毒定量、HBV-DNA,并留取血清标本-80℃保存。入选的CHB病例均行经皮肝活检加病理学检测,肝脏纤维化程度诊断标准为组织病理Scheuer评分(S0-S4)。
选取40例CHB患者的血清样本进行二维凝胶电泳(2-DE)检测,分2组:轻度纤维化组(包括10例S0期和10例S1期患者)和重度纤维化组(包括10例S3期和10例S4期患者)。选取86例CHB患者的血清样本行MRM定量检测,分5组:S0组13例,S1组22例,S2组20例,S3组16例,S4组15例。患者的临床资料和实验室特征如表1所示。
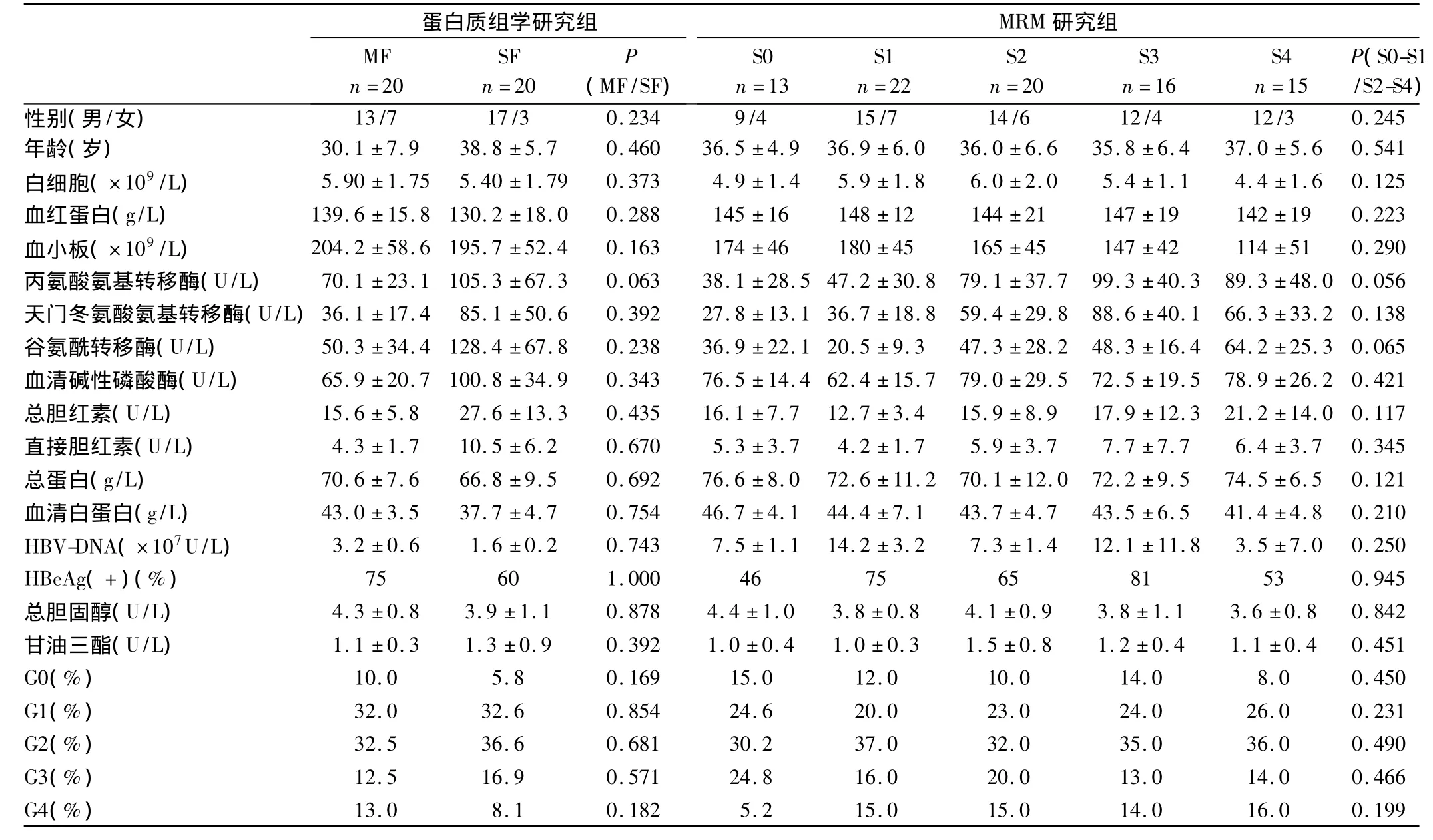
表1 患者的临床资料和实验室特征Tab 1 Patients’clinical date and characteristics
1.2 血清样品制备 血液样本以乙二胺四醋酸(EDTA)抗凝,用AurumTM试剂盒(Bio-Rad公司)去除血清样本中的高丰度蛋白质(白蛋白、IgG)。血清加缓冲液(20 mmol/L磷酸盐缓冲剂、pH 7.0)稀释4倍,加入1 ml柱形筒,离心后收集分离的蛋白碎片,丙酮沉淀,用2-DE溶解缓冲液(8 mmol/L尿素、2 mmol/L 硫脲、4% 丙磺酸、1%Nonidet P40、65 mmol/L DDT、0.5%Pharmalyte 3-10),使其干燥和溶解,-80℃存储,再经2-DE分析。白蛋白和IgG的洗脱采用的SDS溶解缓冲液(100 mmol/L Tris-HCl,pH 6.8、20% 丙三醇、4% 十二烷基磺酸钠、100 mmol/L二硫苏糖醇)。蛋白质浓度测定采用Bradford法。MRM检测的血清多肽提取如下[4-5]:血清蛋白等比例0.1%三氟乙酸和乙腈混合液沉淀,充分震荡混匀后,4℃下孵育30 min,4℃,12000 r/min离心30 min,取上清,用离心浓缩仪进行冻干(Labconco公司)。
1.3 2-DE筛选差异蛋白 2-DE采用phoriso-electronic focusing system(GE Healthcare,美国)和 Bio-Rad蛋白质Ⅱ电泳仪[6]。冻存样本快速解冻后加入等电聚焦电泳样品稀释液中稀释(包含8 mol/L尿素、2 mol/L硫脲、4%丙磺酸、0.1 mol/L 二硫苏糖醇,1.6%pH 值为3 ~10 线性两性电解质缓冲液),将250 μg蛋白质放入350 μl缓冲液样品中稀释。一维等电聚胶电泳在20℃,18 cm梯度胶,电泳参数:30 V 12 h、500 V 1 h、1000 V 1 h,渐变至8000 V 30 min、8000 V 6 h、52.1 KVh。二维电泳是在13.5%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)联合Bio-Rad蛋白Ⅱ电泳仪下进行,然后进行考马斯亮蓝G-250染色。
染色的2-DE胶,通过 Image Scanner扫描仪(GE Healthcare,美国)对凝胶进行扫描获取图像,电泳图谱利用Image Master分析软件(GE Healthcare,美国)对图像进行强度校正、点检测、背景消减、匹配等分析。每个蛋白质点与总凝胶蛋白的体积比计算出标准化值,并进而计算每个蛋白点的相对体积以消除人为实验误差引起的密度差异。二组的差异表达蛋白由两样本t检验统计[7]。蛋白质点差异的阈值定为组间的平均凝胶的蛋白质点体积差异至少在2倍以上。
差异表达蛋白质分析用 ESI-MS-MS串联质谱法(Esquire HCT,Bruker-Daltonics,Bremen,德国)。考马斯亮蓝染色的蛋白质点用50%的乙腈褪色,然后在37℃ 20 ng/ml胰蛋白酶中孵化过夜。多肽提取物在50%乙腈和0.1%三氟乙酸中冷却干化。干化的多肽提取物被2%丙烯腈和0.1%三氟乙酸混合液稀释溶解,通过C18 μ-前置柱(300 μm直径×5 mm 长,5 μm,PepMapTM,Dionex)脱盐,然后由 Ultimate 3000仪 (Dionex,Sunnyvale,CA,美国)的C-18逆向微柱(75 μm 直径 ×15 cm 长,3 μm,Pep-MapTM,Dionex)分离。从逆向微柱洗脱的多肽注入到带有PicoTip发射管喷雾针管实时离子化(New Objective,Woburn,MA,美国),再被 ESI质谱仪检测。质谱分析条件如下:毛细管电压1000~1500 V、氮气流量4 L/min、氮气温度150℃。数据库的搜索参数:一级质谱公差1.2 Da、二级质谱0.6 Da。Mascot搜库分数需大于33分。四肽以下的蛋白质,每个肽都手工检查确保每个肽至少有3~4个连续y或 b系列离子(如 y4、y5、y6)。
1.4 差异蛋白的MRM检测 MRM应用日本岛津公司的高效液相色谱API 3200质谱仪。45 μl血清肽样品加入0.06 ml/min的 Acclaim PepMap C18柱。每个目标肽产生2个转换离子对,母离子以2.0 m/z单位解离(撞击能量 35%,Q=0.25,活化时间30 ms),然后在2.0 m/z单位的隔离窗中波谱扫描子离子。由于API 3200仪的检测灵敏度,仅m/z值小于800的目标多肽和m/z值相对小的产物离子对才能被筛选出。每个目标和内参多肽都至少检测2个特征离子对,特征离子对选择标准需满足该离子对具有唯一性和化学稳定性的条件。
我们用分析软件来提取和整合每个目标离子对的峰面积,计算它们的峰面积总和,最后计算目标多肽和内参多肽的峰面积总和比值(SPAR),不同肝纤维化组的离子对SPAR采用Kruskal-Wallis参数检验进行比较,具有统计学差异是候选的诊断标志物(P<0.05)。
1.5 建立诊断模型 建立差异蛋白诊断模型,诊断值是差异蛋白的多肽离子对的SPAR值。天冬氨酸转氨酶/血小板比例(APRI)、FIB-4和Forn’s指数根据以下公式测量[5,8]。受试者工作特征曲线下面积(AUROC)用来评价诊断模型的敏感性和特异性。APRI=[AST(/ULN)/PLT(109/L)]×100;FIB-4=[age(yr)×AST(U/L)]/{[PLT(109/L)]×(ALT(U/L)]1/2}Forn’s=7.811-3.131 ×In[PLT(109/L)]+0.781 × In[GGT(U/L)]+3.467 ×In[age(yr)]-0.014 ×[cholesterol(g/L)]。
1.6 生物信息学分析 我们应用生物信息学软件(Bruker Profile Analysis and IPI_human protein database)进行质谱鉴定。所有的多肽序列均在blastp数据库中获得验证(http://www.ncbi.nlm.nih.gov/blast/)。
1.7 统计学分析 应用SPSS 19.0(SPSS公司,芝加哥,美国)相关统计学软件及χ2检验用于分类变量的统计学分析,双侧t检验用于连续变量和单变量的统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 差异表达蛋白和二级质谱鉴定 2-DE实验中,Image Scanner扫描仪对6张2D-PAGE凝胶进行扫描获取图像,电泳图谱用Image Master软件分析。在轻度和重度纤维化二组间运用单变量分析和趋势检验,识别出8个显著差异表达蛋白质点(P<0.05,见图1)。二级质谱鉴定最终确认7个有效的差异表达蛋白(见表2)。在图2A和2B中,我们显示了同一血清样本的差异蛋白4的一级质谱和二级质谱峰图。

图1 2D-PAGE凝胶扫描识别的差异表达蛋白质点 如图所示为CHB患者血清的2D-PAGE凝胶扫描获取图像,包含1352对匹配点。我们使用pH为3~10,10~200 kDa的13.5%聚丙烯酰胺凝胶。本图为SF和MF组间的差异表达蛋白质点(质点体积=像素点×光斑尺寸)Fig 1 Serum protein spot profile by 2-DE The image represents the reference gel image built up from 6 separate 2D-PAGE gels from CHB patients’sera,containing 1352 matched spots.The 13.5%polyacrylamide gel has a linear pH 3~10 and a mass range of 10~200 kDa.The images showed differences in protein spot expression(spot volume=pixels×spot size)between group SF(A)and group MF(B)
2.2 MRM定量检测血清差异蛋白的多肽离子对表达值 MRM定量分析首先需建立方法学的标准曲线,本研究选取牛血清白蛋白(BSA)的合成多肽作标准肽来建立MRM参数。BSA校准曲线的相关系数(r)达到0.9949,有较好的线性曲线特征(见图3)。
2-DE筛选出的7个差异蛋白作为目标蛋白,每个目标蛋白产生2个多肽离子对,生成的目标离子对需符合m/z<800。差异蛋白4所产生的离子对的质谱图见于图2C~2F。
7个目标蛋白生成的14个目标离子对和2个内参离子对均具有好的稳定性和可靠性(见表3)。计算目标离子的SPAR值并行统计学分析2个不同纤维化组(轻度纤维化S0-S1组和显著纤维化S2-S4组)的表达情况。二组间比较,仅差异蛋白1、4和8存在显著性差异(P<0.05)。血清多肽离子对的SPAR值可以间接地反映血清对应的目标蛋白的表达水平,因此认为差异蛋白1、4、8与肝纤维化分期相关(见图4A-4C)。
2.3 诊断模型建立和评估 我们建立了三个多肽离子对诊断模型:差异蛋白 1(多肽离子对 499.3/839.4,499.3/676.3);差异蛋白 4(多肽离子对 701.5/357.3,701.5/456.3);差异蛋白 8(多肽离子对 500.8/409.2,500.8/724.4)。3个诊断模型区别肝纤维化S0-S1期和S2-S4期的受试者工作特征曲线(AUROCs)值分别是0.810、0.827 和0.801(见表4 和图4D ~4F)。而血清常规指标建立的诊断模型 APRI、FIB-4和 Forn’s指数的AUROCs值分别为 0.876、0.865 和 0.724(见表 4 和图4G)。结果表明,血清多肽离子对所建立的诊断模型与APRI、FIB-4、Forn’s指数比较,诊断肝纤维化不同分期具有相似的较好的敏感性和特异性。
最后,我们通过生物信息学分析证实,血清蛋白标志物是(1)差异蛋白1:转铁蛋白载脂蛋白A链;(2)差异蛋白4:补体C3c的C链;(3)差异蛋白8:转铁蛋白。
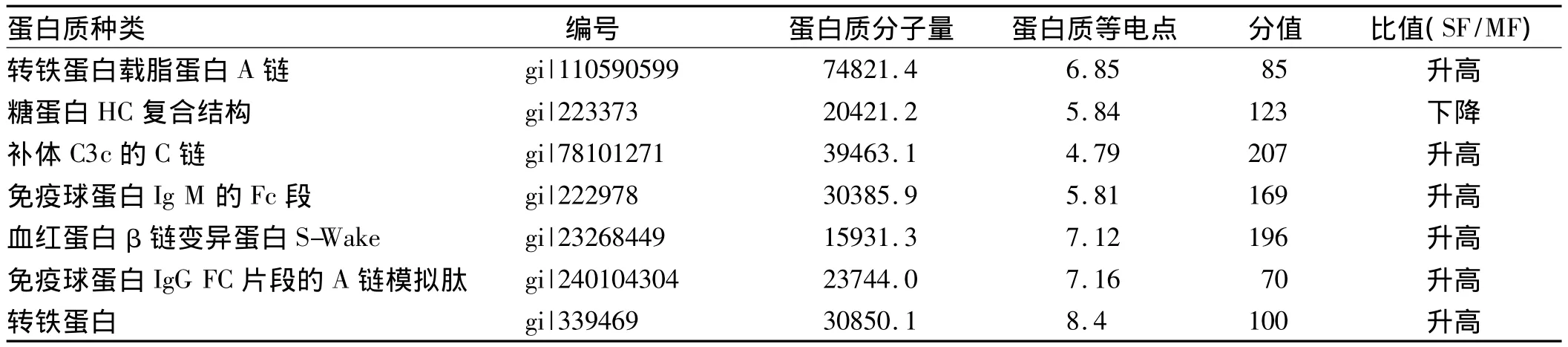
表2 二级质谱鉴定的差异表达蛋白Tab 2 Significantly differentially expressed protein spots
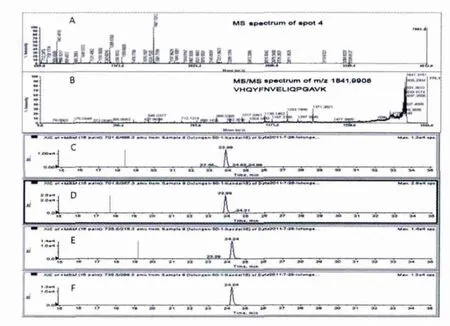
图2 血清补体C3c产生的离子对的ESI-MS-MS分析和MRM监测 A:补体C3c的MS分析和一级谱峰值;B:进一步MS/MS分析及二级谱峰值;C~F:补体C3c产生的离子对的质谱图:701.5/456.3(C);701.5/357.3(D);735.5/215.3(E);735.5/389.3(F)Fig 2 ESI-MS-MS and MRM ion pairs spectrum of complement component C3c A:the MS spectrum of complement component C3c was shown and mass values of peptide peaks were labeled out;B:peptide peaks for further MS/MS identification were labeled out with mass value and the MS/MS map of peptide 1841.9908 was shown;C:four ion pairs were generated from complement component C3c through MRM.It was shown ion pairs spectra of 701.5/456.3;D:701.5/357.3;E:735.5/215.3;F:735.5/389.3
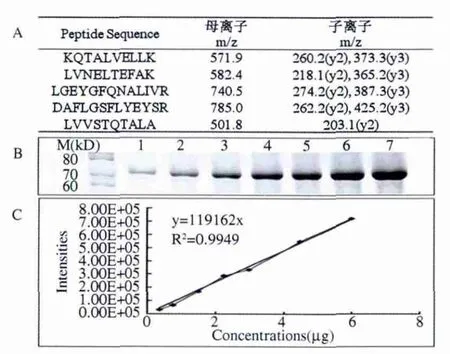
图3 牛血清白蛋白(BSA)标准曲线MRM定量检测 A:BSA的母离子(Parent Ion)及子离子(Fragment Ion)的MRM定量检测;B:BSA 的 SDS-PAGE 电泳结果:分别对 0.375、0.75、1.5、2.25、3、4.5和6 μg BSA进行凝胶电泳和考马斯亮蓝染色,图左侧为分子量;C:运用API 3200仪进行MRM检测的BSA标准曲线(相关系数为 0.9949)。Fig 3 Standard curve of BSA for MRM quantification Five peptides and the correlated precursor and fragment ions from BSA were used for MRM quantification.A:SDS-PAGE of BSA was shown.B:0.375,0.75,1.5,2.25,3,4.5 and 6 μg BSA(lane 1 ~ 7,respectively)were subjected to 11.5%SDS-PAGE and then the gel was stained by Coomassie brilliant blue G-250.“M”represented for“Marker”.The molecular weight of Maker was shown on the left of the gel.The standard curve of BSA for MRM quantification by API 3200 mass spectrometry;C:The correlation coefficient of standard curve was 0.9949
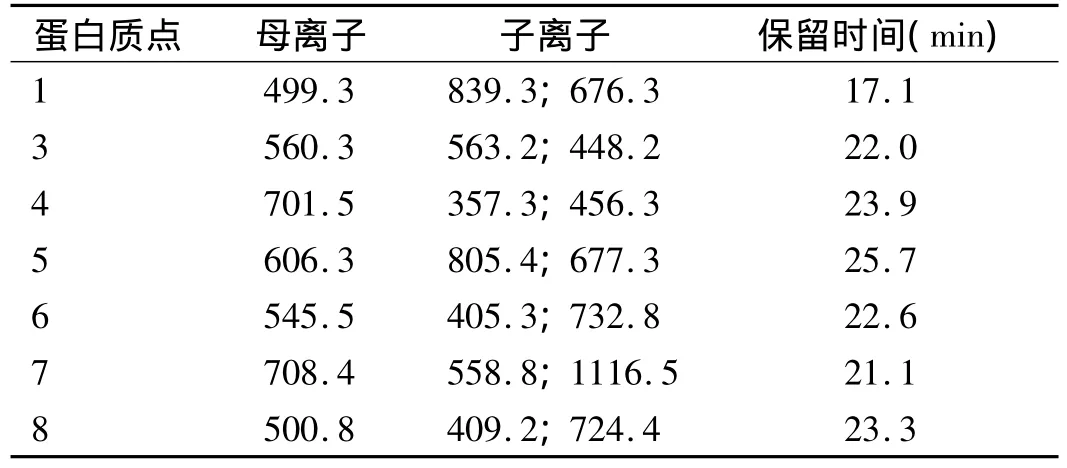
表3 7个目标蛋白生成的目标离子对的MRM定量分析Tab 3 Selected MRM transitions for 7 analyzed protein spots
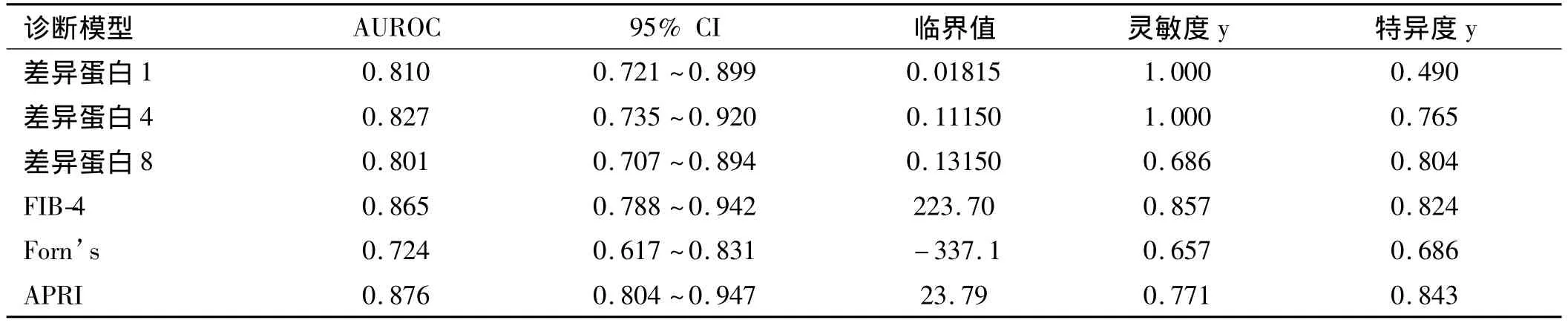
表4 血清多肽离子对所建立的诊断模型与APRI、FIB-4、Forn’s诊断模型的AUROC值Tab 4 AUROC of protein spots and other diagnostic models
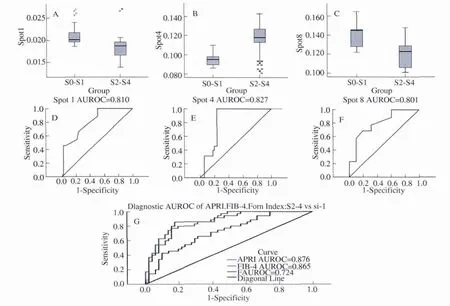
图4 差异蛋白诊断模型的 SPAR和 AUROC值 A、B、C分别为差异蛋白1、4、8在组S0-S1和S2-S4中的SPAR值;D、E、F分别为差异蛋白1、4、8诊断模型的AUROC值;G为APRI、FIB-4和Forn’s指数的AUROC值Fig 4 SPAR and AUROC values of 3 protein biomarkers Values of ion pairs generated from 3 biomarker protein spots in group S0-S1 and S2-S4(A:protein spot 1;B:protein spot 4;C:protein spot 8).AUROCs of 3 protein spots diagnostic models,APRI,FIB-4 and Forn’s index were shown(D:protein spot 1;E:protein spot 4;F:protein spot 8;G:APRI,FIB-4 and Forn’s Index)
3 讨论
目前仍然缺乏有效的非创伤性肝纤维化诊断标志物。近期的一些研究验证了血清比较蛋白组学应用于诊断丙型肝炎病毒(HCV)的临床价值[9-10]。很少有MRM在量化蛋白质诊断标志物方面的报道,近期的文献提出MRM技术应用于定量小分子蛋白,是一种很有前景的方法[11]。
我们的研究是首次将血清蛋白组学结合MRM用来检测血清蛋白,筛选出慢性乙型肝炎病毒感染致肝纤维化的诊断标志物。我们验证了血清中的三个小分子蛋白与乙肝肝纤维化分期具有较好的相关性。MRM量化血清蛋白对应的肽离子水平,显示人血清蛋白转铁蛋白载脂蛋白A链;人补体C3c的C链;转铁蛋白可区分CHB患者轻度肝纤维化(S0-S1)和显著肝纤维化(S2-S4)。它们与血清常规指标建立的诊断模型APRI;Forn’s和 FIB-4指数具有相类似的诊断效力。
肝脏在铁代谢如转铁蛋白产生中扮演着重要的角色。肝细胞表达转铁蛋白受体,然后这些受体在血液循环中结合两个离子。在终末期CHB患者中血清铁蛋白和转铁蛋白饱和度升高[12]。Gressner等[13]提出了关于血清转铁蛋白浓度在肝细胞去分化的发病机理中的诊断价值并提出可使用该参数在慢性肝病患者中作为肿瘤预测标志物。在非酒精性脂肪肝患者中,肝细胞铁沉积往往导致肝纤维化[14]。我们的研究发现人血清转铁蛋白载脂蛋白A链和转铁蛋白在CHB患者中区分轻度和中重度肝纤维化中有较好的诊断价值(AUROC:0.801 ~0.810)。
但是,Gangadharan等[15]认为血清转铁蛋白是大分子蛋白质,而2-DE的使用范围为pH 3~5.6;他发现两个补体C3和C4的β链在HCV肝硬化患者中表达减少。C3a片段(m/z 8130)是一个HCV肝细胞性肝癌的早期诊断标志物[16]。C4a也在区分转氨酶水平正常的HCV携带者或慢性丙型肝炎患者有良好的诊断价值[17]。本研究也发现了补体C3c可区分CHB患者的纤维化程度(AUROC=0.827)。
我们的结论是:血清质谱MRM分析可以有效地改善蛋白组学方法,从而帮助我们寻找到可初步区分CHB患者肝纤维化程度的3个诊断标记物:血清转铁蛋白载脂蛋白链A、补体C3c和转铁蛋白。
[1]European Association for the Study of the Liver.EASL clinical practice guidelines:management of chronic hepatitis B[J].Gastroenterol Clin Biol,2009,33(6-7):539-554.
[2]Marrocco C,Rinalducci S,Mohamadkhani A,et al.Plasma gelsolin protein:a candidate biomarker for hepatitis B-associated liver cirrhosis identified by proteomic approach[J].Blood Transfus,2010,8 Suppl 3:S105-S112.
[3]Liver Disease and Infectious Diseases branch of Chinese medical association.Chronic hepatitis B prevention guide[J].The Chinese Journal of Liver Disease,2005,13(12):881-901.中华医学会肝病学分会、感染病学分会.慢性乙型肝炎防治指南[J].中华肝脏病杂志,2005,13(12):881-901.
[4]Tucholska M,Scozzaro S,Williams D,et al.Endogenous peptides from biophysical and biochemical fractionation of serum analyzed by matrix-assisted laser desorption/ionization and electrospray ionization hybrid quadrupole time-of-flight[J].Anal Biochem,2007,370(2):228-245.
[5]Wai CT,Greenson JK,Fontana RJ,et al.A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C[J].Hepatology,2003,38(2):518-526.
[6]Zhang L,Peng X,Zhang Z,et al.Subcellular proteome analysis unraveled annexin A2 related to immune liver fibrosis[J].J Cell Biochem,2010,110(1):219-228.
[7]Zhang L,Jia X,Zhang X,et al.Alpha-1 antitrypsin variants in plasma from HIV-infected patients revealed by proteomic and glycoproteomic analysis[J].Electrophoresis,2010,31(20):3437-3445.
[8]Sterling RK,Lissen E,Clumeck N,et al.Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection[J].Hepatology,2006,43(6):1317-1325.
[9]Cheung KJ,Tilleman K,Deforce D,et al.Usefulness of a novel serum proteome-derived index FI-PRO(fibrosis-protein)in the prediction of fibrosis in chronic hepatitis C[J].Eur J Gastroenterol Hepatol,2011,23(8):701-710.
[10]Cheung KJ,Libbrecht L,Tilleman K,et al.Galectin-3-binding protein:a serological and histological assessment in accordance with hepatitis C-related liver fibrosis[J].Eur J Gastroenterol Hepatol,2010,22(9):1066-1073.
[11]Ang CS,Nice EC.Targeted in-Gel MRM:a hypothesis driven approach for colorectal cancer biomarker discovery in human feces[J].J Proteome Res,2010,9(9):4346-4355.
[12]Ghaziani T,Alavian SM,Zali MR,et al.Serum measures of iron status and HFE gene mutations in patients with hepatitis B virus infection[J].Hepatol Res,2007,37(3):172-178.
[13]Gressner OA,Jafari S,Erkens M,et al.Evaluation of serum percent trisialotransferrin as potential predictive biomarker of hepatocellular dedifferentiation in chronic liver disease[J].Clin Chim Acta,2009,403(1-2):188-193.
[14]Valenti L,Canavesi E,Galmozzi E,et al.Beta-globin mutations are associated with parenchymal siderosis and fibrosis in patients with nonalcoholic fatty liver disease[J].J Hepatol,2010,53(5):927-933.
[15]Gangadharan B,Antrobus R,Chittenden D,et al.New approaches for biomarker discovery:the search for liver fibrosis markers in hepatitis C patients[J].J Proteome Res,2011,10(5):2643-2650.
[16]Kanmura S,Uto H,Sato Y,et al.The complement component C3a fragment is a potential biomarker for hepatitis C virus-related hepatocellular carcinoma[J].J Gastroenterol,2010,45(4):459-467.
[17]Imakiire K,Uto H,Sato Y,et al.Difference in serum complement component C4a levels between hepatitis C virus carriers with persistently normal alanine aminotransferase levels or chronic hepatitis C [J].Mol Med Rep,2012,6(2):259-264.

