阿萨希毛孢子菌的溶血活性及生物膜形成能力与其基因型关系研究
孙伟 苏建荣 许淑珍
(首都医科大学附属北京友谊医院临检中心,北京 100050)
阿萨希毛孢子菌 (Trichosporon asahii)为一种条件致病酵母样真菌,是毛孢子菌病最常见的致病菌,可引起免疫功能低下患者的各种机会性感染[1-2],因此,对其毒力因子的研究已倍受关注。本研究对其临床尿路感染分离株的溶血活性及生物膜形成能力进行测定,并分析其与基因分型的关系,探讨尿路感染阿萨希毛孢子菌的基因特点及毒力强弱,为临床流行病学研究和阿萨希毛孢子菌感染的诊治提供依据。
1 材料与方法
1.1 菌株
阿萨希毛孢子菌,共10株,分离自8名尿路感染患者(7名男性,1名女性,均为2008~2012年期间我院ICU患者,住院期间均有尿路插管史),并经过VITEK2 COMPACT初步鉴定。
患者编号与菌株编号一致,其中选取3株分离自患者5的菌株纳入研究(菌株间隔2个月,编号为5-1,5-2,5-3)。
1.2 主要试剂
2,3-二 (2-甲氨基-4-硝基-5-磺苯基)-5[(苯胺基)羧基]-2氢-氢氧化四氮唑 (XTT)、吩嗪硫酸甲酯(PMS)、吗啡啉丙磺酸(MOPS)均购自Sigma公司;RPMI1640培养基 (Gibco公司);酵母粉、蛋白胨、沙堡弱培养基、血平板 (Oxfoid公司);无菌培养皿及 96孔板 (Costar);酶标仪 (TECAN,Infinite200);VITEK2 COMPACT(法国生物梅里埃公司)。
1.3 基因型别的鉴定
取新鲜培养的阿萨希毛孢子菌菌落,无菌生理盐水制成菌悬液,离心收集菌体。玻璃珠振荡法[3]提取 DNA,利用 IGS1区特异性引物进行扩增(26SF:5 '-ATCCTTTGCAGACGCTTGA-3 ';5SR:5 '-AGCTTGACTTCGCAGATCGG-3'),PCR 产物送北京Invitrogen公司双向测序,所得序列在Genbank核酸序列数据库中进行同源性搜索,并与已知的12种阿萨希毛孢子菌基因型别进行比较[4],得到10株临床分离株的具体基因型别。本研究中当同源性超过95%时视为相同基因型。
1.4 溶血活性测定
溶血试验参照平板法进行,并进行了适当调整[5]。将新鲜培养的阿萨希毛孢子菌菌落用无菌生理盐水制备成浓度为108CFU/mL的菌悬液,取5 μL菌悬液和5 μL生理盐水分别点种于含糖的羊血平板(7 mL新鲜羊血加到100 mL含3%葡萄糖的沙堡葡萄糖培养基中,pH值为5.6±0.2),35℃、5%CO2培养。96 h后透射光下观察菌落周围的半透明溶血环,可观察到与菌落同圆心的溶血环,测定菌落直径 (mm)与总直径 (菌落+溶血环)并计算溶血指数 (记做Hz),Hz=总直径/菌落直径,可反应溶血活性的强弱[6-7]。Hz=1无溶血活性,Hz>1有溶血活性,且比值越大,溶血活性越强。白念珠菌ATCC90028和ATCC2201分别作为阳性和阴性对照。试验重复测定3次。
1.5 生物膜形成能力的测定
采用XTT还原比色法进行定量分析[8]。测定依据为代谢活性细胞可使黄色的四唑盐XTT裂解成橘黄色甲駑染料。收集沙堡弱培养基上新鲜培养的阿萨希毛孢子菌,无菌PBS溶液洗涤2次后,重悬于 pH7.0(0.165M MOPS调节 pH)的 RPMI1640培养基中,菌悬液终浓度为105CFU/mL。取2 mL菌悬液加入直径35 mm无菌培养皿(Costar),35℃培养。60 min后无菌PBS洗涤培养皿两次,去除未贴壁的菌体,加入2 mL新鲜的 RPMI1640-MOPS培养基继续培养48 h,每隔24 h更换一次培养基。未加入菌体的PBS溶液孔作为阴性对照,其余操作完全相同。培养结束后,弃去培养上清,2 mL无菌 PBS洗涤两次。1.5 mL XTTPMS溶液 (XTT终浓度12.5 μmol/L)分别加入洗涤好的生物膜孔和空白对照孔,35℃避光反应2 h。反应上清离心后分装入96孔微量滴定板,于492 nm(参比波长630 nm)处读取吸光度值。试验重复测定3次。
1.6 数据统计
SPSS 11.5进行统计分析。所有数据以(±s)表示,两组数据之间的比较采用t检验,多组数据之间的比较采用ANOVA检验。差异有统计学意义以P<0.05和P<0.01表示。
2 结 果
2.1 阿萨希毛孢子菌的基因分型
所分离10株阿萨希毛孢子菌经IGS1区特异性引物26sF/5sR扩增后与Genbank数据库中已知的12种基因型别进行比对,分别属于基因型Ⅰ、Ⅲ、Ⅳ型,其中以基因型Ⅳ型为主 (7/10=70%),其余分别为Ⅲ型 (2/10=20%)和Ⅰ型 (1/10=10%)。
2.2 体外溶血活性
10株阿萨希毛孢子菌的溶血活性均为阳性,活性值介于1.08~1.44之间,结果见表1。
2.3 生物膜形成能力
为建立阿萨希毛孢子菌在聚苯乙烯表面形成生物膜的最佳环境,在前期预实验的基础上,选择105CFU/mL接种浓度、菌体贴壁60 min、培养72 h作为最佳试验条件,此条件下,生物膜形成活性与XTT试验结果具有最好的相关性。试验重复测定3次。10株临床分离株的生物膜形成能力在492 nm处吸光度值介于0.06~0.93之间,结果见表2。
2.4 阿萨希毛孢子菌溶血活性及生物膜形成能力与其基因型的关系
表1尿路感染阿萨希毛孢子菌的溶血活性(±s,n=3)Tab.1 Hemolytic activity of urinary tract infection pathogenic Trichosporon asahii

表1尿路感染阿萨希毛孢子菌的溶血活性(±s,n=3)Tab.1 Hemolytic activity of urinary tract infection pathogenic Trichosporon asahii
注:Hz为溶血指数;各分离株溶血活性与阴性对照相比较,*P <0.05,#P <0.01
阴性对照基因型编号 1 2 3 4 5-1 5-2 5-3 6 7 8 1.22 ±0.26 1.01 ±0.02ⅣⅣⅣⅣⅠⅢⅣHz 1.16 ±0.14 1.08 ±0.23 1.43* ±0.14 1.20 ±0.28 1.22 ±0.24 1.33* ±0.21 1.20 ±0.23 1.15 ±0.24 1.44# ±0.29ⅣⅣⅢ
表2尿路感染阿萨希毛孢子菌的生物膜形成能力结果(±s,n=3)Tab.2 Biofilm formation ability of urinary tract infection pathogenic Trichosporon asahii
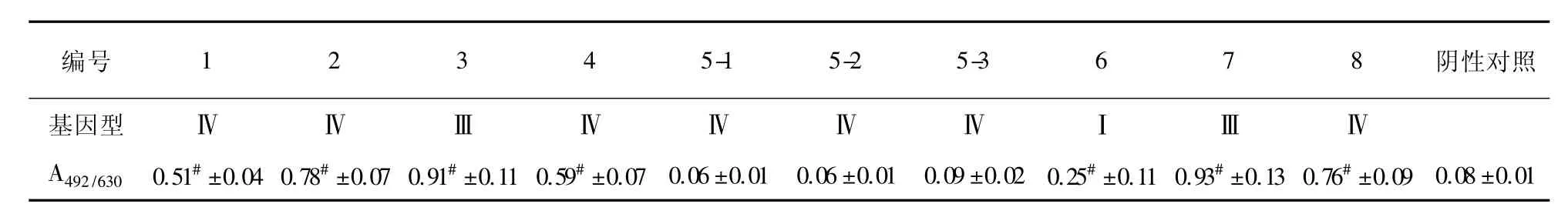
表2尿路感染阿萨希毛孢子菌的生物膜形成能力结果(±s,n=3)Tab.2 Biofilm formation ability of urinary tract infection pathogenic Trichosporon asahii
注:各菌株生物膜形成能力与阴性对照采用单因素方差分析相比较,#P<0.01
阴性对照基因型编号 1 2 3 4 5-1 5-2 5-3 6 7 8ⅣⅣⅢⅣⅣⅣⅣⅠⅢⅣ0.08 ±0.01 A492/630 0.51# ±0.04 0.78# ±0.07 0.91# ±0.11 0.59# ±0.07 0.06 ±0.01 0.06 ±0.01 0.09 ±0.02 0.25# ±0.11 0.93# ±0.13 0.76# ±0.09
10株尿路感染阿萨希毛孢子菌基因型分别属于Ⅰ、Ⅲ、Ⅳ型,其中以Ⅳ型为主。通过将基因型与溶血活性或生物膜活性对应,发现10株临床分离株均具有溶血活性,其中以Ⅲ型溶血活性最高。除患者5的3个分离株外,其他均具有生物膜形成能力,5-1、5-2、5-3分离株均属于基因型Ⅳ,且各株溶血活性与生物膜形成能力相近,故推测为同一菌株的反复感染。
3讨 论
毛孢子菌病是一种慢性、顽固、难治的系统性真菌病,呈世界性分布,且其发病率呈逐年上升的趋势,而阿萨希毛孢子菌是引起该病的主要致病菌,具有种内基因多态性的特点。本研究采用IGS1区的多态性特点来确定阿萨希毛孢子菌[9]的具体基因型别。IGS1区序列分析已成为重要的流行病学研究工具,许多研究以IGS1区序列特点对阿萨希毛孢子菌的基因分布特点进行了探讨[3,10-11]。目前,已知的阿萨希毛孢子菌基因型别共有 12种[12],本研究结果以基因型Ⅳ型为主(70%),其次为基因型Ⅲ和基因型Ⅰ。这与美国、日本、南美、欧洲等以 I型为主不同[3,9-10,13],说明在我国阿萨希毛孢子菌的基因型分布具有显著的地域特异性。国内其他学者的相关研究显示[4],我国阿萨希毛孢子菌主要为基因型I和Ⅳ,并未分离出基因型Ⅲ型的菌株。本研究结果与之既有相同又有区别,这可能与研究对象的标本来源不同有关。本研究标本来源为单一尿标本,而其他研究标本来源复杂,包括血液、痰、皮肤等。
溶血性是病原微生物破坏亚铁血红素后提取铁元素的能力,这种能力在感染过程中很重要。目前已知溶血性是念珠菌的毒力因素,但对于不同念珠菌或非白念珠菌的溶血性的研究却很少。本研究从溶血现象出发,半定量分析了临床分离的10株阿萨希毛孢子菌的溶血活性。结果显示,所分离菌株均具有溶血活性,其中以基因型Ⅲ型菌株的溶血活性最强。
生物膜是一种黏附于非生物或生物表面的微生物菌落,包裹在自身产生的细胞外基质中,是微生物在生长过程中为了适应生存环境而形成的存在形式。多数生物膜感染与近年来各种医用材料(各种支架、导管、瓣膜、起搏器、人工关节等材料)的使用率增高密切相关,因此介入性器械可以作为阿萨希毛孢子菌生物膜构建的黏附基质,使微生物群体黏附于细胞外多聚材料表面造成持续播散性感染,并且导致感染灶的耐药性增加而不易清除[8]。研究表明,微生物的致病力与其在聚合材料表面形成生物膜的能力呈正相关[14]。本研究采用各种导管常用的材料聚苯乙烯为黏附基质,观察尿路感染阿萨希毛孢子菌在其表面形成生物膜的能力,并用XTT比色还原法测定各菌株的生物膜形成活性大小,结果显示基因型Ⅲ型菌株的生物膜形成能力最强,这可能与该分离株患者的慢性感染有关(具体临床资料未展示)。
患者5的三次取材菌株的生物膜形成能力及溶血活性与其他菌株相比均无明显增加,却造成患者临床的持续感染,可能与该脑梗患者常年插管有关。也可能该患者的分离株除生物膜和溶血活性之外的其他致病因子如磷脂酶、酸性蛋白酶等活性较强,有待进一步深入研究。
本研究结果存在研究病例数相对偏少的局限性,但是,研究中所有菌株均分离自尿路感染患者,研究结果有助于了解阿萨希毛孢子菌造成深部感染甚至播散性感染的流行病学特点,尤其对阿萨希毛孢子菌尿路感染的诊断和治疗具有一定的临床意义。
[1]Itoh T,Hosokawa H,Kohdera U,et al.Disseminated infection withTrichosporon asahii[J].Mycoses,1996,39(5-6):195-199.
[2]Thibeault R,Champagne M,de Repentigny L,et al.Fatal disseminatedTrichosporon asahiiinfection in a child with acute lymphoblastic leukemia[J].Can J Infect Dis Med Microbiol,2008,19(2):203-205.
[3]Rodriguez-Tudela JL,Gomez-Lopez A,Alastruey-Izquierdo A,et al.Genotype distribution of clinical isolates ofTrichosporon asahiibased on sequencing of intergenic spacer 1[J].Diagn Microbiol Infect Dis,2007,58(4):435-440.
[4]Xia Z,Yang R,Wang W,et al.Genotyping and antifungal drug susceptibility ofTrichosporon asahiiisolated from Chinese patients[J].Mycopathologia,2011,173(2-3):127-133.
[5]Luo G,Samaranayake LP,Yau JY.Candidaspecies exhibit differentialin vitrohemolytic activities[J].J Clin Microbiol,2001,39(8):2971-2974.
[6]Furlaneto-Maia L,Specian AF,Bizerra FC,et al.In vitroevaluation of putative virulence attributes of oral isolates ofCandidaspp.obtained from elderly healthy individuals[J].Mycopathologia,2008,166(4):209-217.
[7]Negri M,Martins M,Henriques M,et al.Examination of potential virulence factors ofCandida tropicalisclinical isolates from hospitalized patients[J].Mycopathologia,2009,169(3):175-182.
[8]Di Bonaventura G,Pompilio A,Picciani C,et al.Biofilm formation by the emerging fungal pathogenTrichosporon asahii:development,architecture,and antifungal resistance[J].Antimicrob Agents Chemother,2006,50(10):3269-3276.
[9]Sugita T,Nakajima M,Ikeda R,et al.Sequence analysis of the ribosomal DNA intergenic spacer 1 regions ofTrichosporonspecies[J].J Clin Microbiol,2002,40(5):1826-1830.
[10]Kalkanci A,Sugita T,Arikan S,et al.Molecular identification,genotyping,and drug susceptibility of the basidiomycetous yeast pathogenTrichosporonisolated from Turkish patients[J].Med Mycol,2010,48(1):141-146.
[11]Sugita T,Ichikawa T,Matsukura M,et al.Genetic diversity and biochemical characteristics ofTrichosporon asahiiisolated from clinical specimens,houses of patients with summer-typehypersensitivity pneumonitis,and environmental materials[J].J Clin Microbiol,2001,39(7):2405-2411.
[12]Guo LN,Xiao M,Kong F,et al.Three-locus identification,genotyping,and antifungal susceptibilities of medically importantTrichosporonspecies from China[J].J Clin Microbiol,2011,49(11):3805-3811.
[13]Chagas-Neto TC,Chaves GM,Melo AS,et al.Bloodstream infections due toTrichosporonspp.: species distribution,Trichosporon asahiigenotypes determined on the basis of ribosomal DNA intergenic spacer 1 sequencing,and antifungal susceptibility testing[J].J Clin Microbiol,2009,47(4):1074-1081.
[14]Tokimatsu I,Karashima R,Yamagata E,et al.Pathogenesis ofTrichosporon asahiiand strategies for infectious control of disseminated trichosporonosis[J].Nihon Ishinkin Gakkai Zasshi,2003,44(3):181-186.

