韭菜等几种植物根系分泌物对棉花黄萎病菌的影响
姚 琴, 王美入, 杨家荣, 胡小平
(旱区作物逆境生物学国家重点实验室/西北农林科技大学植物保护学院,杨凌 712100)
由大丽轮枝菌(Verticillium dahliae Kleb.)引起的棉花黄萎病是一种土传植物维管束萎蔫病害,在世界范围内危害严重。自20世纪90年代以来,棉花黄萎病在我国呈现危害加重的趋势并造成了巨大的经济损失,目前已成为制约我国棉花(Gossypiumspp.)高产、稳产、优质的主要瓶颈[1-2]。
大丽轮枝菌的微菌核(microsclerotia,MS)能长期存在于棉花残体和土壤中,成为翌年侵染棉花的初侵染源,直接影响病害的发生和发展[3]。由于初侵染源存活时间长[4]、病原菌致病力多变以及棉花品种抗病性差等多种因素,棉花黄萎病的防治难度很大。在农业生产中多采用化学农药防治此病害,但因防治效果较差,且存在农药残留、抗药性和环境污染等问题,该类病害的防治急需寻找新的出路。利用植物根系分泌物的抑菌活性而采用的间作或轮作模式,是以植物为药源取代化学杀菌剂,简单易行、高效低廉的植物保护措施,成为防治病害的有效手段。近年来,植物根系分泌物在植物病害防治中的研究和应用日渐受到人们的关注。大量研究表明,某些植物根系分泌物对土传病害的病原菌具有明显的抑制作用,云南黑籽南瓜根系分泌物能抑制黄瓜枯萎病菌的生长[5],荞麦的根系分泌物对小麦全蚀病菌有明显抑制作用[6],不同抗性的黄瓜品种根系分泌物能抑制枯萎病病原菌的生长[7],不同抗性西瓜品种的根系分泌物对西瓜枯萎病菌有一定的抑制作用[8]。
关于寄主植物根系分泌物对大丽轮枝菌影响的研究已有报道。袁虹霞[9]、吴玉香等[10]研究发现抗病棉花品种的根系分泌物能抑制黄萎病菌的菌丝生长和孢子萌发,刘娜等[11]研究认为嫁接茄子根系分泌物能够抑制黄萎病菌生长。非寄主植物根系分泌物对棉花黄萎病菌的影响尚未见报道。韭菜(Allium tuberosum Rottl.ex Spreng)[12]、大 葱 (Allium fistulosumLinn.)[13]、薰衣草薄荷(Mentha piperita ‘Lavandula’)[14]、广 藿 香 [Pogostemon cablin(Blanco)Benth.][15]和薰衣草(Lavandulaspp.)[16]具有一定抑菌作用,且已有研究表明韭菜和大葱等葱属作物是瓜类蔬菜很好的轮作前茬[17],韭菜与香蕉轮作可以较大程度地减轻香蕉枯萎病的发生[18]。薄荷、藿香和薰衣草为芳香植物,其地上部分具有一定的抑菌作用,但其根系分泌物是否也具有抑菌效果尚无报道。为此,本试验利用水培法收集根系分泌物,探究其对大丽轮枝菌菌丝生长、孢子和微菌核萌发的影响,以期筛选出适宜与棉花间作或轮作的作物,为棉花黄萎病的防治提供依据。
1 材料与方法
1.1 供试材料
供试植物韭菜、大葱、野薄荷、薰衣草和藿香均购自西北农林科技大学园艺场。棉花黄萎病病原菌(Verticillium dahliae Kleb.)XJ2008菌株分离自新疆棉花植株,由西北农林科技大学植物保护学院土传病害实验室提供。
1.2 植物根系分泌物对大丽轮枝菌的抑制作用
1.2.1 植物根系分泌物的收集
收集采用自制水培系统,由塑料瓶、泡沫圆板和自动加氧泵构成。挖取在无病苗圃中培养2个月的健康均一植物幼苗,尽量不伤根,以蒸馏水洗根后移栽到水培系统中,用泡沫圆板固定。每瓶10株,共5瓶,向瓶中加入适量霍格兰营养液使根系没入其中,通气培养。每7d更换一次营养液,共4次,每次更换的营养液保存于4℃下备用。收集结束后称取植物根系鲜重,以确定母液浓度。将收集到的根系分泌液过滤除去杂质后,通过内装约500mL XAD-4吸附树脂的玻璃层析柱,控制流速为1~1.5L/h。再用3倍体积的甲醇洗脱,所得洗脱液在35℃下旋转蒸发至干,溶于5mL甲醇中,随后将其配成浓度为1.2g/mL(1g/mL为1mL水溶液中含有1g鲜根的根系分泌物)的母液并保存于4℃冰箱备用。
1.2.2 植物根系分泌物对大丽轮枝菌菌丝生长的抑制作用
采用菌丝生长速率法[19],配制不同浓度的植物根系分泌物稀释液,将4mL不同浓度提取液加入到16mL已融化并冷却至50℃的PDA培养基中,充分摇匀并迅速倒入直径为9cm的培养皿中,使根系分泌物最终浓度分别为0.1、0.2、0.4、0.6g/mL。以纯PDA培养基平板作为空白对照,每个处理重复3次。在平板中央接入直径为5mm的菌饼,置于25℃恒温培养箱中黑暗培养。待对照菌落生长至培养皿边缘(约20d)时,采用十字交叉法测定菌落直径,比较不同浓度根系分泌物对大丽轮枝菌菌丝生长抑制程度,并计算抑制率。

1.2.3 植物根系分泌物对大丽轮枝菌孢子萌发的抑制作用
在铺有湿润滤纸的培养皿中放入灭菌载玻片,分别吸取20μL新鲜的大丽轮枝菌菌液和不同浓度的植物根系分泌物稀释液滴于载玻片中央,配制成浓度为0.1、0.2、0.4、0.6g/mL的混合液。培养皿置于25℃培养箱中黑暗培养,分别于8、16、24h后在20倍物镜下观察孢子萌发情况,计算抑制率。每个处理重复3次,试验重复3次。

1.3 盆栽试验测定植物根系分泌物对大丽轮枝菌微菌核萌发的影响
1.3.1 大丽轮枝菌微菌核的产生与收集
微菌核的产生与收集方法参考白应文等[20]的方法。将收集到的微菌核在干燥器中干燥过夜。微菌核与适量滑石粉充分混合后放于15mL灭菌的离心管中,4℃ 保存备用。
1.3.2 植物残体对大丽轮枝菌微菌核萌发的影响
按照比例为1∶2混匀基质和田园土,所得土壤呈弱碱性(pH 7.2),有机质1.21%、全氮1.096%,有效氮52.6%、速效磷10.4μg/g、速效钾272.0μg/g、稳渗滤0.72mm/s。此后将土壤在121℃下湿热灭菌120min。挖取在无病苗圃中培养3个月的健康均一植株种植于花盆中,每盆10株,每种植物5盆,在阴凉环境中缓苗5d。
将获得的微菌核/滑石粉混合物再次混匀后,加入无菌蒸馏水配成悬浮液,超声震荡1min。镜检计数后配制成2000MS/mL的悬浮液。充分混匀后,取1mL注入无菌尼龙袋(2cm×3cm,孔径75μm)中。
植物经缓苗长势良好后,挖出盆中部分土壤。将装有微菌核的尼龙袋埋入植物根系聚集处,覆上无菌土后以无菌水浇灌使土壤含水量保持在25%左右。每盆埋入3袋微菌核,重复3次,对照为在无菌混合土壤中埋入微菌核。
分别在3、6、9周后取出尼龙袋,经浸泡洗去土壤和杂质后剪成小块,置于装有无菌水的离心管中,超声振荡1min。镜检计数,将微菌核浓度调节为100~200MS/mL,吸取0.5mL悬浮液涂布于果胶酸琼脂培养基[21]上,22~23℃培养箱中黑暗培养,试验重复3次。15d后,观察微菌核萌发情况并计算萌发率。
1.4 数据分析
试验数据采用SPSS 16.0for Windows统计软件包和 Microsoft Office Excel 2003进行统计分析。
2 结果与分析
2.1 植物根系分泌物对大丽轮枝菌菌丝生长的抑制作用
5种植物根系分泌物对大丽轮枝菌菌丝生长均有抑制作用,但存在差异:韭菜对大丽轮枝菌菌丝生长的抑制效果最好,其抑制率达到22.74%~87.92%,在浓度为0.2~0.6g/mL时,其抑制率均高于其余四者,在浓度为0.4g/mL,其抑制率显著高于其余四者;野薄荷次之,抑制率为24.49%~85.30%,在浓度为0.2g/mL和0.6g/mL时,与韭菜的抑制作用无显著差异,且高于其余3种植物;藿香的抑制效果最差,为17.86%~70.02%。随着浓度的升高,植物根系分泌物对大丽轮枝菌菌丝生长的抑制作用逐渐增强,其中韭菜的抑制率增长迅速,在浓度为0.4g/mL时,其抑制率从46.26%增加到77.86%,其余4种增长较为缓慢。在浓度达到0.6g/mL时,抑制率增长速度放缓,处理之间的差异也逐渐减小。
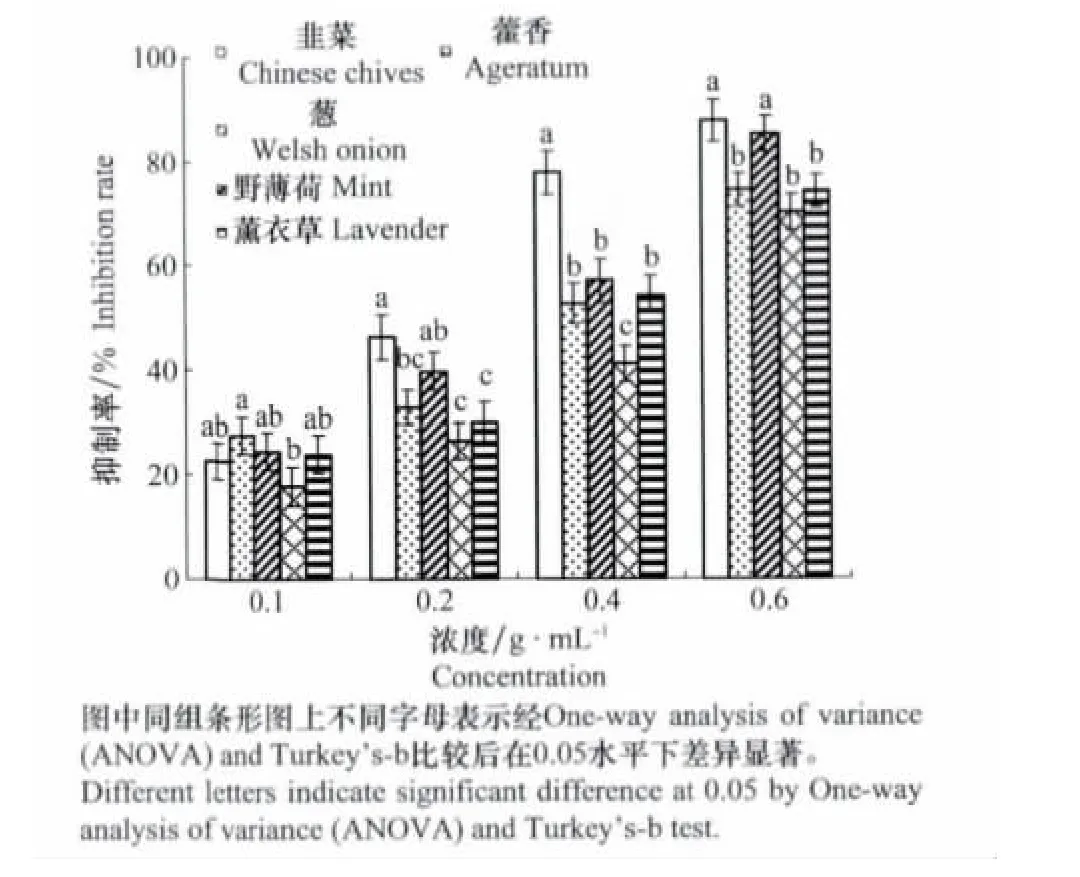
图1 植物根系分泌物对大丽轮枝菌菌丝生长的抑制作用Fig.1 Inhibitory effects of root exudates on mycelium growth of V.dahliae
通过对菌落形态的观察(图2),随着浓度增加,菌落直径明显减小且边缘呈现不规则,气生菌丝的生长受到明显抑制,在浓度为0.6g/mL时,菌落未能扩展。在浓度为0.4g/mL和0.6g/mL时,菌落中不同程度地出现了大丽轮枝菌的休眠结构微菌核。

图2 大丽轮枝菌在含不同浓度韭菜根系分泌物PDA平板上的菌落形态Fig.2 Colony morphology of V.dahliae on PDA with root exudates of Chinese chives at different concentrations
2.2 植物根系分泌物对大丽轮枝菌孢子萌发的抑制作用
5种植物根系分泌物均能抑制大丽轮枝菌孢子的萌发(表1)。随着浓度的升高,抑制作用逐渐增强,但增强的幅度有所不同:韭菜和藿香抑制率上升幅度较大,分别为22.66%~100.00%和6.57%~75.10%;大葱的上升幅度较小,为10.86%~56.57%。在同一浓度下,随着时间延长,根系分泌物对孢子萌发的抑制作用呈减弱趋势。大丽轮枝菌孢子对韭菜根系分泌物最为敏感,在浓度为0.1g/mL时抑制率已达22.66%,明显高于其他植物。韭菜根系分泌物在5种植物中抑制作用最强,在相同浓度相同处理时间,韭菜根系分泌物的抑制率均高于其他植物根系分泌物。总体来看,韭菜根系分泌物对大丽轮枝菌孢子的抑制作用最强,其次是野薄荷,薰衣草最弱。
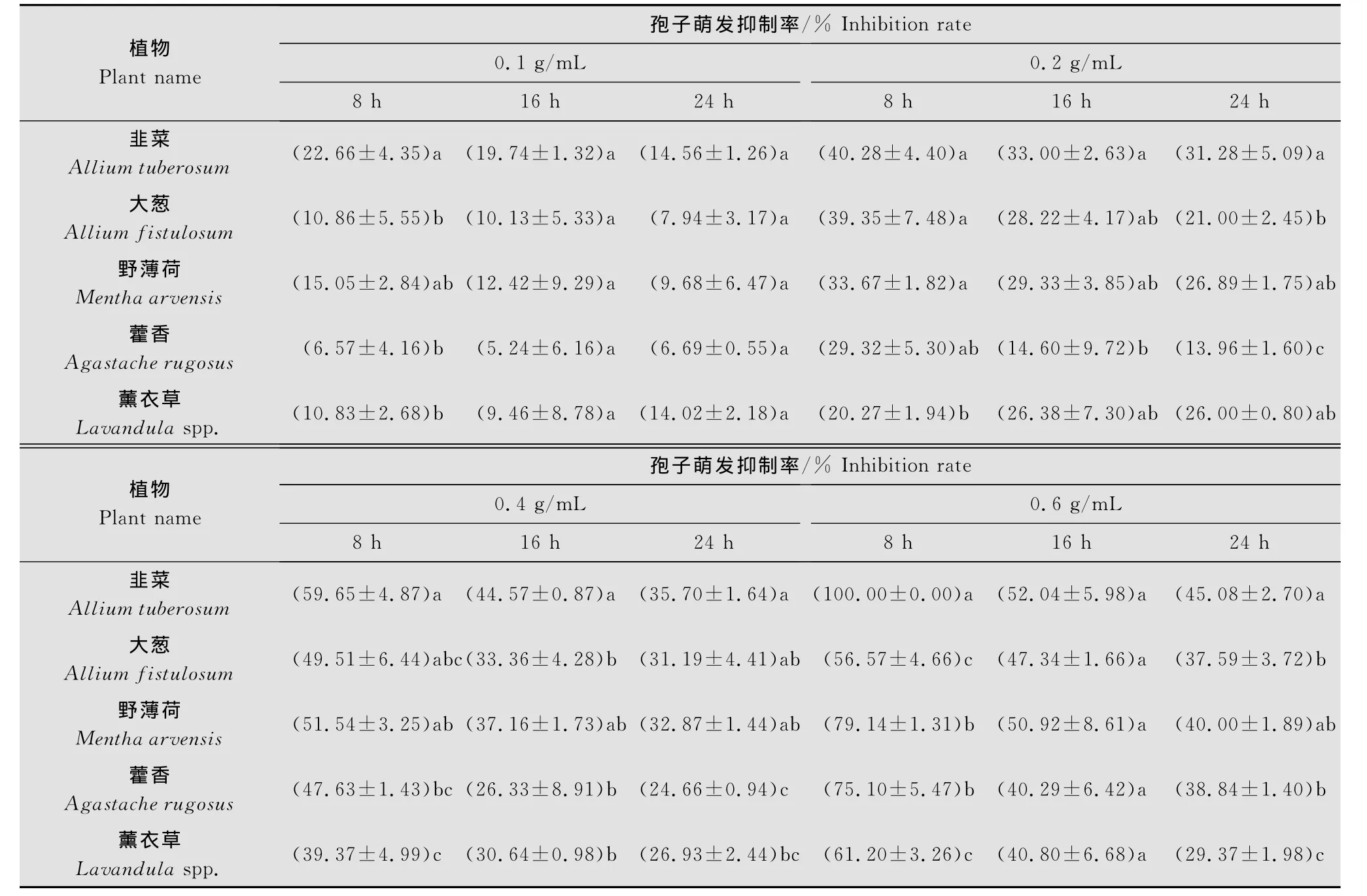
表1 植物根系分泌物对大丽轮枝菌孢子萌发的抑制作用1)Table 1 Inhibitory effects of the root exudates on spore germination of V.dahliae
2.3 根系分泌物对大丽轮枝菌微菌核萌发的影响
盆栽试验中,5种植物根系分泌物均能明显抑制大丽轮枝菌微菌核的萌发(表2)。随着处理时间的延长抑制作用增强,从第3周到第6周抑制率大幅度上升,其中大葱的抑制率从32.30%上升到62.94%,上升了30.64%,幅度最大;韭菜上升了17.05%,幅度最小;第6周到第9周上升趋势逐渐趋缓。韭菜对微菌核的抑制作用最强,在第3周和第6周抑制率分别为63.15%、80.20%,显著高于其他4种植物,在第9周时抑制率为87.58%,与野薄荷无明显差异,但显著高于其他3种植物。微菌核对韭菜根系分泌物最敏感,第3周时抑制率就已达到63.15%,显著高于其他植物。野薄荷对微菌核也有较好的抑制效果,在第3周、第6周和第9周时,其抑制率分别达到了49.03%、58.12%和78.13%;大葱的抑制作用稍弱,抑制率为32.30%~66.03%;抑制作用最弱的是藿香和薰衣草,其抑制率分别为25.21%~51.56%和29.60%~53.25%,两者无明显差异。
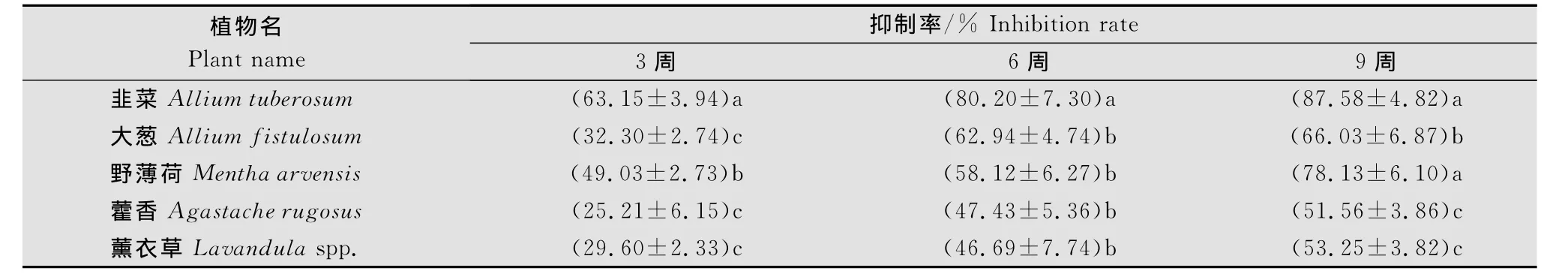
表2 植物根系分泌物对大丽轮枝菌微菌核萌发的抑制率1)Table 2 Inhibition of the germination of V.dahliae microsclerotia by root exudates
3 讨论
本试验中,5种植物根系分泌物对大丽轮枝菌的菌丝生长和孢子萌发均有抑制作用。随着浓度的升高,根系分泌物的抑制作用逐渐增强,这与大蒜[22]、分蘖洋葱[23]根系分泌物对枯萎病病原菌影响的研究结果一致。5种植物中,韭菜根系分泌物对大丽轮枝菌的抑制效果最好,其抑制率、敏感度都明显优于其他植物。野薄荷根系分泌物表现出良好的抑菌作用,仅次于韭菜。大葱也具有一定的抑菌效果。徐宁[24]等研究认为大葱根系分泌物对黄瓜枯萎病菌有很好的抑制作用,可见大葱根系分泌物可能存在一定的广谱性。薰衣草和藿香的根系分泌物抑菌作用较弱,这可能与其根系不发达有关。植物根系分泌物抑菌程度不同,可能与植物种类、品种、发育时期以及根系分泌物的收集方法等的差异有关[25],这些差异导致了所得根系分泌物的成分和浓度的不同。
微菌核作为大丽轮枝菌的休眠结构,其存活和消长与土壤温度、pH和有机质等多种因素有关[26]。López-Escudero[27]等证实熏衣草和百里香的植物残体能有效降低大丽轮枝菌微菌核的存活力。Heal[28]等的研究表明,微菌核与根系分泌物也有密切关系,当微菌核受到寄主根系分泌物的刺激后可萌发侵入根系,随即产生菌丝并定殖于木质部,最终导致维管束堵塞而引起植株局部或整体萎蔫。本试验研究结果显示非寄主植物的根系分泌物能不同程度地抑制微菌核萌发,其中韭菜和野薄荷的抑制作用最强,藿香最弱。抑制程度的不同可能与植物根系分泌物中能打破微菌核休眠的活性成分的组成和浓度有关。随着时间的延长,抑制作用增强且增加幅度由大到小,这可能是由于植物根系在定植后才能大量产生具有杀菌活性的次生物质的原因。非寄主植物根系分泌物抑制微菌核萌发的机理还有待进一步研究。
前人研究表明,植物根分泌物对土壤病原菌的抑制作用与根分泌物中具有抑菌作用的物质有直接关系。周宝利等[29]研究发现,嫁接茄子在受到黄萎菌胁迫时能分泌大量具有明显抑菌作用的丁二酸二甲酯;李勇等[30]证实人参根系分泌物成分苯甲酸、邻苯二甲酸二异丁酯等与人参部分致病菌的菌落生长和孢子萌发呈负相关;耿广东[31]等研究表明,辣椒根系分泌物中的邻二酸二甲酯具有抑菌作用。根系分泌物的抑菌活性与土壤中的生物和非生物因子有着密切关系,活性的高低在一定程度上还取决于土壤整个微生物群落的相互作用[32]。本研究中筛选出具有较好抑菌作用的韭菜和薄荷,其根系分泌物中的有效抑菌成分还需进一步研究,另外本试验仅限于室内,有待于在大田环境的土壤、土壤微生物及生态环境中进一步验证。
Jing[33]报道韭菜与番茄间作,韭菜根系分泌物抑制了由青枯菌(Pseudomonas solanacearum)侵染引起的番茄青枯病。Gómez-Rodríguez等[34]报道,在番茄和万寿菊间作系统中,万寿菊的根分泌物可以有效抑制番茄旱疫病病原菌(Alternaria solani)孢子的萌发,大大减轻番茄枯萎病的发生。本研究结果也证明植物根系分泌物能够抑制大丽轮枝菌菌丝、孢子和微菌核的活力。由此可见,利用非寄主植物与棉花间作或轮作防控黄萎病具有潜在的应用前景。
[1] 简桂良,卢美光,仇家山,等.棉花黄萎病防治策略[J].中国植保导刊,2004,24(4):30-31.
[2] 李凤瑞,史加亮,杨秀凤.棉花抗黄萎病研究进展及前景展望[J].山东农业科学,2009(9):57-59.
[3] 沈其益.棉花病害基础研究与防治[M].北京:科学出版社,1992:139-141.
[4] Garas N A,Wilhem S,Sagen J E.Relationship of cultivars resistance to distribution of Verticillium dahliae in inoculated cotton plants and to growth of single conidia on excised stem segments[J].Psychopathology,1986,76:1005-1010.
[5] 黄奔立,许云东,伍烨,等.两个不同抗性黄瓜品种和云南黑籽南瓜根系分泌物对黄瓜枯萎病发生的影响[J].应用生态学报,2007,18(3):559-563.
[6] 张庆平.荞麦根分泌物对小麦全蚀病菌的抑制及根际微生物种群数量观察[J].内蒙古农业科技,1994(1):8-9.
[7] 韩雪,潘凯,吴凤芝.不同抗性黄瓜品种根系分泌物对枯萎病病原菌的影响[J].中国蔬菜,2006(5):13-15.
[8] 田永强,张作刚,张正,等.根系分泌物对西瓜枯萎病菌的影响[J].山西农业大学学报(自然科学版),2008,28(4):436-438.
[9] 袁虹霞,李洪连,王烨,等.棉花不同抗性品种根系分泌物分析及其对黄萎病菌的影响[J].植物病理学报,2002,32(2):127-131.
[10]吴玉香,沈晓佳,房卫平,等.陆地棉根系分泌物对黄萎病菌生长发育的影响[J].棉花学报,2007,19(4):286-290.
[11]刘娜,周宝利,李轶修,等.茄子/番茄嫁接植株根系分泌物对茄子黄萎病菌的化感作用[J].园艺学报,2008,35(9):1297-1304.
[12]吴莉,陈文利.韭叶中化学成分的生物活性研究[J].化学与生物工程,2005(2):49-51.
[13]冯岩,杨静美,王晓容,等.韭菜和葱汁液对香蕉枯萎病菌的抑制作用[J].华中农业大学学报,2010,29(3):292-294。
[14]孔静思,陈季武,王帮正,等.三种芳香植物抑菌比较及GC/MS分析[J].食品工业科技,2011,32(11):152-156.
[15]莫小路,严振,王玉生,等.广藿香精油对植物病原真菌的抑制活性研究[J].中药材,2004,27(11):805-807.
[16]姜黎,王向未,江英.薰衣草精油抑菌作用的研究[J].农产品加工(学刊),2011,4(4):73-75.
[17]中国农业科学院蔬菜花卉研究所.中国蔬菜栽培学[M].北京:中国农业出版社,2010.
[18]黄永红.韭菜对香蕉枯萎病的防控效果及其作用机理的研究[D].长沙:湖南农业大学,2011.
[19]方中达.植病研究方法[M].第3版.北京:中国农业出版社,1998:152.
[20]白应文,胡东芳,胡小平,等.大丽轮枝孢微菌核的形成条件[J].菌物学报,2011,30(5):695-701.
[21]Dunne C P,Dell B,Hardy G E S.The effect of biofumigants on the vegetative growth of five Phytophthoraspecies in vitro[J].Acta Horticulturae,2003,602:45-51.
[22]周艳丽.大蒜根系分泌物的化感作用研究及化感物质鉴定[D].杨凌:西北农林科技大学,2007.
[23]杨阳.分蘖洋葱根系分泌物对黄瓜的化感作用及其应用[D].哈尔滨:东北农业大学,2010.
[24]徐宁,王超,魏珉,等.大葱根系分泌物对黄瓜种子萌芽和枯萎病病原菌的化感作用及其 GC-MS分析[J].园艺学报,2012,39(8):1511-1520.
[25]刘素萍,杨之为.根系分泌物[J].生态农业研究,1998,6(2):34-36.
[26]杨家荣,商鸿生,高立强.土壤环境因素对棉花黄萎病菌微菌核存活的影响[J].植物病理学报,2004,34(2):180-183.
[27]López-Escudero F J,Mwanza C,Blanco-López M A.Reduction of Verticillium dahliae microsclerotia viability in soil by dried plant residues[J].Crop Protection,2007,26:127-133.
[28]Heale J B,Karapapa V K.The Verticilliumthreat to Canada’s major oilseed crop:Canola[J].Canadian Journal of Plant Pathology[J].1999,21(1):1-7.
[29]周宝利,刘娜,叶雪凌,等.嫁接茄子根系分泌物变化及其对黄萎菌的影响[J].生态学报,2011,31(3):0749-0759.
[30]李勇,刘时轮,黄小芳,等.人参(Panax ginseng)根系分泌物成分对人参致病菌的化感效应[J].生态学报,2009,29(1):161-168.
[31]耿广东,张素勤,程智慧.辣椒根系分泌物的化感作用及其化感物质分析[J].园艺学报,2009,36(6):873-878.
[32]Kong C H,Xu X H,Zhang M,et al.Allelochemical tricin in rice hull and its aurone isomer against rice seedling rot disease[J].Pest Management Science,2010,66:1018-1024.
[33]Jing Q Y.Allelopathic suppression of Pseudomonas solanacearuminfection of tomato(Lycopersicon esculentum)in a tomato-Chinese chive (Allium tuberosum)intercropping system[J].Journal of Chemical Ecology,1999,25(11):2409-2417.
[34]Gómez-Rodríguez O,Zavaleta-Mejía E,González-Hernández V A,et al.Allelopathy and microclimatic modification of intercropping with marigold on tomato early blight disease development[J].Field Crops Research,2003,83:27-34.

