番茄品种浙粉702 DNA指纹图谱构建
阮美颖,叶青静,王荣青,姚祝平,周国治,万红建,杨悦俭
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.浙江省农业科学院 蔬菜研究所,浙江 杭州 310021)
番茄 (Solanum lycopersicumMill.)在蔬菜中占有举足轻重的地位,全国番茄年种植面积66.7万hm2,产值400亿元。但番茄业的发展受诸多不利因素的制约。目前,番茄黄化曲叶病毒病(TYLCVD)是制约番茄生产的不利因素之一,这种病害分布广泛,危害重,造成产量锐减。防治番茄黄化曲叶病毒病最为有效的途径是培育优良的抗病品种。
浙粉702为浙江省农业科学院新育成的抗番茄黄化曲叶病毒病的番茄品种,长势强,成熟果粉红色,商品性好,抗病性强,抗番茄黄化曲叶病毒病、叶霉病和枯萎病等,深受种植者青睐,推广应用面积不断增加,制种量也增加。但在制种过程中,常因机械混杂、去雄不彻底或者去雄不及时等原因,会发生种子混杂或者假杂种现象,种子纯度受影响。种子纯度的降低会明显降低品种的产量和品质,因此,种子纯度鉴定是浙粉702推广的重要保障。分子标记技术可快速鉴定番茄种子的纯度,1998年栾雨时等[1]利用 RAPD技术鉴定番茄种子纯度。本研究旨在利用CAPS和SSR分子标记技术构建番茄品种浙粉702及其亲本的DNA指纹图谱,探索适合室内使用的番茄杂种纯度快速鉴定方法。
1 材料与方法
1.1 材料
浙粉702、父本Z3及母本7969F2-19由浙江省农业科学院蔬菜研究所提供。TaqDNA聚合酶、dNTP、KpnI、XbaI、ScaI、Hin6I 及SmaI 为TAKARA公司产品,HindIII、TaqI和EcoRI为上海生物技术有限公司产品,HinfI、RsaI和Hpy188I为NEB公司产品,引物由上海生物技术有限公司合成。
1.2 基因组DNA快速提取
浙粉702、Z3及7969F2-19基因组总 DNA的提取参照周国治等[2]方法。
1.3 引物
从 http://solgenomics.net/获得 SSR、CAPS和RFLP标记,并对RFLP标记cLET-1-I13、cLEG-31-P16、T0693和TG590的核苷酸序列进行引物设计,引物序列并由上海生工生物工程技术服务有限公司合成。
1.4 PCR反应及电泳
PCR反应体系。20~80 ng DNA模板,上游引物与下 游引物各 0.25 μmmol· L-1,0.2 mmol·L-1dNTPs,2 mmol·L-1Mg2+,1 × 反应缓冲液,1UTaq酶,加水补足至总体积为20 μL。
PCR反应条件。94℃ 3 min;94℃ 50 s,53℃ 50 s,72℃ 50 s,循环 35次;72℃延伸10 min。
电泳检测。提取的番茄基因组DNA用1%的琼脂糖凝胶电泳进行检测。将SSR引物扩增的PCR产物10 μL与1 μL上样缓冲液混匀,经8%
CAPS酶切。TaqI限制性内切酶在65℃下酶切5 h,其他内切酶在37℃酶切5 h。酶切后的PCR产物经2.0%琼脂糖凝胶电泳检测其多态性。
1.5 DNA指纹图谱的构建与验证
对浙粉702、Z3及7969F2-19的基因组 DNA进行PCR扩增,筛选出互补差异条带,构建浙粉702的DNA指纹图谱。在浙粉702种子中混合Z3和7969F2-19的种子,定向验证浙粉702 DNA指纹图谱。在浙粉702种子中掺入浙杂203、浙砧204、浙粉209、浙粉208、浙杂301和809的种子,进行盲样检测和真伪验证。
1.6 浙粉702种子纯度鉴定
用建立的浙粉702DNA指纹图谱对来源不同地区、不同制种户及不同批次的浙粉702进行纯度鉴定,并与田间形态、抗性等鉴定结果进行比较。
2 结果与分析
2.1 番茄品种基因组DNA的提取
采用1.2%琼脂糖凝胶电泳检测DNA提取质量,结果 (图1)显示,采用CTAB法提取番茄试验样品 (父母本及杂交种)的DNA,为1条清晰完整的DNA带,没有降解,所提DNA质量较高。
2.2 SSR和CAPS标记的筛选
PCR反应体系中主要成分对扩增结果影响较大,因此,在筛选标记前,对PCR反应体系中模板浓度、引物浓度、TaqDNA聚合酶浓度、dNTP浓度、Mg2+离子浓度以及循环次数、退火温度等因素进行了研究,从而建立优化的番茄PCR扩增反应体系。

图1 采用CTAB法提取番茄样品的DNA电泳结果
通过来自 http://solgenomics.net/网站标记的筛选,经过多次重复和比较,最终确定带型清晰、稳定性好的13个SSR标记和17个CAPS标记作为鉴定浙粉702番茄品种的标记。多数SSR引物对样品扩增出2条以上的条带,片段的大小为50~500 bp(图2);多数 CAPS标记的 PCR产物经酶切后有2条以上的条带,片段的大小为50~2 000 bp(图 3)。在筛选引物的过程中,发现杂交种与双亲之间的带型有以下几种类型:杂交种与双亲带型相同;杂交种出现偏父本型条带;杂交种出现偏母本型条带;一亲本为强带,另一亲本无带,杂交种介于中间的所谓中间型双亲均为弱带而杂交种为强带的增强型;杂交种比双亲多条带少条带类型;杂交种与双亲有互补带型。这几种类型中,用于杂交种纯度鉴定最理想的带型是互补带型,这种带型能将杂交种与双亲明确区分开。筛选出的 SSR标记 SOL3194F3/R4、SOL3194F2/R2、TGS2216F4/R4、C2_At3g56230F/R、CAPS标记C2_ At3g56040F1/R4、 C2_ At3g56040F2/R3、cLEG-31-P16F3/R2、cLET-1-113F1/R1可以将浙粉702、父本Z3及母本7969F2-19完全区分开,父母本与杂交种具有互补带型 (图2)。
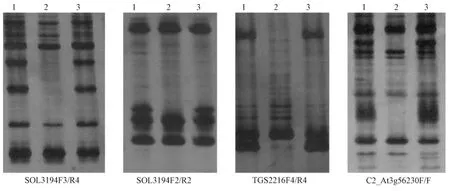
图2 番茄SSR标记的筛选结果

图3 番茄CAPS标记的筛选结果
2.3 定向实验检测种子纯度
在浙粉702种子中掺入亲本种子进行盲样检测,结果 (图4)与实际情况相符,4和7是父本,12是母本,1,2,3,5,6,8,9,10,11是浙粉702,表明建立的指纹图谱能有效检测出亲本。
2.4 种子真伪鉴定

图4 利用引物TGS2216F4/R4和C2_At3g56040F1/R4鉴定浙粉702及其亲本

图5 用TGS2216F4/R4和C2_At3g56040F1/R4鉴定浙粉702种子的真伪
用构建的指纹图谱对浙粉702番茄品种进行种子真伪鉴定,结果 (图5)表明,用TGS2216F4/R4和C2_At3g56040F1/R4构建的浙粉702的指纹图谱能较好的区分浙粉702和其他番茄品种。1,2,3,7,8,10是浙粉 702,4是浙杂 203,5是浙砧204,6是浙粉209,9是浙粉208,11是浙杂301,12是809。
2.5 浙粉702种子纯度鉴定
用构建的浙粉702指纹图谱鉴定不同制种户的浙粉702生产种。抽取2批,每批随机检测100个杂交种。第1批检测出2个混杂的种子,种子纯度为99%,第2批种子纯度为100%,表明浙粉702生产种达到了国家规定标准。
3 小结和讨论
长期以来,种子生产者、经营者、使用者和管理者期盼着对品种真实性和纯度鉴定有快速、准确、经济实用的室内检测方法。随着DNA指纹技术的迅速发展,为快速、简便、准确鉴定品种真实性和纯度提供了技术支撑。在多种分子标记技术中,RAPD-PCR技术由于费用低、分析快、操作简便等优点,适合构建特定品种的指纹图谱,现已广泛应用于小麦[3]、大麦[4]、玉米[5]及水稻[6]等作物种子纯度鉴定。但是RAPD-PCR的多态性不太高,并且稳定性和重复性较差,而CAPS和SSR技术,呈共显性遗传,易于分析,稳定性和重复性较好,具有信息含量高等特点,适合杂交种品种纯度的鉴定。
由于国内用于番茄育种的亲本材料遗传变异幅度小,所以很多国内的番茄品种不易找到多态性的差异。筛选出能够区分双亲和杂交种的CAPS和SSR引物是很重要的。目前,开展番茄品种纯度鉴定工作,首先要利用好现有的番茄CAPS和SSR标记,再自主开发更多的CAPS和SSR标记。
本研究以浙粉702、父本Z3及母本7969F2-19为试验材料,筛选出了能够区分浙粉702、Z3及7969F2-19的CAPS和SSR标记,建立了适合于检测番茄种子纯度的反应体系,从而为CAPS和SSR技术在番茄种子纯度鉴定中的应用和推广打下了坚实的基础。
[1]栾雨时,苏乔,李海涛,等.利用RAPD技术快速鉴定番茄杂种纯度 [J].园艺学报,1998,25(3):247-251.
[2]Williamson VM,Ho J Y,Wu F F,et al.A PCR-based marker tightly linked to the nematode resistance gene,Mi,in tomato[J].Theoretical and Applied Genetics,1994,87:757-763.
[3]向太和,汪秀峰,李莉,等.利用RAPD标记对我国主栽的籼优杂交稻和其亲本进行区别和鉴定 [J].作物学报,2000,26(3):292-296.
[4]雷开荣,林清,郝风,等.鲜食玉米渝糯7号DNA指纹图谱建立及应用研究 [J].玉米科学,2006,14(1):43-45.
[5]McDonald M B,Elliot L J,Sweeney P M.DNA extraction form dry seeds for RAPD analysis in varietal identification studies[J].Seed Science and Technology,1994,22:171-176.
[6]Tinker N A,Fortin M G,Mather D E.Random amplified polymorphic DNA and pedigree relationship in spring barley[J].Theor AppI Genet,1993,85:976 -984.

