低分化型黏膜内胃癌淋巴结转移的危险因素与腹腔镜手术探讨*
吴殿超 刘丽芳 霍志斌 李 华 肖琦海 穆炳阁 郭淑敬
低分化型黏膜内胃癌淋巴结转移的危险因素与腹腔镜手术探讨*
吴殿超①刘丽芳②霍志斌①李 华①肖琦海①穆炳阁①郭淑敬①
目的:探讨低分化型黏膜内胃癌淋巴结转移的危险因素,从而对低分化型黏膜内胃癌患者,制定合理腹腔镜术式提供理论依据。方法:回顾性分析60例低分化型黏膜内胃癌的临床病理资料,按照临床病理特征与淋巴结转移的关系进行统计学分析。结果:通过多因素分析,多发肿瘤,肿瘤大小≥2 cm和淋巴管癌栓阳性对淋巴结转移差异具有统计学意义(P<0.05)。无危险因素的患者,淋巴结转移率为0;三个危险因素均有者,淋巴结转移率高达66.7%。结论:多发肿瘤,肿瘤大小≥2 cm和淋巴管癌栓阳性是低分化型分化型黏膜内胃癌淋巴结转移的独立危险因素。对于无危险因素的患者,行腹腔镜下胃局部切除术是可行的;对于具有危险因素的患者,可以实施腹腔镜下胃癌根治术治疗。
早期胃癌 淋巴结转移 临床病理特征 腹腔镜
1994年日本Kitano等[1]首次报告了早期胃癌腹腔镜下根治性远端胃大部切除术。由于腹腔镜下根治性胃切除术不仅可以做到对原发病灶的完全切除,还可以进行适当范围的淋巴结清扫,因此,在早期胃癌的根治性治疗中逐渐得到广泛应用。然而,对于行根治手术96.6%低分化的黏膜内胃癌患者,淋巴结是不存在转移的[2]。对于这部分患者,行腹腔镜下胃癌根治术是治疗过度的。
本院肿瘤外科于1989年3月至2005年5月共收治并施行手术治疗低分化型黏膜内胃癌患者60例。本文回顾性分析60例患者的临床病理特点与淋巴结转移的关系,从而对低分化型黏膜内胃癌患者,制定合理腹腔镜术式提供理论依据。
1 材料与方法
1.1 一般资料
本组患者男45例,女15例;年龄28~79岁,平均年龄47岁。全部病例均D1以上的根治术式;全部病例均经手术、病理组织学证实。
1.2 手术方式
60例病例中,37例行D1手术(D1手术指清扫区域淋巴结至第1站),23例行D2手术(D2手术指清除扫区域淋巴结至第2站)。
1.3 临床病理因素
探讨不同的临床病理特征与淋巴结是否存在转移之间的联系。临床因素包括:性别、年龄、家族史、肿瘤数目、肿瘤位置、肿瘤大小。病理因素:组织学类型及淋巴管癌栓。组织学分型、大体分型、淋巴结分组参照日本胃癌处理规约[3]。
1.4 统计学方法
所有数据用SPSS 15.0统计学软件进行分析。单因素分析采用χ2检验。多因素分析采用Logistic回归,生存分析采用Kaplan-Merier法。P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征与淋巴结转移的关系
通过单因素分析,多发肿瘤(P<0.001),肿瘤大小≥2 cm(P=0.031)和淋巴管癌栓阳性(P=0.002)对淋巴结转移差异有统计学意义(表1)。其他因素:性别、年龄、家族史、肿瘤位置、组织学类型对淋巴结转移差异无统计学意义(P>0.05)。
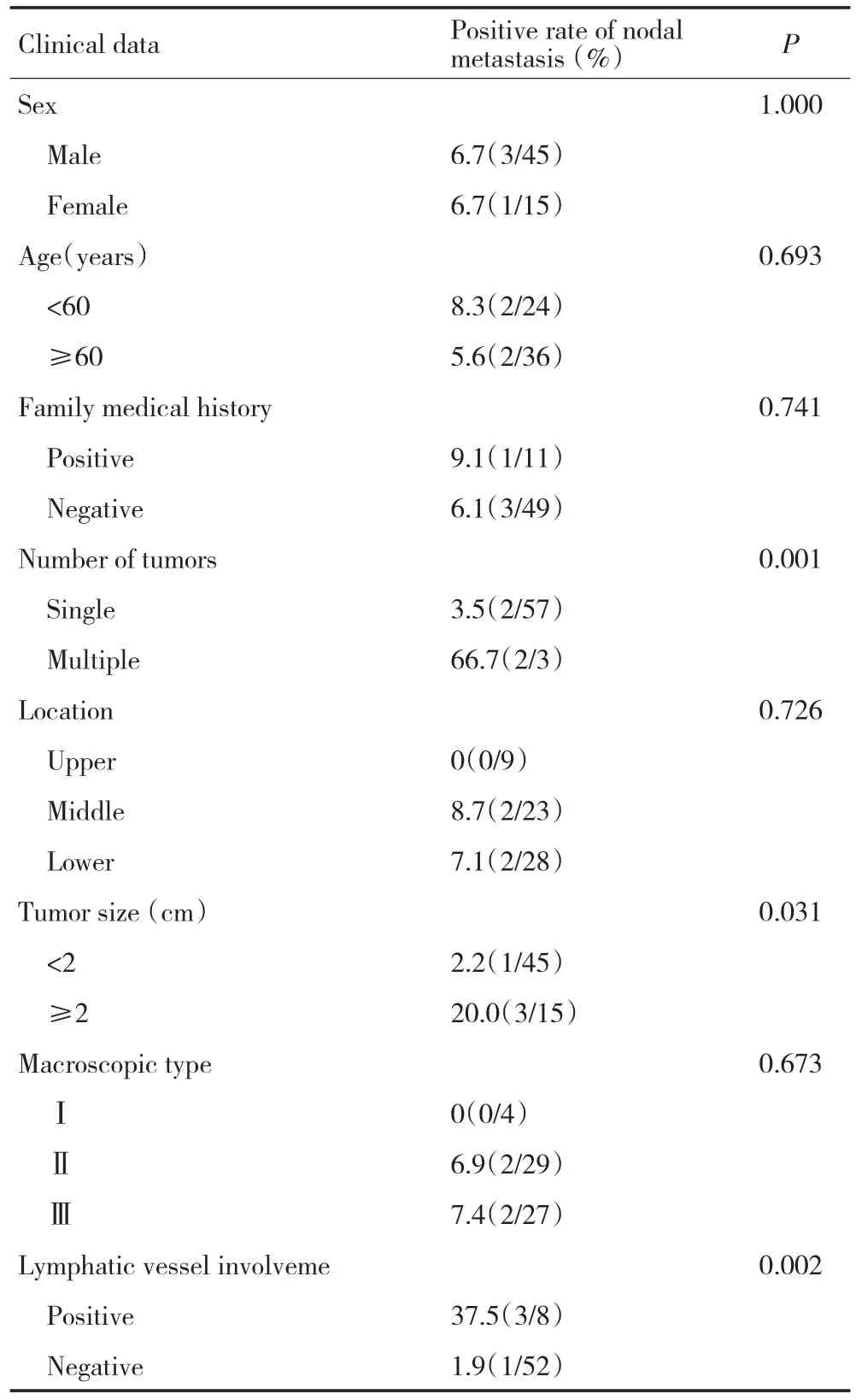
表1 单变量分析淋巴结转移的影响因素 (%,例)Table 1 Univariate analysis of potential risk factors for lymph node metastasis
2.2 多因素分析淋巴结转移独立危险因素
通过多因素分析,多发肿瘤(OR=118.115,P=0.019),肿瘤大小≥2 cm(OR=2.554,P=0.039)和淋巴管癌栓阳性(OR=152.169,P=0.028)是淋巴结转移独立的危险因素(表2)。

表2 多变量分析淋巴结转移的影响因素Table 2 Multivariate analysis of potential risk factors for lymph node metastasis
2.3 危险因素的数目与淋巴结转移的关系
本组患者6.7%(4/60)发生淋巴结转移。无危险因素(多发肿瘤,肿瘤大小≥2 cm和淋巴管癌栓阳性)的患者,发生淋巴结转移的比例为0(0/45);具有一个危险因素者,发生淋巴结转移的比例为12.5%(1/8);两个危险因素具有者,发生淋巴结转移的比例高达25.0%(1/4);三个危险因素均有者,发生淋巴结转移的比例高达66.7%(2/3)(表3)。

表3 危险因素数目与淋巴结转移率关系Table 3 Relationship between the number of risk factors and lymph node metastasis
2.4 手术方式与预后分析
本组资料随访率为88.3%(53/60),D1手术组的5年生存率为90.6%(29/32),D2手术组的5年生存率为90.5%(19/21)。两组经Kaplan-Merier法分析,D1、D2手术组之间差异无统计学意义(P<0.05,图1)。
3 讨论
1994年Kitano等[1]报道了首例腹腔镜辅助远端胃切除术(LADG)后,早期胃癌的腹腔镜根治术在日本和韩国得到了快速发展,越来越多的早期胃癌患者接受腹腔镜下根治性手术。腹腔镜下胃癌手术种类也日趋多样,几乎覆盖了常见的传统手术方式。如何在不影响患者生存率的前提下,采用微创技术,使胃癌患者既能安全和有效地进行手术治疗,又能最终减轻创伤、改善生存质量,是目前国内外该领域研究的一大热点[4-7]。腹腔镜下胃局部切除术治疗早期胃癌的适应症是癌肿仅浸润黏膜层、非溃疡浸润型、无淋巴结转移、估计内镜下黏膜切除(EMR)有困难者、隆起型病变直径<25 mm或凹陷型病变直径<15 mm。日本胃癌协会建议局部切除手术适应症是直径<2 cm的高分化黏膜癌[1]。目前对于腹腔镜下胃局部切除术应用于低分化型黏膜内胃癌的相关研究甚少。

图1 D1、D2手术生存率比较Figure 1 Comparison of survival rates between patients treated with D1 and D2 operation
淋巴结转移是低分化型黏膜内胃癌选择腹腔镜下胃局部切除术最重要因素。目前,许多学者开始研究早期胃癌淋巴结转移的危险因素。并认为癌的肿瘤大小、淋巴管癌栓,大体和组织学分型是淋巴结发生转移的危险因素[8-13]。本组研究结果认为多发肿瘤,肿瘤大小≥2 cm和淋巴管癌栓阳性是低分化型黏膜内胃癌淋巴结转移的独立危险因素。
本组对影响淋巴结转移危险因素的数目与淋巴结转移的关系进行研究分析显示:本组无危险因素患者,淋巴结转移率为0,这提示腹腔镜下局部切除术治疗对于此类患者是适合的,因此不需要加行根治术式。但是对于淋巴结转移危险因素具有者,淋巴结转移率为12.5%~66.7%,这也提示行腹腔镜下根治性胃切除术后淋巴结转移也是不可避免的。
对于恶性肿瘤手术,人们最关心的首先是安全性与根治性,其次才是微创性,所以必须在保证安全及远期疗效的前提下,追求手术微创化,提高患者的近期疗效。传统胃癌根治术无论从手术指征、手术方式及淋巴结清扫范围等都已建立了规范,而微创手术仅有遵循已有传统的开腹胃癌根治术的原则,并根据腹腔镜视野下的解剖特点进行根治性操作,才可确保其远期疗效等同于传统手术。因此如何在手术中严格遵循肿瘤根治原则,使腹腔镜手术达到肿瘤根治效果,是人们关注的焦点,更是腹腔镜早期胃癌手术的核心问题之一。因此,低分化型黏膜内胃癌的腹腔镜治疗必须遵循与传统开腹手术相同的肿瘤根治原则:1)强调肿瘤及周围组织的规范切除;2)足够的切缘;3)彻底的淋巴清扫;4)肿瘤操作的非接触原则。
早期胃癌的腹腔镜手术治疗后恢复快,生存质量佳,近期疗效好,在日本和韩国早期胃癌患者采取腹腔镜手术治疗的比例迅速增长,长期随访结果显示,早期胃癌腹腔镜下根治性胃切除术与开腹手术的远期疗效相当[14]。目前关于早期胃癌腹腔镜下胃局部切除术后生存率及胃癌复发率报道较少。Ohgami等[15]于1999年报道了61例早期胃癌腹腔镜下胃局部切除术,其中2例术后局部复发,1例淋巴结浸润,1例术后转移行开腹胃癌根治术,随访4~65个月无患者死亡。日本全国内镜手术调查显示:腹腔镜下胃局部切除术术中及术后并发症发生率分别为2.9%和5%,最常见的并发症有胃排空障碍(1.9%)及出血(1.8%),总的手术中转率为1.3%,因此被认为是治疗早期胃癌安全有效的手术方式[14]。本组资料D1、D2手术组之间5年生存率差异无统计学意义(P<0.05),提示黏膜内胃癌患者可以不必实施D2根治术而同样取得较好的预后效果。
综上所述,多发肿瘤,肿瘤大小≥2 cm和淋巴管癌栓阳性是低分化型黏膜内胃癌淋巴结转移的独立危险因素。对于无危险因素的患者,行腹腔镜下胃局部切除术是可行的;对于具有危险因素的患者,可以实施腹腔镜下胃癌根治术治疗。
1 Kitano S,Iso Y,Moriyama M,et al.Laparoscopy-assisted Billroth I gastrectomy[J].Surg Laparosc Endosc,1994,4(2):146-148.
2 Park YD,Chung YJ,Chung HY,et al.Factors related to lymph node metastasis and the feasibility of endoscopic mucosal resection for treating poorly differentiated adenocarcinoma of the stomach[J].Endoscopy,2008,40(2):7-10.
3 Japanese Gastric Cancer Association:Japanese classification of gastric carcinoma.2nd English edition[J].Gastric Cancer,1998,1(1):10-24.
4 Koeda K,Nishizuka S,Wakabayashi G.Minimally invasive surgery for gastric cancer:the future standard of care[J].World J Surg,2011,35(7):1469-1477.
5 Zeng YK,Yang ZL,Peng JS,et al.Laparoscopy-assisted versus open distal gastrectomy for early gastric cancer:evidence from randomized and nonrandomized clinical trials[J].Ann Surg,2012,256(1):39-52.6 Pavlidis TE,Pavlidis ET,Sakantamis AK.The role of laparoscopic surgery in gastric cancer[J].J Minim Access Surg,2012,8(2):35-38.
7 Nozaki I,Kubo Y,Kurita A,et al.Long-term outcome after laparoscopic wedge resection for early gastric cancer[J].Surg Endosc,2008,22(12):2665-2669.
8 Lee SW,Nomura E,Bouras G,et al.Long-term oncologic outcomes from laparoscopic gastrectomy for gastric cancer:a single-center experience of 601 consecutive resections[J].J Am Coll Surg,2010,211(1):33-40
9 Goh PM,Khan AZ,So JB,et al.Early experience with laparoscopic radical gastrectomy for advanced gastric cancer[J].Surg Laparosc Endosc Percutan Tech,2001,11(2):83-87.
10 Kim DY,Joo JK,Ryu SY,et al.Factors related to lymph node metastasis and surgical strategy used to treat early gastric carcinoma[J].World J Gastroenterol,2004,10(5):737-740.
11 Ludwig K,Klautke G,Bernhard J,et al.Minimally invasive and local treatment for mucosal early gastric cancer[J].Surg Endosc,2005,19(10):1362-1366.
12 Abe N,Watanabe T,Suzuki K,et al.Risk factors predictive of lymph node metastasis in depressed early gastric cancer[J].Am J Surg,2002,183(2):168-172.
13 Ichikura T,Uefuji K,Tomimatsu S,et al.Surgical strategy for patients with gastric carcinoma with submucosal invasion.A multivariate analysis[J].Cancer,1995,76(6):935-940.
14 Kitano S,Yasuda K,ShiraishiN.Laparoscop ic surgical resection for early gastric cancer[J].European J Gastr Hepa,2006,18(8):855-861.
15 Ohgami M,Otani Y,Kumai K,et al.Curative Laparoscop ic surgery for early gastric cancer:five years experience[J].World J Surg,1999,23(2):187-193.
(2012-11-15收稿)
(2012-12-21修回)
Risk factors for lymph node metastasis in intramucosal poorly differentiated gastric cancer and reasonable laparoscopic surgery
Dianchao WU1,Lifang LIU2,Zhibin HUO1,Hua LI1,Qihai XIAO1,Bingge MU1,Shujing GUO1
Dianchao WU;E-mail:wdch1022@163.com
1The Second Department of Surgical Oncology and2Department of First-aid Center,Xingtai People Hospital Affiliated to Hebei Medial University,Xingtai 054001,China
Objective:This study aimed to investigate the clinicopathological factors predictive of lymph node metastasis(LNM)in intramucosal poorly differentiated early gastric cancer(EGC),and to expand the possibility of laparoscopic surgery for treating poorly differentiated EGC.Methods:Data of 60 patients with intramucosal poorly differentiated EGC and surgically treated in our hospital were collected.The association between the LNM and clinicopathological factors was retrospectively analyzed using univariate and multivariate logistic regression analyses.Results:Univariate analysis showed that the tumor size,number of tumors,and lymphatic vessel involvement(LVI)were the significant and independent risk factors for LNM.The LNM rate was 66.7%in patients with the three risk factors.LNM was not found in patients without the three clinicopathological risk factors.Conclusion:The tumor size,number of the tumors,and LVI were independently associated with the presence of LNM in intramucosal poorly differentiated EGC.Laparoscopic wedge resection can be sufficient to treat patients without the risk factors.Gastrectomy with lymphadenectomy is inevitable for patients with the risk factors.
early gastric cancer,lymph node metastasis,clinicopathologic characteristics,laparoscopic surgery
10.3969/j.issn.1000-8179.2013.010
①河北医科大学附属邢台人民医院肿瘤外二科(河北省邢台市054001);②河北医科大学附属邢台人民医院急救部
*本文课题受邢台市科学基金(编号:20102025-2)资助
吴殿超 wdch1022@163.com
This work was supported by the Scientific Foundation of Xingtai City(Grant No.20102025-2)
(本文编辑:贾树明)

