西藏飞蝗虫粪粗提物的成分分析及其活性测定
王海建,李彝利,李 庆,*,杨 刚,匡健康,蒋春先,杨群芳
(1.四川农业大学农学院,成都 611130;2.四川甘孜州农业局,康定 626000)
西藏飞蝗Locusta migratoria tibetensis(Chen)是青藏高原独有的飞蝗亚种,分布在我国青海省南部、川西高原和西藏自治区,主要危害青稞、玉米、小麦等禾本科作物及牧草等。它与东亚飞蝗Locusta migratoria manilensis(Meyen)、亚洲飞蝗Locusta migratoria migratoria(Linnaeus)一起被称为我国的“三大飞蝗”[1]。近年来西藏飞蝗在西藏、川西高原和青海玉树等地发生危害十分严重,且有蔓延的趋势,给当地的农牧业带来了严重的经济损失[2]。自1963年陈永林订立西藏飞蝗亚种以来[3],我国对西藏飞蝗的研究主要集中在形态描述、生物学和生态学特性等方面[4-8]。如李庆等对西藏飞蝗生活史、抗寒性、产卵习性以及西藏飞蝗对温度和紫外辐射的适应机制进行了研究[4-7],杨群芳等对西藏飞蝗的食性进行了研究[8]。
由于西藏飞蝗主要滋生于偏远民族地区,从高原藏族宗教文化和环境保护等方面考虑,单靠化学方法来防治西藏飞蝗可行性低,需要从生态治理等方面着手。利用信息化合物监测和防治广泛分布的蝗虫,是可持续蝗灾治理的新理念[9-11]。西藏飞蝗危害严重的主要原因之一在于其群集性。昆虫聚集信息素是由昆虫产生,并且能够引起同种昆虫产生聚集行为反应的化学物质,在昆虫群集中起着重要作用[12]。关于蝗虫聚集信息素的研究报道多见于非洲飞蝗Locusta migratoria migratorioides(Reiche&Fairmaire)[13]、沙漠蝗(Schistocerca gregaria(Forskål))[13-14]和东亚飞蝗[15]。现已证明聚集信息素对于蝗虫的型变、群集起到主要的调节和控制作用。蝗虫聚集信息素可存在于粪便、卵囊、虫体及泡沫等部位[16-22]。不同种类蝗虫聚集信息素组分和含量存在差异,同种蝗虫不同发育阶段、不同性别之间也存在差异。Torto等人证实沙漠蝗聚集信息素表现出明显的阶段性差异和性别差异,其体表分泌2种不同聚集信息素:一类由蝗蝻释放只对蝗蝻作用,另一类由成蝗释放且只对成蝗作用,且两类信息素的成分不尽相同[18-19]。Njagi等研究表明散居型沙漠蝗聚集信息素中缺少群居型主要的苯乙腈,并且群居型雄成虫聚集信息素在维持种群聚集及使散居型向群居型转变过程中起着重要作用[20]。石旺鹏等[23-24]和郭志永等[25]研究表明东亚飞蝗聚集信息素主要存在于粪便中,其5龄蝗蝻与成虫之间、雌雄成虫之间的粪便挥发物化学组分基本相似,但是各成分的组成比例存在差异,而且包含多种电生理活性物质。Yu等[26]利用气相色谱技术证实东亚飞蝗成虫粪便挥发物中含有30多种化合物,并通过质谱分析结果和保留时间鉴定出9种能够激起雄成虫触角电位反应的化合物。关于西藏飞蝗聚集信息素的研究国内外未见相关报道。本文采用自制Y型嗅觉仪、气质联用(GC-MS)和触角电位反应(EAG)等方法对西藏飞蝗虫粪粗提物进行了活性测定和成分分析,以期为进一步研究西藏飞蝗聚集机制及利用聚集信息素对西藏飞蝗进行生态治理提供基础。
1 材料与方法
1.1 试验材料
从四川甘孜州理塘县采回西藏飞蝗低龄蝗蝻(群居型颜色为黑褐色至黑色,散居型为草绿色),在实验室用新鲜玉米叶(雅玉二号)饲养成生长情况一致的群居型和散居型蝗虫供试。饲养条件为温度(25±1)℃,相对湿度为60%—70%,光周期为12/12(L/D)。为了避免西藏飞蝗发生型变,将群居型和散居型蝗蝻分别放在不同房间的人工气候箱中以25头/笼和1头/笼进行隔离饲养,以获得群居型和散居型蝗虫。同时,每天收集蝗虫粪便,直到成虫20d。将每天收集到的粪便清除干净杂质并用铝箔纸包好,放入-20℃冰箱。供试前将每一龄期粪便5g/包混在一起。文中低龄蝗蝻指1—2龄蝗蝻,高龄蝗蝻指3—5龄蝗蝻。
1.2 试验方法
1.2.1 西藏飞蝗虫粪粗提物的制备
溶剂直接浸提法取充分研磨的西藏飞蝗粪便5g置于100mL锥形瓶,加入50mL乙醇充分振荡,1h后过滤得粗提物,将粗提物置于冰浴中经N2浓缩后,置于-20℃冰箱保存待测。丙酮和二氯甲烷提取采用乙醇相同的方法,正己烷浸提需在65℃水浴中加热。
超声波提取法取充分研磨的西藏飞蝗粪便5g置于100mL锥形瓶,加入50mL乙醇,用超声波细胞粉碎机处理1h后,过滤得粗提物,将粗提物置于冰浴中经N2浓缩后,置于-20℃冰箱保存待测。
1.2.2 西藏飞蝗对其虫粪粗提物的行为反应
采用自制Y型嗅觉仪进行行为反应测定。Y型嗅觉仪主管长50cm,两侧臂分别长30cm,内径7cm,两臂夹角为75°,Y型嗅觉仪两侧臂分别通过Teflon管与样品室连接,一个样品室内放入充分浸润西藏飞蝗虫粪粗提物的脱脂棉球,另一个样品室中放入充分浸润同体积提取溶剂的脱脂棉球作对照;采用大气采集仪抽气,使每侧臂气流速度均控制在250mL/min。从Y型嗅觉仪主管末端接入西藏飞蝗试虫1头,每次观察3min。如果试虫释放后在某一侧臂的前臂(即侧臂与气味源连接处的1/2处)活动时间持续超过1min,就记为试虫对该侧臂所连接的气源有趋向性;如果试虫释放后,在整个3min观察时间内,在任一侧臂的前臂均未持续活动超过1min,就记为该试虫在整个试验中对气源无趋向性。
行为反应测定在温度(25±1)℃的室内进行。每处理试虫10头,重复3次。每测试2头试虫时调换一下Y型管两侧臂的方向,以消除几何位置对试虫行为可能产生的影响。每处理测试完后,用75%的酒精清洗嗅觉仪,吹风机吹干,静置30min后再测定。
1.2.3 西藏飞蝗虫粪粗提物成分分析
利用气相色谱-质谱联用仪分析西藏飞蝗不同类型、性别、龄期粪便粗提物的成分。气相色谱条件:HP-5MS石英毛细管柱(30cm×0.25mm×25μm),无分流进样;载气:氦气(He);压力:20kPa。具体的升温程序:初始温度为60℃,保留3min;然后以4℃/min升温至80℃,保留3min;再以20℃/min升温至180℃,保留1min;最后以4℃/min升温至220℃,保留5min。进样口温度为250℃,GC-MS接口温度为270℃,进样量2μL。质谱条件:EI离子源,离子源温度150℃,四极杆温度230℃,电离能为70 eV,扫描范围(m/z)35—550amu,载气流速:1mL/min。用WILEY软件进行数据采集和分析,2min后开始采集数据,所得质谱图直接与WILEY数据库检出的标准图谱进行对照,并通过查阅相关资料以确定其化学组分。
1.2.4 西藏飞蝗对人工合成化合物触角电位反应
试验时将西藏飞蝗触角沿基部切下,并将触角顶部切下2—3mm,然后将基部置于参考电极,端部置于记录电极上。取一定量的化合物滴于2cm×0.5cm的滤纸片上,并置于1000μL移液枪头中。设定纯化空气流速为100mL/min,样品刺激时间为300ms,两次刺激间的时间间隔为2min。试验所用触角电位仪由荷兰Syntech公司生产,测定所需软件也由该公司提供。
每处理测试触角5根,每根刺激5次。为消除触角适应所导致的偏差,测试前后均使用乙醇做空白对照,将每一样品测定值的平均数除以前后2次对照测定值的平均值即得EAG净反应值。
1.2.4 数据处理
应用SPSS17.0数据处理系统对数据进行方差分析和Duncan氏新复极差测验。
2 结果与分析
2.1 西藏飞蝗虫粪粗提物提取方法比较
西藏飞蝗散居型和群居型4龄蝗蝻对不同方法提取的虫粪粗提物的趋向率存在差异(图1,图2)。除群居型4龄蝗蝻对群居型高龄蝗蝻虫粪粗提物外,散居型和群居型4龄蝗蝻对不同来源虫粪粗提物的趋向率均表现为乙醇浸提法>丙酮浸提法>二氯甲烷浸提法>正己烷浸提法>乙醇超声波提取法。乙醇浸提法提取的虫粪粗提物活性显著高于正己烷浸提法和乙醇超声波提取法。群居型4龄蝗蝻对群居型高龄蝗蝻乙醇超声波提取法的虫粪粗提物趋向率略高于正己烷浸提法,但两者之间无显著差异。因此,在五种方法中乙醇浸提法是提取西藏飞蝗虫粪粗提物的最佳方法,后续试验中虫粪粗提物均用该方法得到。

图1 西藏飞蝗散居型4龄蝗蝻对不同虫粪粗提物的趋向率Fig.1 The taxis ratio of solitary 4th instars L.migratoria tibitensis Chen to different fecal extract

图2 西藏飞蝗群居型4龄蝗蝻对不同虫粪粗提物的趋向率Fig.2 The taxis ratio of gregarious 4th instars L.migratoria tibitensis Chen to different fecal extract
2.2 西藏飞蝗对不同虫粪粗提物的行为反应
西藏飞蝗对其虫粪粗提物均有一定趋向性,但对不同虫态的虫粪粗提物趋向性存在显著差异(表1)。其中,群居型雄成虫对其自身虫粪粗提物趋向率最高为76.67%,而群居型4龄蝗蝻对群居型低龄蝗蝻的虫粪粗提物趋向率最低,仅为36.67%。
西藏飞蝗各虫态对群居型成虫虫粪粗提物的趋向性明显高于对其他虫态虫粪粗提物的趋向性;且对群居型雄成虫虫粪粗提物的趋向性略高于群居性雌成虫,但对两者并无显著差异。各虫态对群居型高龄蝗蝻虫粪粗提物的趋向性略高于低龄,但对两者并无显著差异。说明群居型西藏飞蝗虫粪粗提物活性随虫龄增加而增强。西藏飞蝗对散居型高龄蝗蝻的趋向性略高于低龄,对雄成虫的趋向性略高于雌成虫,但西藏飞蝗对散居型各虫态虫粪粗提物的趋向性之间无显著性差异。
各虫态西藏飞蝗对低龄蝗蝻虫粪粗提物的趋向性均较低,都小于或等于50%;对成虫虫粪粗提物的趋向性无显著性差异。散居型蝗虫对蝗蝻虫粪粗提物的趋向性高于同虫态群居型蝗虫对蝗蝻虫粪粗提物的趋向性。除对散居型雄成虫虫粪粗提物外,雄成虫对同一虫粪粗提物的趋向性均高于雌成虫。
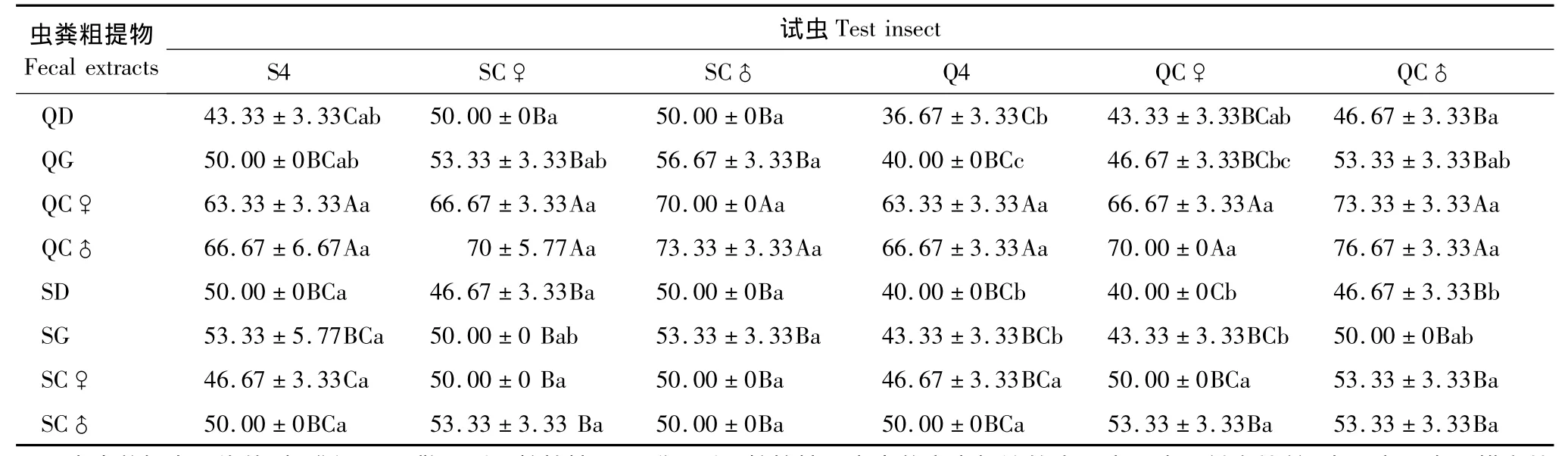
表1 西藏飞蝗对不同虫粪粗提物的趋向率(%)Table1 The taxis ratio of L.migratoria tibitensis Chen to different fecal extract(%)
2.3 西藏飞蝗不同虫态虫粪粗提物的成分分析
通过气质联用分析可知,不同虫态西藏飞蝗虫粪粗提物共含有35种化合物,主要包含烯烃、醇、醛、酮和酚类等(表2)。不同虫态虫粪粗提物所含化合物数量及含量有所差别。雌性成蝗化合物种类最多,散居型蝗蝻化合物种类最少。从各化合物含量看,西藏飞蝗虫粪粗提物主要成份为环己醇、2,5-二甲基吡嗪、2,6,6-三甲基环己烯-1,4-二酮、壬醛、苯甲醛、(E)-3,7,11,15-四甲基-2-十六碳烯-1-醇、3-苯基丁-2-醇和 2,2'-亚甲基双-(4-6-叔丁基苯酚)。另外,蝗蝻虫粪粗提物中(3β,5α)-2-亚甲基-3-胆甾烷醇含量远高于成蝗。
2.4 西藏飞蝗对人工合成化合物的触角电位反应
对西藏飞蝗虫粪粗提物中含量较高的化合物及与东亚飞蝗聚集信息素相同的化合物进行触角电位反应,结果见图3。在0.04—4μL/mL浓度范围内,除对(E)-3,7,11,15-四甲基-2-十六碳烯-1-醇触角电位反应不明显外,西藏飞蝗试虫对供试的人工合成化合物均有一定的电生理反应,其变化趋势大致可分为3类。第一类是苯甲醛、2,6,6-三甲基环己烯-1,4-二酮、4-(2,6,6-三甲基环己烯基)3-丁烯-2-酮、2,5-二甲基吡嗪和己醛。西藏飞蝗各虫态对浓度为2μL/mL和4μL/mL的各化合物触角电位反应值均高于对照,且对浓度为2μL/mL的各化合物触角电位反应值均最高。第二类是2-己烯醛、环己醇、庚醛、苯甲醇、壬醛和癸醛等6种物质。在0.04—4μL/mL浓度范围,不同虫态西藏飞蝗对同一化合物的电生理反应变化趋势不一致。如散居型雌性成虫和散居型雄成虫对环己醇的电生理反应值随环己醇浓度增大而增强;但散居型和群居性蝗蝻对浓度为4μL/mL的环己醇电生理反应值低于2μL/mL。第三类是2,2'-亚甲基双-(4-6-叔丁基苯酚)、3-苯基丁-2-醇和1-乙基-3-甲基环戊烯。西藏飞蝗各虫态对这3种化合物的电生理反应均显著高于对照,且随物质浓度增加,电生理反应值显著增加。就不同虫态西藏飞蝗对同一物质的反应值来看,总体呈现出散居型强于群居性、成虫强于若虫,雄性强于雌性的趋势。
3 讨论
本文表明溶剂浸提法获得的粗提物活性随提取溶剂极性增强而增强,乙醇浸提法获得的粗提物活性最强,丙酮次之。说明西藏飞蝗虫粪粗提物组分主要为高极性和中极性的物质,低极性的物质较少。超声波提取法在处理粪便的过程中由于温度上升或震动破坏了活性成分,故制备效果不理想。这与石旺鹏等的对东亚飞蝗粪便聚集信息素提取方法的研究结果报道一致[24]。
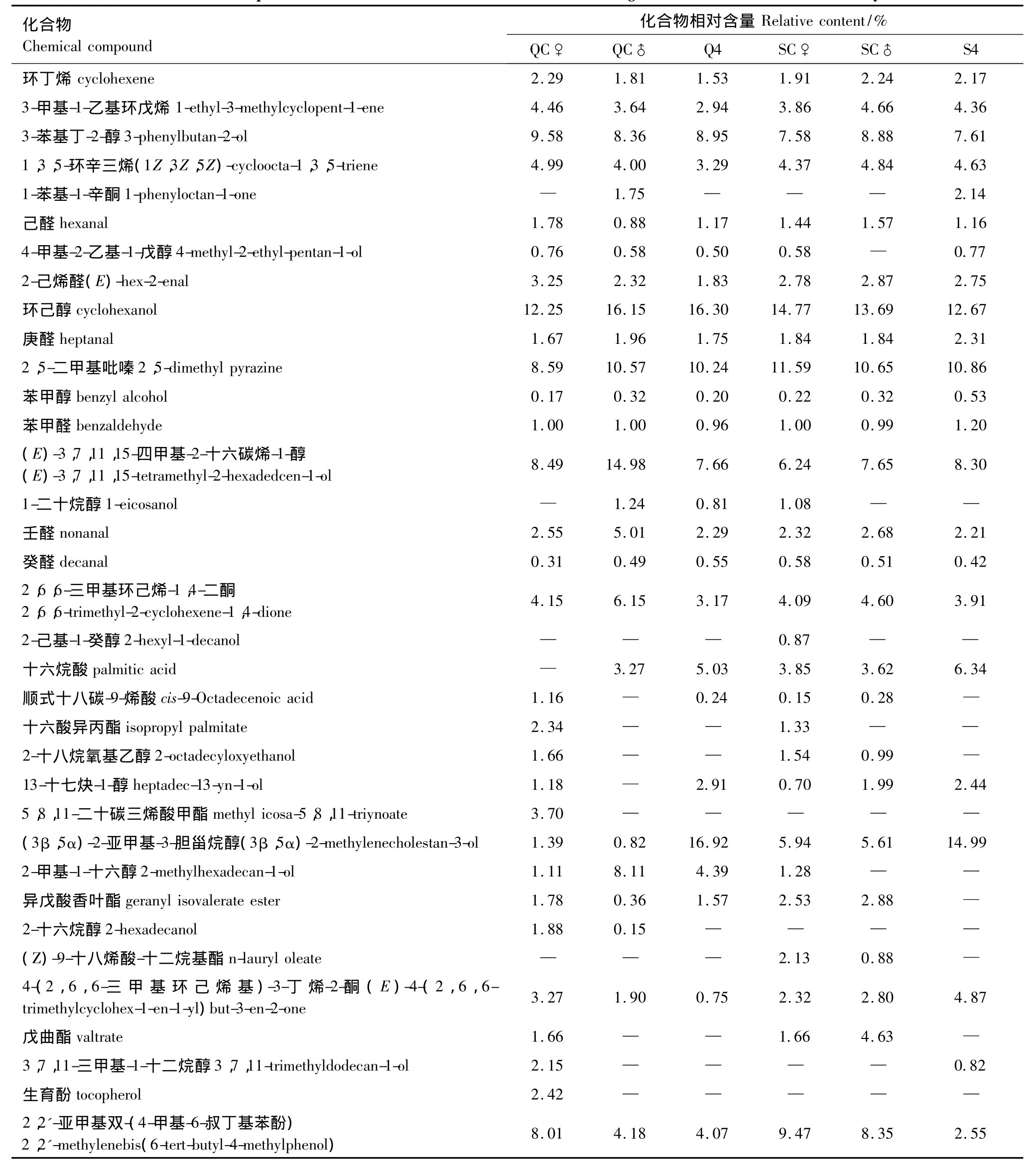
表2 GC-MS法鉴定的西藏飞蝗虫粪粗提物成分及相对含量Table2 Chemical compounds and relative content in fecal volatile of L.migratoria tibitensis Chen identified by GC-MS
西藏飞蝗对不同虫粪粗提物的行为反应表明,西藏飞蝗虫粪粗提物活性随虫龄增加,群居型成虫虫粪粗提物活性最强,雄成虫虫粪粗提物活性高于雌成虫,推测成虫虫粪粗提物可能在维持种群聚集中起主要作用。本试验还发现散居型蝗虫对蝗蝻虫粪粗提物的趋向性高于群居型蝗虫对蝗蝻虫粪粗提物的趋向性。不同虫态西藏飞蝗对同一人工合成化合物的触角电位反应也总体呈现散居型强于群居型、成虫强于蝗蝻,雄性强于雌性的趋势。一方面可能是由于散居型西藏飞蝗触角上感受器数量较群居型更多,对寄主植物、产卵场所等的感知和定位能力更强[27];另一方面群居型蝗虫群集生活,对生活环境中的类似信息素存在一定的适应性,因而对聚集信息素的敏感性不及散居型蝗虫。

图3 西藏飞蝗对不同浓度人工合成聚集信息素单质的触角电位反应Fig.3 Electrophysiological responses of L.migratoria tibitensis Chen to different concentrations of synthetic active substance
现有关于沙漠蝗、非洲飞蝗和东亚飞蝗聚集信息素成分研究表明蝗虫聚集信息素成份较为复杂。不同种类、同种不同生物型、不同性别、不同发育阶段聚集信息素成分及作用对象均表现出明显的差异[18-19,28]。西藏飞蝗成虫较蝗蝻虫粪粗提物中的化合物种类更多,表明随虫龄增长化合物种类增加。雌性可能由于生殖等原因,虫粪粗提物化学组分最多,具体是何原因还有待进一步深入研究。群居型和散居型成虫、蝗蝻虫粪粗提物中均有11种物质与东亚飞蝗聚集信息素一致,依次为己醛、2-己烯醛、环己醇、庚醛、2,5-二甲基吡嗪、苯甲醇、苯甲醛、壬醛、癸醛、2,6,6-三甲基环己烯-1,4-二酮和 4-(2,6,6-三甲基环己烯基)3-丁烯-2-酮,但是比例有所不同。西藏飞蝗虫粪粗提物中有些物质未曾在东亚飞蝗粪便挥发物中发现,如(E)-3,7,11,15-四甲基-2-十六碳烯-1-醇、3-苯基丁-2-醇、1-乙基-3-甲基环戊烯和2,2'-亚甲基双-(4-6-叔丁基苯酚)等。西藏飞蝗虫粪粗提物中未发现愈创木酚、邻二甲氧基苯和苯酚这3种沙漠蝗和非洲飞蝗聚集信息素中存在的化合物。这可能与西藏飞蝗和东亚飞蝗、非洲飞蝗等隶属不同亚种,且食物、生活条件不同有关。另外,本研究采用溶剂浸提法获得的虫粪粗提物中既含有挥发性成分,也具有非挥发性成分,这也是引起西藏飞蝗和其他飞蝗化合物不同的主要原因。因此,在后续研究中,需直接提取虫粪取挥发性成分做进一步研究。触角电位反应说明,虽然在西藏飞蝗各虫态粪便聚集信息素中(E)-3,7,11,15-四甲基-2-十六碳烯-1-醇含量较高,但并无电生理活性。其余物质根据西藏飞蝗不同虫态对不同浓度的反应趋势大体可分为3类,说明不同活性成分作用浓度不同。各化合物最适浓度及不同化合物混合作用时,达到最大聚集活性的各成分比例,各成分含量还需进一步研究。在试验中还发现,蝗蝻虫粪粗提物中(3β,5α)-2-亚甲基-3-胆甾烷醇含量远高于成蝗,由于未购得该成分人工合成化合物,并未对该化合物进行触角电位反应,该化合物含量在成若蝗中显著不同是否是引起成蝗和蝗蝻虫粪粗提物活性差异的主要原因还需进一步研究。
[1] Chen Y L.Locust and locust plague.Bulletin of Biology,1991,26(11):9-12.
[2] Chen Y L.The main achievements of research and control about migratory locust in China.Entomological Knowledge,2000,37(1):55-59.
[3] Chen Y L.A new subspecies of Locusta migratoria—Tibetan migratory locusta(Locusta migratoria tibetensis subsp.N.).Acta Entomologica Sinica,1963,12(4):463-474.
[4] Li Q,Feng CH,Zhang M,Jiang F,Yang G,Luo L M.The biological characteristics of Locusta migratoria tibetensis.Entomological Knowledge,2007,44(2):210-213.
[5] Li Q,Wang SZ,Feng C H,Zhang M,Jiang F,Yang G,Luo L M.The physiological and biochemical indexes of the cold-hardiness of Locusta migratoria tibetensis Chen.Acta Ecologica Sinica,2008,28(3):1314-1320.
[6] Li Q,Liao Z C,Yang G,Feng CH,Yang QF,Luo H H,Jiang CX,Wang H J.Effect of vegetation and soil on oviposition of Locusta migratoria tibetensis Chen.Scientia Agricultura Sinica,2012,45(4):656-665.
[7] Li Q,Wu L,Yang G,Kuang JK,Feng CH,Luo H H,Yang Q F,Jiang CX,Wang H J.Effects of temperature stress and ultraviolet radiation stress on antioxidant systems of Locusta migratoria tibetensis Chen.Acta Ecologica Sinica,2012,32(10):3189-3197.
[8] Yang Q F,Liao Z C,Li Q,Yang G,Feng C H,Jiang C X.Feeding habits and economic threshold of Locusta migratoria tibetensis.Acta Phytophylacica Sinica,2008,35(5):399-404.
[9] Yang Y H.Broadening the scope of biological control by alternatives towards the substainable pest management.Acta Entomologica Sinica,1998,41(suppl):1-4.
[10] Zhang L,Yan Y H.Some considerations on sustainable control over plague of locusts in China.Acta Entomologica Sinica,2000,43(suppl):180-185.
[11] Li J,Zhang L.An overview of locust pheromones.Chinese Journal of Applied Entomology,2011,48(4):1046-1051.
[12] Jiang Y,Lei C L,Zhang Z N.The aggregation pheromones of insects.Acta Entomologica Sinica,2002,45(6):822-832.
[13] Niassy A,Torto B,Njagi P G N,Hassanali A,Obeng-Ofori D,Ayertery J N.Intra-and interspecific aggregation responses of Locusta migratoria migratorioides and Schistocerca gregaria and a comparison of their pheromone emissions.Journal of Chemical Ecology,1999,25:1029-1042.
[14] Bashir M O,Hassanali A.Novel cross-stage solitarising effect of gregarious-phase adult desert locust(Schistocerca gregaria(Forskål))pheromone on hoppers.Journal of Insect Physiology,2010,56(6):640-645.
[15] Yu Y X,Cui X J,Jiang Q Y,Jin X,Guo Z Y,Zhao X B,Bi Y P,Zhang L.New isoforms of odorant-binding proteins and potential semiochemicals of locusts.Archives of Insect Biochemisty and Physiology,2007,65(1):39-49.
[16] Obeng-Ofori D,Torte B,Njagi P G N,Hassnali A,Amiani Habert.Fecal volatiles as part of the aggregation pheromone complex of the desert locust,Schistocerca gregaria(Forskal)(Orthoptera:Acrididae).Journal of Chemical Ecology,1994,20(8):2077-2087.
[17] Hassanali A,Torto B.Grasshoppers and locusts//Hardie J,Minks A K,eds.Pheromones of non-Lepidopteran insects associated with agricultural plants.Oxon:CABI Publishing,1999:305-328.
[18] Torto B,Obeng-Ofori D,Njagi PGN,Hassanli A,Amiani H.Aggregation pheromone system of adult gregarious desert locust Schistocerca gregsria(Forskal)(Orthoptera:Acrididae).Journal of Chemical Ecology,1994,20(7):1749-1762.
[19] Torto B,Njagi P G N,Hassanali A.Aggregation pheromone system of nymphal gregarious desert locust,Schistocerca gregsrfa(Forskal)(Orthoptera:hcrididae).JournaI of Chemical Ecology,1996,22(12):2273-2281.
[20] Njagi P G N,Torto B,Obeng-Ofori D,Hassanali A.Phase-independent responses to phase-specific aggregation pheromone in adult desert locusts,Schistocerca gregaria(Orthoptera:Acrididae).Physiological Entomology,1996,21(2):131-137.
[21] Rai M M,Hassanali A,Saini R K,Odongo H.Kahoro H.Identification of components of the oviposition aggregation pheromone of the gregarious desert locust,Schistocsrca gregaria(Forskal).Journal of Insect Physiology,1997,43(1):83-87.
[22] McCaffery A R,Simpson SJ,Islam M,Roessingh P.A gregarising factor present in the egg pod foam of the desert locust Schistoccrca gregaria.Journal of Experimental Biology,1998,201:347-363.
[23] Shi W P,Yang Y Y,Zhang L,Wang X D.Attraction of fecal volatile of Oriental migratory locust for the aggregation of its nymphs.Journal of China Agricultural University,2005,5(5):54-58.
[24] Shi W P,Yan Y Y,Yan Y H.EAG responses of oriental migratory locust to semiochemicals from different sources of the insect.Entomological Konwledge,2003,40(2):145-149.
[25] Guo Z Y,Shi W P,Zhang L,Wang G L.Behavioral and morphological indices for phase transformation of oriental migratory locust Locusta migratoria manilensis.Chinese Journal of Applied Ecology,2004,15(5):859-862.
[26] Yu Y X,Cui X J,Jiang Q Y,Jin X,Guo Z Y,Zhao X B,Bi Y P,Zhang L.New isoforms of odorant-binding proteins and potential semiochemicals of locusts.Archives of Insect Biochemistry and Physiology,2007,65(1):39-49.
[27] Li Y L,Li Q,Kuang JK,Yang G,Feng C H,Luo H H.Observation of antennal sensilla of Locusta migratoria tibetensis with scanninig electron microscope.Chinese Journal of Applied Entomology,2011,48(4):872-876.
[28] Ferenz H J,Seidelmann K.Pheromones in relation to aggregation and reproduction in desert locusts.Physiological Entomology,2003,28(1):11-18.
参考文献:
[1] 陈永林.蝗虫和蝗灾.生物学通报,1991,26(11):9-12.
[2] 陈永林.中国的飞蝗研究及其治理的主要成就.昆虫知识,2000,37(1):55-59.
[3] 陈永林.飞蝗新亚种——西藏飞蝗 Locusta migratoria tibetensis subsp.N.昆虫学报,1963,12(4):463-474.
[4] 李庆,封传红,张敏,蒋凡,杨刚,罗林明.西藏飞蝗的生物学特性.昆虫知识,2007,44(2):210-213.
[5] 李庆,王思忠,封传红,张敏,蒋凡,杨刚,罗林明.西藏飞蝗(Locusta migratoria tibetensis Chen)耐寒性理化指标.生态学报,2008,28(3):1314-1320.
[6] 李庆,廖志昌,杨刚,封传红,杨群芳,罗怀海,蒋春先,王海建.植被及土壤对西藏飞蝗产卵的影响.中国农业科学,2012,45(4):656-665.
[7] 李庆,吴蕾,杨刚,匡健康,封传红,罗怀海,杨群芳,蒋春先,王海建.温度和紫外辐射胁迫对西藏飞蝗抗氧化系统的影响.生态学报,2012,32(10):1-9.
[8] 杨群芳,廖志昌,李庆,杨刚,封传红,蒋春先.西藏飞蝗食性及其防治指标.植物保护学报,2008,35(5):399-404.
[9] 严毓骅.试论拓宽生物防治范围发展虫害可持续治理.昆虫学报,1998,41(增刊):1-4.
[10] 张龙,严毓骅.持续治理飞蝗灾害的新对策.昆虫学报,2000,43(增刊):180-185.
[11] 李嘉,张龙.飞蝗及沙漠蝗信息素概述.应用昆虫学报,2011,48(4):1046-1051.
[12] 姜勇,雷朝亮,张钟宁.昆虫聚集信息素.昆虫学报,2002,45(6):822-832.
[23] 石旺鹏,严毓骅,张龙,王旭东.东亚飞蝗粪便挥发物对其蝗蝻的聚集作用初报.中国农业大学学报,2000,5(5):54-58.
[24] 石旺鹏,闫跃英,严毓骅.东亚飞蝗不同来源聚集信息素的电生理活性.昆虫知识,2003,40(2):145-150.
[25] 郭志永,石旺鹏,张龙,王贵龙.东亚飞蝗行为和形态型变的判定指标.应用生态学报,2004,15(5):859-862.
[27] 李彝利,李庆,匡健康,杨刚,封传红,罗怀海.西藏飞蝗触角感器的扫描电镜观察.应用昆虫学报,2011,(48)4:872-876.

