梓醇对异丙肾上腺素诱导的大鼠心肌损伤的保护作用及机制研究
毕方杰,张虎,胡健
(1.山东省淄博市中心医院心血管内科,山东 淄博 255000;2.佳木斯大学,黑龙江 佳木斯 154000;3.中国医科大学附属第一医院心血管内科,沈阳 110001)
近年来,心血管疾病的发病率和致残致死率在全世界范围内呈明显上升趋势,虽然药物治疗与介入治疗是目前主要治疗手段,但均存在一定不足。因此筛选新的抗心肌缺血药物和探索抗心肌缺血机制仍是一项重要的研究课题。梓醇作为地黄中的主要有效成份,属于环烯醚萜单糖类。研究表明梓醇具有多种生物学活性,如抗炎、抗氧化、抗凋亡等多种生物学效应。目前研究主要集中在梓醇抗脑细胞凋亡,改善氧化应激对神经系统损伤。本课题组的前期研究发现,梓醇在细胞水平对脐静脉内皮细胞及心肌细胞也有保护作用[1],另有研究表明梓醇可明显改善心功能不全。因此我们有理由进一步研究梓醇的心肌保护作用,从而为进一步研发新的有效治疗心血管疾病的天然药物提供实验基础和理论依据。
1 材料与方法
1.1 动物模型:
健康SPF级雄性Wistar大鼠48只,体质量180~200 g。适应性饲养1周后,参照文献提供方法制作心肌损伤模型[1],采用异丙肾上腺素(每次85 mg/kg)连续皮下注射2次(间隔24 h)的方法成功建立心肌损伤模型。
1.2 材料及试剂
梓醇及丹参酮ⅡA均购自中国药品生物制品检定所,异丙肾上腺素购于Sigma公司,CK-MB及LDH试剂盒购于南京建成生物制品公司,所有一抗及二抗均购于Santa Cruz公司。
1.3 实验分组
将48只Wistar大鼠分为6组,每组8只,分别是:(1)正常对照组(Control组);(2)模型组(Model组);(3)阳性对照组(TanshinoneⅡA 组);(4)低剂量梓醇组(Catalpol-L 组 2.5 mg/kg);(5)中剂量梓醇组(Catalpol-M 组 5 mg/kg);(6) 高 剂 量 梓 醇 组(Catalpol-H 组 10mg/kg),梓醇剂量参照相关文献[2]。所有治疗组均用药10 d,第9 d,10 d连续在用药0.5 h后皮下给予异丙肾上腺素(每次85 mg/kg)。
1.4 心肌组织标本的留取及检测
最后1次用药结束24 h后,麻醉后颈动脉取血,分离血清后,保存于冰箱内,24 h内用自动生化分析仪检测CK-MB及LDH的含量。取血后立即处死大鼠取出心脏,沿冠状沟走行分离左心室心肌,每组取4个标本置于10%中性甲醛中固定24 h,石蜡包埋行HE染色,损伤分级及免疫组化检测。
1.5 HE染色
将固定好的心肌组织常规石蜡包埋,Leica石蜡切片机连续切片,厚度约5 μm,HE程序染色,Olympus显微镜观察病理改变。
1.6 免疫组化
按博士德公司SABC免疫组化染色试剂盒使用说明书进行操作,用0.01mol/L枸橼酸盐缓冲液进行热抗原修复,DAB显色液显色,阴性对照以PBS代替一抗。TNF-α和IL-1β阳性细胞表现为细胞浆内有黄色或棕黄颗粒沉积,阴性对照没有黄色颗粒沉积。在400倍高倍视野下,每张切片随机选取5个无重叠图像,应用NIS Elements F2.30图像采集软件进行图像采集,Image pro-plus图像分析软件计算平均光密度(mean optical density,MOD)。
1.7 统计学分析
采用SPSS 10.0统计软件对数据进行分析,各组实验数据以±s表示,多组间比较采用方差分析,以P<0.05为有统计学意义,以P<0.01为有显著性统计学意义。
2 结果
2.1 梓醇对各组大鼠生化指标的影响
我们首先检测反映心肌损伤的血清CK-MB及LDH变化,结果显示:Model组明显高于Control组(P<0.01)。不同剂量梓醇[(2.5~10)mg/kg]预处理后,血清LDH及CK-MB的活性下降(P<0.01),提示catalpol对ISO诱导的心肌损伤有保护作用。见表1。
表1 各组大鼠血清CK-MB和LDH的表达(±s)Tab.1 ExpressionsofserumCK-MBandLDHinallgroups(±s)
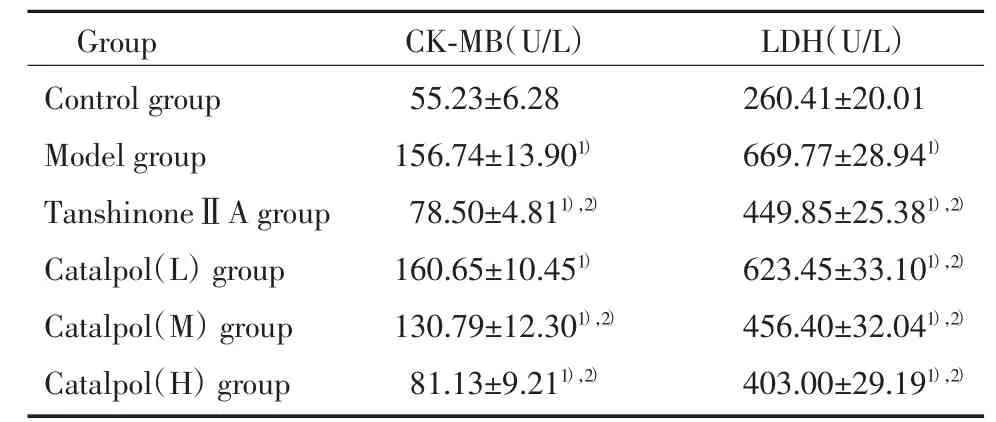
表1 各组大鼠血清CK-MB和LDH的表达(±s)Tab.1 ExpressionsofserumCK-MBandLDHinallgroups(±s)
1)P<0.01 vs control group;2)P<0.01 vs model group.
Group CK-MB(U/L) LDH(U/L)Control group 55.23±6.28 260.41±20.01 Model group 156.74±13.901) 669.77±28.941)TanshinoneⅡA group 78.50±4.811),2) 449.85±25.381),2)Catalpol(L)group160.65±10.451)623.45±33.101),2)Catalpol(M)group130.79±12.301),2)456.40±32.041),2)Catalpol(H)group81.13±9.211),2)403.00±29.191),2)
2.2 梓醇对各组大鼠心肌病理改变的影响
结果显示:Control组:心肌细胞形态正常,未见明显变性、坏死及炎性细胞浸润。心肌细胞核呈圆形或椭圆形,居细胞中央,心肌间质结构正常,无坏死灶。Model组:有明显的心肌缺血坏死变化,心肌细胞出现片状、局灶性坏死,部分心肌保持正常。心肌细胞核变形、聚集、排列紊乱,心肌间质增宽并部分出现炎性细胞浸润,心肌纤维多处肿胀断裂,肌横纹消失,局部可见空泡样变性。TanshinoneⅡA组及3种剂量Catalpol组:部分心肌缺血坏死变化,坏死灶呈点状,小片状分布,心肌间质部分仍有炎性细胞浸润,心肌病理改变程度和面积较模型组要小,炎症细胞浸润程度减轻,见图1。
2.3 各组大鼠心肌损伤分级
根据Rona提供的心肌损伤分级标准将各组大鼠心肌分为Grade 0-GradeⅣ5个级别。结果显示:Catalpol(L)组及Catalpol(M)组心肌损伤程度均较Model组减轻,但是Catalpol(H)组心肌损伤程度减轻最为显著,差异有统计学意义。见表2。
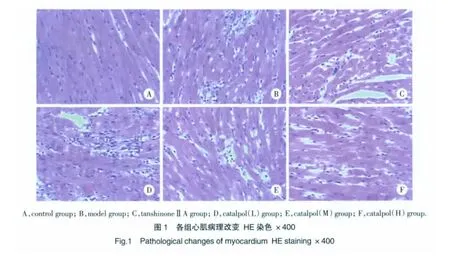

表2 各组心肌病理损伤分级Tab.2 The pathological grades of myocardium
2.4 免疫组化检测各组大鼠心肌TNF-α蛋白的表达
免疫组化结果显示TNF-α蛋白阳性染色信号呈黄色,主要位于心肌细胞胞浆,Control组有少量表达,Model组较Control组明显增多(P<0.01)。与Model组比较,TanshinoneⅡA 组、Catalpol(L) 组、Catalpol(M)组和Catalpol(H)组TNF-α蛋白表达减少(P<0.01)。见图 2。

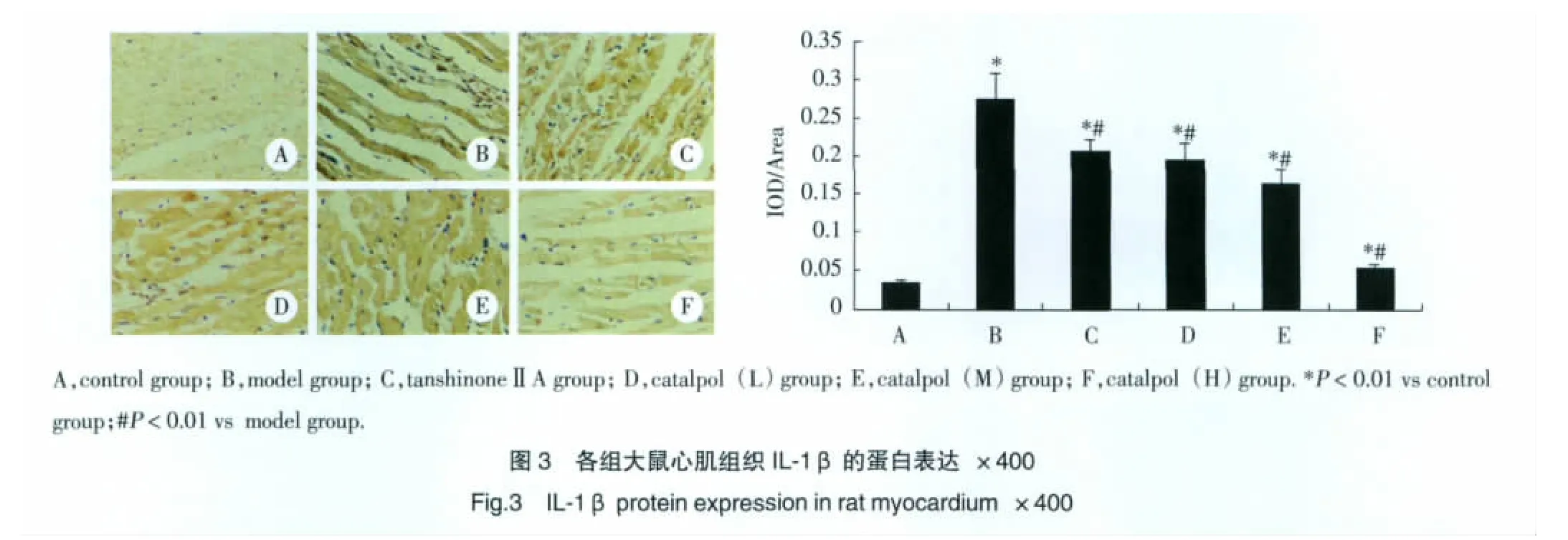
2.5 免疫组化检测各组大鼠心肌IL-1β蛋白的表达
免疫组化结果显示IL-1β蛋白阳性染色信号呈棕黄色,主要位于心肌细胞胞浆,与Control组比较,Model组表达明显增多(P<0.01),见图 3。经catalpol预干预后,IL-1β蛋白表达减少(P<0.01),差异有统计学意义,以Catalpol(H)组最显著。
3 讨论
梓醇属于环烯醚萜单糖类,是地黄中起主要药理作用的单体。相关研究已发现梓醇具有抗凋亡[3,4]、降糖[5]、抗炎[6,7]、抗氧化应激[8,9]等多种生物学活性,其中梓醇对神经系统的保护作用研究最为广泛。目前梓醇对于心血管系统的保护作用的研究处于起步阶段,本课题组的前期研究发现:梓醇通过抗氧化对阿霉素诱导的心肌细胞损害有明显的保护作用[1]。在本实验中我们进一步研究梓醇的心肌保护作用,并探讨相关作用机制。
异丙肾上腺素是一种β受体激动剂,大剂量皮下注射可引起明显的心肌损伤[1,2],目前已经广泛应用于心肌损伤的药物试验中。虽然其致心肌损伤的作用机制尚未完全明了,但是相关研究提示:氧化应激[10]、炎症反应[11]及细胞凋亡[12]可能是主要原因。LDH是一种糖酵解酶,在全身各器官均有分布,LDH质与量的改变,直接影响机体的能量代谢,在心肌细胞中分布尤其丰富,正常情况下,此酶不会从细胞中释放,但是当心肌细胞受损时,LDH大量释放入血,因此血液中LDH的变化是反应心肌受损的一项重要指标。CK-MB是CK的一种同工酶,主要存在于心肌细胞的胞浆和线粒体中,它能催化肌酸和ATP之间高能磷酸键转换生成磷酸肌酸和ADP的可逆反应,为肌肉收缩提供能量。由于CK-MB特异性较高,故其活性增加被认为是心肌细胞损伤最敏感的指标之一,与心肌坏死程度呈正相关。在本研究中发现,当用异丙肾上腺素作用于大鼠机体后,血清CK-MB和LDH都明显升高,表明皮下注射异丙肾上腺素可成功诱导心肌损伤动物模型。不同剂量梓醇预干预可明显降低血清CK-MB和LDH的活性(P<0.01),提示梓醇对ISO诱导的心肌损伤有明显的保护作用。
各组大鼠心肌HE染色结果显示:在异丙肾上腺素作用下的大鼠中,心肌损伤明显,心肌细胞核变形、聚集、排列紊乱,心肌间质增宽并部分出现炎性细胞浸润,心肌纤维多处肿胀断裂,肌横纹消失,进一步证明异丙肾上腺素诱导的心肌损伤模型是成功的。应用梓醇后,尤其是中剂量和大剂量梓醇可以使坏死面积明显减少,炎性细胞浸润程度明显减轻,这一变化趋势也在各组大鼠损伤分级比较中得到体现,上述结果均提示:梓醇对异丙肾上腺素诱导的心肌损伤有保护作用。
炎性细胞因子是机体出现炎症反应的标志,可进一步引起中性粒细胞与血管内皮细胞的粘附、迁移以及最终在心肌组织的积聚,释放溶酶体酶,损伤心肌细胞。在本实验中我们发现异丙肾上腺素作用于大鼠后,大鼠心肌有明显的炎性细胞的渗出和间质水肿,提示我们炎症在异丙肾上腺素的心肌损伤中发挥重要作用TNF-α和IL-1β是诱导炎性细胞渗出的重要因子,他们可以在多种细胞因子的刺激下由多种细胞分泌[13],有相关研究表明,在人体心脏损伤时,上述两种炎症因子明显升高[14]。另有实验发现[15,16]阻止 TNF-α 和 IL-1β 的表达可以明显改善梗死心肌的心功能,因此抑制炎症反应是保护心肌损伤的一种有效方法。以往的研究发现,梓醇可以抑制脂多糖(LPS)引起的小胶质细胞的激活,限制小胶质细胞产生反应性氧自由基(ROS)和一氧化氮(NO),降低诱导型一氧化氮合成酶(iNOS)的表达[17],表明梓醇在LPS介导的炎症损伤中起到抑制小胶质细胞的活化和炎症因子产生的作用。在Aβ1-42损伤的小鼠大脑皮层神经-胶质混合细胞培养体系中,梓醇一方面直接保护神经元免受神经毒性损伤,另一方面通过抑制小胶质和星型胶质细胞活化及炎症因子TNF-α的过量表达,间接保护神经元,通过抗炎发挥神经保护作用[18]。因此为了进一步探讨梓醇对心肌损伤的保护机制,我们从炎症角度检测了心肌组织TNF-α和IL-1β蛋白的表达。结果发现:在异丙肾上腺素处理组的大鼠心肌上述两种因子表达明显升高,而梓醇预处理后,尤其在中剂量和高剂量梓醇组,上述两种因子的表达明显减少,提示梓醇通过抑制炎症因子的表达实现保护心肌的作用。
总之,本实验表明梓醇可以阻止异丙肾上腺素诱导的心肌损伤,这种保护作用可能是通过抑制炎症反应来实现的,此结果将为筛选具有心肌保护作用的中药单体提供更多实验依据及理论依据。
[1]Xing W,Yanbin M.Effect of catalpol on doxorubicin-induced cytotoxicity in H9c2 cells[J].J Med Plants Res,2012,6(5):849-854.
[2]XiuliZ,WeidongL,XinhuaN,etal.Systemicadministrationofcatalpol prevents d-galactose induced mitochondrial dysfunction in mice[J].Neurosci Lett,2010,473(3):224-228.
[3]Dan L,Yong B,Yang L,et al.Catalpol modulates the expressions of Bcl-2 and Bax and attenuates apoptosis in gerbils after ischemic injury[J].Brain Res,2006,1115(1):179-185.
[4]Lingai H,Yukun S,Jian H.Catalpol inhibits apoptosis in hydrogen peroxide-induced endothelium by activating the PI3K/Akt signaling pathway and modulating expression of Bcl-2 and Bax[J].Eur J Pharmacol,2010,628(1-3):155-163.
[5]赵素容,卢兖伟,陈金龙,等.地黄梓醇降糖作用的实验研究[J].时珍国医国药杂志,2009,20(1):171-172.
[6]YuanY T,Li JA,Lan J,et al.Catalpol protects dopaminergic neurons from LPS-induced neurotoxicity in mesencephalic neuron-glia cultures[J].Life Sci,2006,80(3):193-199.
[7]Aihong Z,Shuang H,Jing B,et al,Effects of catalpol on mitochondrial function and working memory in miceafter lipopolysaccharide-induced acute systemic inflammation[J].Exp Toxicol Pathol,2009,61(5):461-469.
[8]Yu R M,Lan J,Yan LD,et al,Efficacy of catalpol as protectant against oxidative stress and mitochondrial dysfunction on rotenone-induced toxicity in mice brain[J].Exp Toxicol Pathol,2007,23(3):314-318.
[9]Xiu LZ,Bo J,Zhi BL,et al.Catalpol ameliorates cognition deficits and attenuates oxidative damage in the brain of senescent mice induced by D-galactose[J].Pharmacol Biochem Be,2007,88(1):64-72.
[10]Zhang GX,Kimura S,Nishiyama A,et al.Cardiac oxidative stress in acuteandchronicisoproterenol-infusedrats[J].CardiovascRes,2005,65(1):230-238.
[11] Murray DR,Prabhu SD,Chandrasekar B.Chronicβ-Adrenergic stimulation induces myocardial proinflammatory cytokine expression[J].Circulation,2000,101(20):2338-2341.
[12]Shizukuda Y,Buttrick PM,Greenen DL,et al.β-Adrenergic stimulation causes cardiocyte apoptosis:influence of tachycardia and hypertrophy[J].Am J Physiol Heart Circ Physiol,1998,275(3Pt2):961-968.
[13]FanH,WilliamsDL,ZingarelliB.Differentialregulationof lipopolysaccharide and Gram-positive bacteria induced cytokine and chemokine production in macrophages by Galpha (i)proteins[J].Immunology,2007,122(1):116-123.
[14]Ono K,Matsumori A,Shioi T.Cytokine gene expression after myocardial infarction in rat hearts.Possible implication in left ventricular remodeling[J].Circulation,1998,98(2):149-156.
[15]Turner NA,Mughal RS,Warburton P.Mechanism of TNF alpha-induced IL-1alpha,IL-1beta and IL-6 expression in human cardiac fibroblasts:effectsofstatinsandthiazolidinediones[J].CardiovascRes,2007,76:81-90.
[16]SuzukiJ,OgawaM,MaejimaY,etal.Tea catechins attenuate chronic ventricular remodeling after myocardial ischemia in rats[J].J Mol Cell Cardiol,2007,42(2):432-440.
[17]Tian YY,An LJ,Jiang L,et al.Catalpol protects ddopaminergic neurons from LPS-induced neurotoxicity in mesencephalic nuron-glia cultures[J].Life Sci,2006,80(3):193-199.
[18]Jiang B,Du J,Liu JH,et al.Catalpol attenuates the neurotoxicity induced by β-amyloid1-42 in cortical neuron-glia cultures[J].Brain Res,2008,1188:139-147.

