山竹果皮抗氧化活性成分的超声提取工艺
张晓军,李春英,刘帅华,刘德曼,李 朝,施昆明,赵春建*
(1.吉林省林业科学研究院,长春130033;2.东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
山竹(Garcinia mangostanaL.)又称山竹子、凤果、莽吉柿,是藤黄科(Guttiferae)藤黄属(Garcinia)常绿乔山竹的果实,原产于马来西亚和印度尼西亚,是一种典型的热带水果,主要分布于泰国、越南、马来西亚、印度尼西亚和菲律宾等东南亚国家,我国台湾、福建、云南和广东也有引种[1]。山竹果皮一直作为泰国传统医药用于腹痛、腹泻、痢疾、感染性创伤、慢性溃疡、白带、淋病、乳腺癌、白血病、肝癌等疾病治疗[2-6]。近年来,山竹特别是山竹果皮的化学成分及其生物学活性成为人们的研究热点[7-9]。本文旨在探讨山竹抗氧化活性物质的提取工艺,为山竹果皮的开发利用提供基础数据。
近年来,超声技术在天然产物提取中已显示出巨大的优势[10-12],利用超声波产生的振动、空化效应、搅拌作用等可以加速植物有效成分进入溶剂,提高提取率,缩短提取时间,简化提取操作步骤。本文以山竹果皮为原料,采用超声法对其中抗氧化活性物质提取的方法进行研究,获得优化的超声提取条件,为山竹果皮的进一步开发利用提供参考。
1 材料与方法
1.1 试验材料
山竹购自哈尔滨市水果市场,去除果肉,果皮气干后,用小型粉碎机粉碎后进行提取。
1,1-二苯基-2-苦基肼(DPPH)、儿茶素、β-胡萝卜素(Sigma公司);乙醇、氯仿、亚油酸、吐温、三羟甲基氨基甲烷,盐酸,钨酸钠,钼酸钠,磷酸,液溴 (以上试剂均为分析纯);实验用水为二次蒸馏水。
1.2 主要仪器与设备
KQ5200DB型超声波清洗仪,昆山市超声波仪器有限责任公司;5418型离心机,Eppendorf公司;UV-2550型紫外-可见分光光度计,岛津公司,日本;PHSJ-5型pH计,上海精密科学仪器有限公司;HYQ-2121A型涡旋混匀器,南京畅翔仪器设备有限责任公司;R-1001-V/VN旋转蒸发仪,郑州长城科工贸有限公司。
1.3 样品溶液的制备
山竹果皮60℃烘干、用小型粉碎机粉碎、过60目筛。精确称取山竹果皮粉若干份,每份1.5 g,分别加一定量的提取溶剂进行提取,提取液过滤、定容至50 mL,滤液离心取上清、待测。
1.4 DPPH法检测抗氧化性
参考Gyamfi等的方法[13],并做适当调整。取1 000 μL DPPH 乙醇溶液(0.1 mm)、450 μL Tris-HCl缓冲液(50 mm,pH 7.4)与 100 μL样品或儿茶素溶液,涡旋混匀后避光静置30 min,于517 nm下测定吸光值。以100 μL与样品溶液浓度相同的乙醇代替样品同法操作,为对照。本试验3次重复。根据吸光值计算DPPH自由基清除率。
DPPH自由基清除率式中:Aa为试验组吸光值;AC为对照组吸光值。
1.5 β-胡萝卜素漂白法检测抗氧化性
参照陈炳华等[14]的方法进行检测。
1.6 总酚含量测定
总酚含量按照Kujala等的Folin-Ciocalteu法测定[15],并适当修改,以儿茶素为对照品进行检测。试验时,取500 μL Folin-Ciocalteu试剂(1 N)加入500 μL不同浓度儿茶素于离心管中,涡旋混匀30s,并静置5 min后,添加1 mL 20%Na2CO3再静置10 min,离心,取上清液,于730 nm测定吸光值,并根据此吸光值与儿茶素浓度绘制标准曲线。样品分析时,以500 μL样品取代儿茶素,其余操作同上。将样品吸光值代入上述标准曲线,计算出每毫升提取液中所含儿茶素相对量,并以此表示总酚含量,本试验3次重复。
1.7 山竹果皮抗氧化活性成分超声提取工艺的正交试验设计
在预试验的基础上,分别以乙醇浓度 (A)、超声时间 (B)、超声温度 (C)和液料比 (D)为影响因素,以100μL提取液的DPPH自由基清除率为指标,进行L16(45)正交试验。
2 结果与分析
2.1 提取条件对山竹果皮提取液DPPH自由基清除率的影响
对正交试验的结果进行方差分析和显著性检验,正交试验结果、方差分析结果分别见表1和表2。

表1 L16(45)正交试验结果Tab.1 Results of L16(45)orthogonal experiment

表2 DPPH自由基清除率的方差分析Tab.2 Variance analysis of scavenging rate on DPPH free-radical
2.2 正交试验结果分析
由表1的极差和表2的方差分析结果可以看出,4种因素对超声提取结果影响大小依次为:乙醇浓度A>超声时间B>超声温度C>液料比D。以影响最大的2个因素乙醇浓度和超声时间对提取液DPPH自由基清除率作图,结果如图1所示。
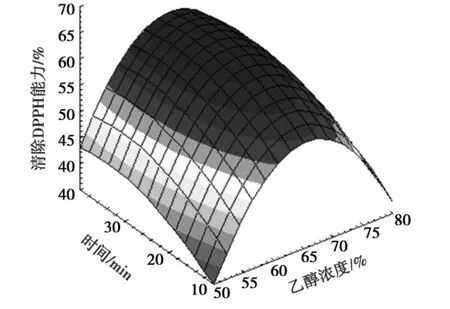
图1 乙醇浓度和提取时间对提取液清除DPPH能力影响Fig.1 The effect of ethanol concentration and extraction time on scavenging DPPH of the extracts
根据极差分析结果,确定在试验设计的范围内,最优的试验方案为 A2B3C3D1,即乙醇浓度60%、超声时间30 min、超声温度40℃和液料比10 mL/g。
2.3 抗氧化活性成分超声提取的数学模拟
对超声提取的试验结果进行逐步回归分析,并剔除最小的影响因素液料比,得到回归方程:

式中:X1为乙醇浓度;X2为超声时间,min;X3为超声温度,℃;Y为DPPH自由基清除率,%。
方程回归系数R=0.9652,可以看出模拟值与试验值拟合良好,说明数值模拟是成功的。
根据方程对最佳提取条件进行预测,结果见表3。

表3 最优解预测Tab.3 Prediction of optimum solution
从表3可以看出,拟合的方程预测的最优解与正交试验极差和方差的分析结果基本一致。由于在试验范围内,液料比对提取率的影响不显著,综合考虑工艺成本,最终确定最佳工艺条件为乙醇浓度65%、超声时间32 min、超声温度41℃和液料比10 mL/g。为了确认拟合方程预测的最优组合的可信性,进行优化组合的验证试验,测得此条件下100μL提取液的DPPH自由基清除率为66.8%,与方程的预测值接近,重复试验相对偏差为1.82%(n=3),说明方程优化的超声提取工艺条件可信。
2.4 山竹果皮提取物抗氧化活性初步分析
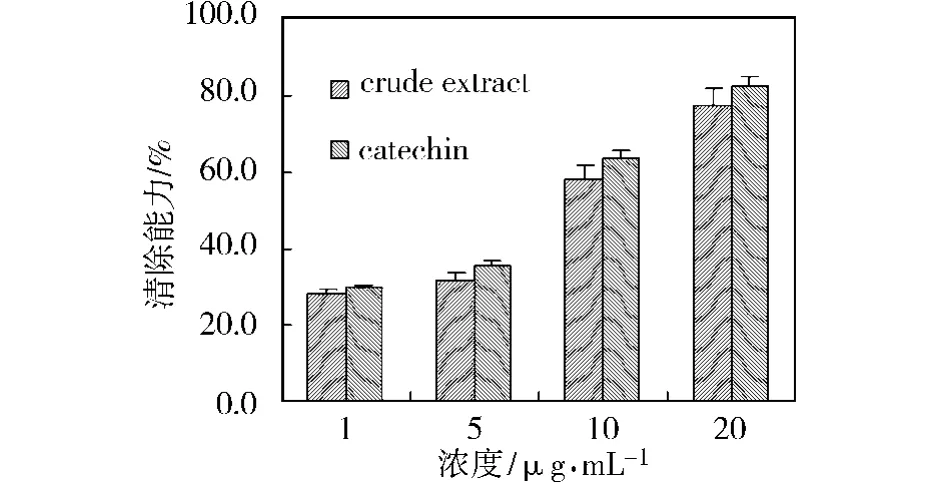
图2 山竹果皮提取物清除DPPH自由基的能力Fig.2 Free-radical scavenging activity of the extracts from mangosteen pericarp on DPPH assay
山竹果皮的抗氧化能力是由多种物质共同作用的结果,仅有部分物质结构组成已被鉴定,但仍有一些成分结构及其存在方式仍不明确。由于植物成分的体外抗氧化能力大部分与酚类化合物有关,因此,将最优化提取条件下得到的提取液浓缩至干,干燥物溶于乙醇,测定了总酚含量,经计算干燥物总酚含量为492.3 mg/g儿茶素。为了评价山竹果皮乙醇提取物的抗氧化能力,对不同浓度的儿茶素和乙醇提取液干燥物样品清除DPPH自由基能力、抑制β胡萝卜素漂白的能力进行了测定,结果分别如图2和图3所示。从图2可以看出,乙醇提取物的对DPPH自由基的清除率随浓度的增加而增大,经计算,其对DPPH自由基清除的IC50值为8.4 μg/mL,与公认的天然抗氧化剂儿茶素的IC50值接近(7.6μg/mL);从图3可以看出,乙醇提取物对β-胡萝卜素漂白的抑制率随浓度的增加而增大,经计算,其对β-胡萝卜素漂白抑制的IC50值为 52.6μg/mL,而儿茶素的 IC50值大于200 μg/mL,说明山竹果皮提取物具有较强的抗氧化能力。
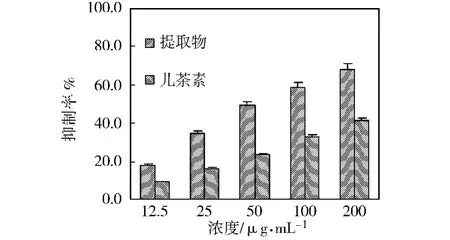
图3 山竹果皮提取物对β-胡萝卜素漂白的抑制能力Fig.3 Inhibitory effect of the extracts from mangosteen pericarp on β-carotene bleaching
3 结束语
利用DPPH自由基清除能力作为抗氧化性成份的提取指标,采用正交试验优化了山竹中抗氧化活性成分的提取工艺条件,即最佳工艺条件为乙醇浓度65%、超声时间32 min、超声温度41℃和液料比10 mL/g。山竹果皮提取物具有较高的清除DPPH自由基和对β-胡萝卜素漂白的抑制能力,其具体抗氧化成份有待于进一步研究,并评估其抗氧化应用的可行性。
】
[1]刘全儒,于 明.几种热带果实的食用部位[J].生物学通报,2003,38(1):10.
[2]Ho C K,Huang Y L,Chen C C.Garcinone E a Xanthone derivative,has potent cytotoxic effect against hepatocellular carcinoma cell lines[J].Planta Med.,2002,68(11):975-979.
[3]Chiang L C,Cheng H Y,Liu M C,et al.In vitro evaluation of antileukemic activity of 17 commonly used fruits and vegetables in Taiwan[J].Lebensmittel-Wissenschaft & Technologie,2004,37(5):539-544.
[4]Moongkarndi P,Kosem N,Kaslungka S,et al.Antiproliferation,antioxidation and induction of apoptosis by Garcinia mangostana(mangosteen)on SKBR3 human breast cancer cell line[J].Journal of Ethnopharmacology,2004,90(1):161-166.
[5]Pedraza-Chaverri J,Cárdenas-Rodríguez N,Orozco-Ibarra M,et al.Medicinal properties of mangosteen(Garcinia mangostana)[J].Food and Chemical Toxicology,2008,46(10):3227-3239.
[6]Seeram N P.Berry fruits:compositional elements,biochemical activities,and the impact of their intake on human health,performance,and disease[J].Journal of Agricultural and Food Chemistry,2008,56(3):627-629.
[7]范润珍,彭少伟,林宏图.山竹壳色素的提取及其稳定性研究[J],食品科学,2006,27(10):358 -362.
[8]张宝友,李春英,赵春建.山竹果皮提取物抗氧化活性研究[J].森林工程,2012,28(5):6 -10.
[9]辛 广,张 平,张雪梅.山竹果皮与果肉挥发性成分分析[J].食品科学,2005,26(8):291 -294.
[10]Kujala T S,Loponen J M,Klika K D,et al.Phenolics and betacyanins in red beetroot(Beta vulgaris)root:distribution and effect of cold storage on the content of total phenolics and three individual compounds[J].Journal of Agricultural and Food Chemistry,2000,48(11):5338-5342.
[11]Oyaizu M.Antioxidative activity of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J].Nippon Shokuhin Kogyo Gakkaishi,1986,35(11):771-775.
[12]Kirby A J,Schmidt R J.The antioxidant activity of Chinese herbs for eczema and of placebo herbs-1[J].Journal of Ethnopharmacology,1997,56(2):103-108.
[13]Gyamfi M A,Aniya Y.Antioxidant properties of Thonningianin A,isolated from the African medicinal herb,Thonningia sanguinea[J].Biochemical Pharmacology,2002,63(9):1725-1737.
[14]杨冬梅,金月亭,柯乐芹,等.12种常见蔬菜抗氧化活性的比较研究[J].中国食品学报,2007,7(5):24 -29.

