扩张型心肌病心力衰竭患者血清HCY水平变化及临床意义
高 伟,王志永,王雪艳
(1 安新县医院,河北安新 071600;2 天津医科大学心血管病临床学院;3 永清县人民医院)
扩张型心肌病(DCM)是一种以心腔扩大、心肌收缩功能障碍为主要特征的心肌疾病,心衰是其常见症状,预后极差,5年内死亡者约占50%。同型半胱氨酸(HCY)是一种含硫氨基酸,通常被认为是冠心病、血栓形成、血管病变等疾患的危险因素。近年来研究表明高HCY血症与慢性心衰有一定关系,而与心衰病因无关[1]。目前DCM与HCY关系的研究尚不多见。2008年1月~2012年5月,我们观察了86例DCM慢性心衰患者血清HCY水平变化,现探讨其意义。现报告如下。
1 资料与方法
1.1 临床资料 DCM患者86例,男49例,年龄(53.18 ±5.26)岁,女 37 例,年龄(53.35 ±5.12)岁。所有患者均除外严重的肝、肾、肺等疾病,且不合并心脏瓣膜病、心肌梗死、高血压等。86例患者均符合Framingham心衰诊断标准[2],同时采用美国纽约心脏病协会(NYHA)心功能分级标准对患者进行分组,Ⅰ~Ⅱ级46例(A组),其中男26例,女20例,年龄(53.63±5.32)岁;Ⅲ~Ⅳ级组40 例(B组),其中男23,女17 例,年龄(54.82 ±4.23)岁。所有患者均使用血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂、β受体阻滞剂、地高辛、利尿剂等药物治疗,疗程为2周。两组一般资料比较差异无统计学意义。
1.2 方法
1.2.1 HCY检测 所有研究对象均于治疗前1 d及治疗2周后清晨空腹抽肘静脉血5 mL,置入含2 mg依地酸(EDTA)的试管,2 h内离心(2500 r/min)10 min,分离出血清,置于-70℃冰箱贮存待测。采用ELISA法检测血清中的HCY,正常参考值5.0~15.9 μmol/L[3]。
1.2.2 BNP检测 患者于入院24 h内采静脉血3 mL,应用乙二胺四乙酸试管,采用美国博适Triage干式快速定量心衰诊断仪测定全血标本中的BNP,正常范围<100 ng/L。
1.2.3 左房内径、左室舒张末内径、左室射血分数的测定 行多普勒超声心动图检查,采用美国产Philips7500超声心动图仪测定。
1.2.4 随访观察 通过门诊、家访或电话进行随访,每2个月1次,于患者第一次随访及以后每隔6个月来院复查血清HCY。记录心源性死亡(包括泵衰竭死亡及心源性猝死)的发生情况。
1.3 统计学方法 采用SPSS17.0统计软件。计量资料采用表示,采用t检验,计数资料采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组超声心动图检测结果比较 A组左房内径、左室舒张末内径低于B组,左室射血分数高于B组(均 P <0.01)。见表1。
表1 两组血清超声心动图检测结果比较()

表1 两组血清超声心动图检测结果比较()
注:与 A组相比,*P <0.01
组别 n 左房内径(mm)左室舒张末内径(mm)左室射血分数(%)A组46 38.03 ± 8.53 62.38 ±4.35 29.30 ±3.68 B 组 40 44.10 ±10.21* 69.82 ±3.66* 21.58 ±2.56*
2.2 两组治疗前后 HCY、BNP水平比较 两组HCY、BNP水平治疗后均低于治疗前 (P均 <0.01),且A组治疗后HCY、BNP水平低于B组(P均 <0.01)。见表 2。
表2 两组患者治疗前后HCY和BNP水平比较()
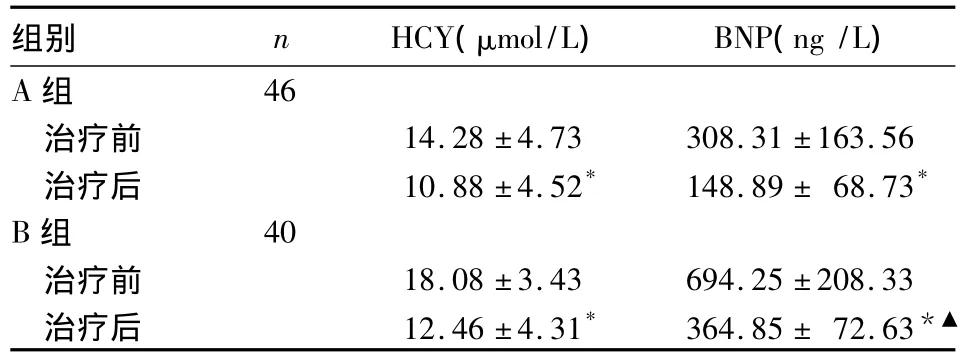
表2 两组患者治疗前后HCY和BNP水平比较()
注:与同组治疗前比较,*P<0.01;▲与A组治疗后比较,P<0.01
组别 n HCY(μmol/L) BNP(ng/L)A组46治疗前 14.28 ±4.73 308.31 ±163.56治疗后 10.88 ±4.52* 148.89 ± 68.73*B组 40治疗前 18.08 ±3.43 694.25 ±208.33治疗后 12.46 ±4.31* 364.85 ± 72.63*▲
2.3 HCY水平与心源性死亡发生率的关系 两组24.0±8.3个月。A组发生心源性死亡 15例(32.6%),B 组为19 例(47.5%)(P <0.05)。见表3。

表3 两组HCY水平与心源性死亡发生率比较
3 讨论
HCY是一种含硫基的非必需氨基酸。新近研究表明,高HCY血症(HHCY)与心衰的发生有一定关系[4]。HHCY可损伤血管内皮,刺激血小板黏附血管内膜,使机体处于一种凝血功能增强的状态,引起动脉血管炎症反应[5]。Blacher 等[6]研究指出HCY与心脏质量指数及左室舒张末期内径、左室后壁厚度及室间隔的厚度等呈正相关。An等[7]研究发现HCY可通过自氧化诱导产生过氧化物,导致核转录因子-kB(NF-kB)迅速而短暂的升高,而NF-kB异常激活是机体炎症反应放大与持续的分子生物学机制。Vasan等[8]研究发现,血浆HCY水平是心力衰竭发展的独立预测因子。
DCM往往表现为一侧或双侧心腔扩大,心肌收缩期泵血功能障碍,从而产生充血性心力衰竭[9]。现已逐渐明确心肌重塑是DCM心衰发生、发展的分子细胞学基础,是心衰的决定性机制[10],包括心肌细胞肥大、胚胎基因和蛋白质的再表达、心肌细胞坏死或凋亡、炎症反应、心肌细胞外基质质量和组成的变化。临床表现为心肌肥厚、心室容量增加和心室形状的改变[11]。
HCY可通过自氧化产生大量自由基,介导DCM患者血管内皮损伤[12],还促进血栓调节因子的表达,以及假性血友病因子(VWF)水平升高,并激活蛋白C和凝血因子Ⅴ、Ⅹ、Ⅺ,还可使血小板功能受损,血栓素A2(TXA2)合成增加,促进血小板黏附和聚集,纤维蛋白溶酶原浓度降低,纤溶活性下降,从而加速了血栓的形成[13]。Asghar等[14]研究发现在HCY下,凝血酶调节蛋白 mRNA合成增多,但由于同型半胱氨酸使凝血酶调节蛋白表皮生长因子样结构域减少或被替代,影响凝血酶与蛋白C在其上的结合,使辅酶因子活性减低,导致蛋白C抗凝活性下降,而促进血栓的形成。研究表明HCY还促进了DCM炎症反应的形成和发展,增加了其心衰发生的风险[15]。HCY通过改变细胞内巯基的氧化还原状态(特别是谷胱甘肽的浓度)来影响DCM患者相关的细胞功能,如抑制转录因子抗因子NF-kB的激活,影响内皮细胞的凋亡过程及黏附分子和细胞因子的表达;干扰蛋白质在内质网的折叠、转运、抑制凝血酶调节蛋白等细胞蛋白的表达、分泌。通过上述环节,高HCY促进了DCM患者血管内皮细胞的凋亡。
BNP首先从猪脑中分离出来,有活性的BNP包括32个氨基酸,由左心室分泌,心室压力、心室容积和心脏负荷是其释放的主要刺激因素,心衰患者的血浆BNP浓度升高,且其升高的程度与心衰的严重程度呈明显的正相关关系。本文通过测量血浆BNP浓度,除了反应DCM患者心衰的严重程度外,主要观察DCM心衰患者血浆BNP浓度是否与血清HCY水平有相关性。
本研究结果显示,心功能Ⅰ~Ⅱ级者治疗前后血清HCY、BNP水平同步地低于Ⅲ~Ⅳ级者,左房内径、左室舒张末内径低于Ⅲ~Ⅳ级者,左室射血分数高于Ⅲ~Ⅳ级者,HCY水平与心源性死亡发生率呈正相关关系,说明HCY水平的高低可作为DCM严重程度的有效评价指标。
[1]Schofield RS ,Wessel TR ,Walker TC ,et al.Hyperhomocysteinemia in patients with heart failure referred for cardiac transplantation:preliminary observations[J].Clin Cardiol,2003,26(9):407-410.
[2]McKee PA,Castelli WP,McNamara PM,et al.The natural history of congestive heart failure,the Framingham Study[J].NEJM,1971,285(26):1441-1446.
[3]Alam MA,Hasain SA,Narang R,et al.Association of polymor-phism in the thermolabile 5,10-methylene tetrahydrofolate reductase gene and hyperhomocysteinemia with coronary artery disease[J].Mol Cell Biochem,2008,310(1-2):111-117.
[4]Arnesen E,Refsum H,Bonaa KH,et al.Serum total homocysteine and coronary heart disease[J].Int J Epidemiol,1995,24(4):704-709.
[5]丁国锋,毛艳华,石斗飞,等.老年高血压并缺血性脑卒中患者血浆同型半胱氨酸变化的临床意义[J].山东医药,2006,46(1):30-31.
[6]Blacher J,Demuth K,Guerin AP,et al.Association between plasma homocysteine concen-trations and cardiac hypertrophy in end stage renal disease[J].Nephrol,1999,12(4):248-255.
[7]An Yeung KK,Woo CW,Sung FL,et al.Hyperhomocysteinemia activates nuclear factor-kB in endothelial cells via oxidative stress[J].Circ Res,2004,94:2998.
[8]Vasan RS,Beiser A,Dpagostino RB,et al.Plasma homocysteineand risk for congestive heart failure in adults without prior myocardial infarction[J].JAMA,2003,289(10):1251-1257.
[9]Hsu DT,Canter CE.Dilated cardiomyopathy and heart failure in children[J].Heart Fail Clin,2010,6(4):415-432.
[10]Greenberg B.Treatment of heart failure:state of the art and prospectives[J].J Cardiovasc Pharmacol,2001,38(Suppl 2):S59-S63.
[11]Maekawa K,Hirayama A,Iwata Y,et al.Global metabolomic analysis of heart tissue in a hamster model for dilated cardiomyopathy[J].J Mol Cell Cardiol,2013,59(6):76-85.
[12]Kang RX,Zhang JJ.A natural squamosamide derivative FLZ inhibits homocysteine-induced rat brain microvascular endothelial cells dysfunction[J].Biochem Biophys Res Commun,2012 ,417(4):1176-1181.
[13]Malinowska J,Tomczynska M,Olas B.Changes of blood platelet adhesion to collagen and fibrinogen induced by homocysteine and its thiolactone[J].Clin Biochem,2012 ,45(15):1225-1228.
[14]Asghar A,Ali FM.Anaesthetic management of a young patient with homocystinuria[J].J Coll Physicians Surg Pak,2012,22(11):720-722.
[15]Miller JW,Beresford SA,Neuhouser ML,et al.Homocysteine,cysteine,and risk of incident colorectal cancer in the Women's Health Initiative observational cohort[J].Am J Clin Nutr,2013,97(4):827-834.

