纳豆固态发酵条件优化
甘 露,崔松松,倪敬田,曹媛媛,唐欣昀
(安徽农业大学生命科学学院,安徽合肥230036)
纳豆是一种传统的大豆发酵食品,具有抗血栓、降血压、抗肿瘤等多种生理功能[1],在各有效成分中最重要的是具有溶栓作用的纳豆激酶(nattokinase,NK)[2]。纳豆激酶具有安全性好、成本低、作用迅速、经口服后可迅速入血、纤溶活性强、作用时间长等特点[3]。因此,研究提高纳豆中纳豆激酶的含量可以提高纳豆功能性食品的营养和保健价值。目前,已有一些关于固态发酵产纳豆激酶工艺条件的报道[4-7],这些研究主要涉及固态发酵中有关辅料的配比、理化条件的优化,多以产纳豆激酶为主要指标。生产纳豆功能性食品条件要求严格,需要使用完整的大豆,不能添加过多的辅料和化学药品,仅有少数报道涉及纳豆功能性食品固态发酵[8-10],初步注意到在固体发酵中大豆颗粒的破碎程度与提高纳豆中纳豆激酶的活性有关[10],但尚缺少大豆破碎度等因素与纳豆激酶活性之间关系的详细研究。本文将详细研究在纳豆固态发酵中包括大豆破碎度在内的理化条件的影响,以纳豆激酶活性为指标,采用 Plackett-Burman设计和响应面法设计实验,优化发酵条件,为研发优质纳豆功能性食品提供参考。
1 材料与方法
1.1 材料与仪器
纳豆枯草芽孢杆菌(Bacillus subtilis natto)BN-3菌株 由本实验室筛选保存;纤维蛋白原、凝血酶sigma公司出品;其他试剂 均为国产或进口分析纯;种子培养基[11]牛肉膏0.3%,蛋白胨1%,NaCl 0.5%,pH7.2~7.4。
恒温水浴锅 江苏省金云市荣华仪器制造有限公司;不锈钢手提式灭菌锅 上海华线医用核子仪器有限公司;电热恒温培养箱 上海一恒科技有限公司;恒温振荡器 江苏太仓市实验设备厂;紫外可见分光光度计 北京普析通用仪器有限责任公司;超净工作台 苏州净化设备有限公司。
1.2 实验方法
1.2.1 种子液的制备 挑取经斜面活化的纳豆菌一环接到种子培养基中,在37℃,转速为160r/min的摇床中培养12h。
1.2.2 工艺流程 大豆→清洗→浸泡→沥干→灭菌(115℃高压灭菌30min)→冷却至室温→接菌→发酵→后熟→取样分析。
按照实验设计定量接菌及设定发酵温度,发酵时间及后熟时间等参数。
1.2.3 纳豆激酶粗酶液制备及活性测定方法 酶活测定参照Astrup纤维蛋白平板法[12]制备纤维蛋白平板。
尿激酶标准曲线的测定:配制不同浓度的尿激酶标准溶液。取上述各溶液的尿激酶标准溶液10μL点样于纤维蛋白平板上,37℃培养12h,测量溶解圈的两垂直直径。以溶解圈的垂直直径乘积为纵坐标,以标准尿激酶活力为横坐标作标准曲线,方程是y=0.1523x+0.5025,R2=0.9847。
粗酶液制备及点样:纳豆固体发酵结束后,在每克纳豆中加入质量分数为0.9%生理盐水2mL,4℃浸提12h,4500r/min离心20min,取上清液即所需的粗酶液。取15μL样品点样于纤维蛋白平板,37℃培养12h,测量溶解圈的两垂直直径。参照上述尿激酶标准曲线的方程计算样品酶活。
1.3 实验设计
1.3.1 Plackett-Burman法筛选影响发酵的主要因素[5]纳豆激酶固态发酵的影响因素包括大豆起始含水率、大豆破碎度、培养基起始pH、物料厚度、接种量、发酵温度、发酵时间、后熟时间等。实验选用N=12的Plackett-Burman设计安排,对这8个因素进行研究,另外3个因素为虚拟变量。实验设计的每个因素取2个水平,根据前期实验确定各因素的水平,各因素水平取值见表1。
1.3.2 最陡坡实验 根据Plackett-Burman实验所筛选出的各显著因素效应值的大小来确定最陡上升路径,而其他因素的取值则根据各因素效应的正负和大小,正效应的因素均取较高值,负效应的因素均取较低值[5]。
1.3.3 响应面实验 在对Plackett-Burman实验结果充分分析的基础上,在最陡坡实验确定的区域内,采用Box-Behnken响应面设计方法,以NK酶活为响应值对显著因素进行优化,各因素水平和编码见表2。

表1 因素及水平Table 1 Factors and levers

表2 Box-Behnken响应面设计实验因素水平和编码Table 2 Factors and levels in the Box-Behnken experimental design

表3 Plackett-Burman实验设计与结果Table 3 Plackett-Burman test design and result
2 结果与分析
2.1 重要因素筛选
按实验设计进行两轮实验,取两次测量值的平均值为准,实验结果见表3。各因素效应及其显著性见表4。
由表4可知,对纳豆激酶产率有显著影响的因素包括大豆破碎度、接种量和发酵温度。由各因素的效应还可看出,要提高纳豆激酶酶活,应降低发酵温度,升高大豆破碎度和接种量。同时,还可以看出大豆含水率、物料厚度为正效应,培养基起始pH、发酵时间、后熟时间为负效应。因此在后续实验中大豆含水率、物料厚度取高水平,培养基起始pH、发酵时间、后熟时间取低水平。

表4 因素及效应Table 4 Factors and effects
2.2 最陡坡实验
表5列出了各因素的变化方向、步长及实验结果。由实验结果可知,NK产率在1与2之间有一个明显上升,之后开始下降,最优发酵条件在1与2之间,故2条件为后续实验的中心点。

表5 最陡坡实验设计及结果Table 5 Steepest ascent test design and result
2.3 响应面实验优化发酵条件
在最陡爬坡实验确定的区域内,以大豆破碎度、发酵温度、接种量为自变量,以NK酶活为响应值,经软件Design Expert8.0.6设计了3因素3水平共15个实验点的Box-Behnken响应面分析实验。实验设计及结果见表6。
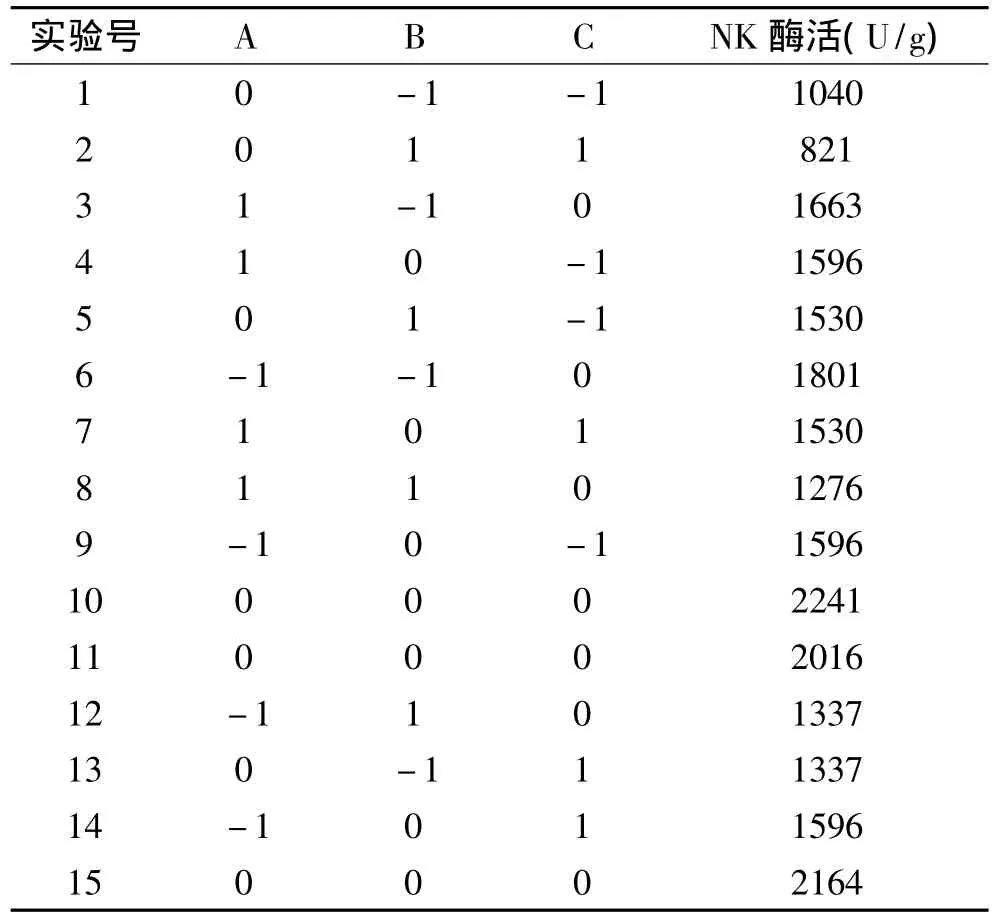
表6 响应面实验设计及结果Table 6 Box-Behnken experimental design matrix and experimental results

表7 回归模型的方差分析Table 7 Variance analysis for the fitted regression equation
通过Desgn-Expert 8.0.6软件分析可以得到优化后的响应值的动态参数方程:

由表7分析结果表明,该模型的p=0.0146<0.05,表明模型显著:失拟项p=0.2901>0.05,不显著。回归方程相关系数的平方为0.9391,说明建立的模型能理解响应值变化的93.91%,模型拟合程度较好。
利用Desgn-Expert 8.0.6软件求解方程最大值时,当破碎度为3.69、接种量7.9%、发酵温度31.93℃时,NK酶活最高为2149.86U/g。根据实际要求,最终确定最佳发酵条件为破碎度4,接种量7.9%、发酵温度32℃。为检验模型的准确性,在最佳发酵条件下进行发酵实验,三次实验得NK酶活平均值为(2140.5±83.2)U/g,表明所得的模型具有一定的实验指导意义。
3 结论
3.1 本文采用Plackett-Burman实验设计方法,筛选出了影响纳豆激酶固态发酵的3个显著因素:大豆破碎度、接种量和发酵温度。通过最陡爬坡实验有效地逼近最大响应区域。然后利用Box-Burman实验设计及响应面分析得到最优发酵工艺:大豆破碎度4、接种量7.9%、发酵温度32℃。经验证,在此条件下,纳豆激酶酶活为(2140.5±83.2)U/g。
3.2 目前,关于纳豆激酶固态发酵的研究报道主要涉及以苹果渣或豆渣等为原料,添加尿素或麸皮等辅料,发酵纳豆菌、生产纳豆激酶[4-7];而仅有少数研究涉及固态发酵纳豆功能性食品。本文采用大豆为原料,未添加任何辅料,以纳豆激酶活性为指标深入研究了在纳豆固态发酵过程中理化条件的影响。
3.3 路龙女在纳豆固体发酵和液体发酵条件的研究中初步探讨了大豆破碎度与提高纳豆中纳豆激酶活性有关[10]。本研究由PB实验结果得知大豆破碎度对提高纳豆中纳豆激酶活性具有显著效应。这可能是由于适当破碎大豆颗粒,有利于空气流通及物料散热,进而有利于纳豆菌的生长及产酶。
3.4 一些研究涉及固态发酵纳豆功能食品[8-10],所得纳豆中的纳豆激酶酶活在976~2150U/g之间。本研究设计破碎大豆的新工艺,采用响应面法优化条件,在最佳发酵条件下获得纳豆激酶酶活为(2140.5±83.2)U/g,高于多数文献报道的酶活,为研发优质纳豆功能性食品、提高纳豆中纳豆激酶酶活提供技术参考和实验数据。
[1]Yoshikatsu Murooka,Mitsuo Yamshita.Traditional healthful fermented products of Japan [J].Ind Microbiol Biotechnol,2008,35:795-796.
[2]Sumi H,Hamada H,Tsushima H,et al.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto;a typical and popular soy- bean food in the Japanese diet[J].Experientia,1987,43(10):1110-1111.
[3]Essam Kotb.Fibrinolytic Bacterial Enzymes with Thrombolytic Activity[M].Springer Briefs in Microbiology,2012:35-43.
[4]鲍艳霞,陈钧,钱之玉,等.固态发酵产纳豆激酶的工艺优化[J].沈阳药科大学学报,2004,11(6):468-471.
[5]仓义鹏,张宏志,董明盛.苹果渣固态发酵产纳豆激酶的工艺优化[J].生物工程,2010,31(15):181-185.
[6]孙岩,王海宽,王建玲,等.以豆粕为原料固态发酵产纳豆激酶工艺的优化[J].天津科技大学学报,2011,26(6):7-11.
[7]周伏忠,陈晓飞,陈国参,等.纳豆激酶固态发酵的参数优化[J].生物技术,2011,21(1):91-94.
[8]熊迎新,尹宗宁,李婉宜.纳豆激酶固体浅盘发酵工艺的优化[J].中国生化药物杂志,2005,26(1):15-17.
[9]史卓强.功能性食品纳豆及其相关产品关键技术研究[D].西安:陕西科技大学,2009.
[10]路龙女,唐欣昀.纳豆固体发酵和液体发酵条件的研究[J].安徽农业科学,2011,39(26):16433-16434,16443.
[11]郎亚军,隋海澜,于育玲,等.纳豆枯草杆菌的分离鉴定及发酵条件优化[J].大连轻工业学院学报,2005,24(1):12-14.
[12]Astrup T.Muller.S.The fibrin plate method for estimating fibrinolytic activity [J].Arch Biochemical Biopys,1995,40:346-351.
[13]郭颖,孔繁东,祖国仁,等.纳豆激酶溶栓功效及开发应用前景[J].食品工业科技,2007,28(3):225-228.
[14]董超,李楠,程辉彩,等.纳豆激酶发酵条件的优化[J].食品科学,2009,30(1):151-154.
[15]张庆庆,许鹏,汤文晶,等.响应面法优化纳豆菌液态发酵产抗菌物质条件的研究[J].食品工业科技,2012,33(13):240-242.
[16]孙艳辉,董英.响应面发优化以豆渣为基质发酵纳豆菌[J].食品科学,2007,28(4):208-211.
[17]Ferreira S L C,Bruns R E,Ferreira H S,et al.Box-Behnken design:An alternative for the optimization of analytical methods[J].Analyfica Chimiea Acta,2007,597(2):179-186.
[18]Prafulla M Mahajan,Sagar V Gokhale,Smita S Lele.Production of Nattokinase Using Bacillus natto NRRL 3666:Media Optimization,Scale Up,and Kinetic Modeling [J].Food Sci.Biotechnol,2010,19(6):1593-1603.

