流式细胞术在实验教学中的开发与应用
张 英, 黎宏宇, 李 莉, 杨 举, 成 军, 郝林琳, 于 浩
(吉林大学畜牧兽医学院,吉林长春130062)
0 引言
流式细胞术(Flow Cytometry,FCM)是20世纪70年代发展起来的利用流式细胞仪(Flow Cytometer)快速定量分析细胞群的物理、化学特征以及利用这些特征精确分选细胞的新型技术,主要包括流式分析、流式分选两部分。流式细胞仪的出现及流式细胞术的发展是多学科领域高度发展的结晶,其中涉及到细胞生物学、分子生物学、生物技术、分子免疫学、单克隆抗体技术、电子物理技术、纳米技术、激光技术、流体力学、荧光化学、光电测量技术、计算机技术等多个领域[1-2]。
FCM既可以测量细胞大小、细胞内颗粒的复杂程度、细胞表面积、核浆比例、DNA含量、RNA及蛋白质含量,也可以检测细胞表面/胞浆的特异性抗原、细胞活性、细胞因子、细胞受体、激素结合位点等,该技术作为一种快速细胞分析技术,不仅应用于免疫学、细胞生物学、微生物学、发育生物学、生理学等基础医学研究,更广泛应用于临床的各个方面,如肿瘤学、血液学(血常规检查)、药物学、临床检验等各方面[3-5]。
因此,2009年吉林大学农学部利用985项目建设平台,引进一台美国BD公司,型号为AriaⅡ的流式细胞仪,并在动物医学、动物生物技术专业的细胞生物学实验教学中率先引入了流式细胞技术,旨在实现细胞生物学、FCM理论知识教学与学生动手操作能力培养的有效融合。
1 流式细胞术原理
流式细胞仪主要由流动室及液流驱动系统,激光光源及光束形成系统,信号检测、存贮、光电转换、数据处理系统和细胞分选系统5部分组成。
将待测标本制成单细胞悬液,经不同的荧光染料染色后加入流式上样管,由气压装置送入流动室,样品在鞘液的的包被下成单行排列,以一定流速经过喷嘴进入激光聚焦区,在激光束的照射下,产生散射光信号和荧光信号。散射光信号包括前向角散射光(Forward Scatter,FSC)及侧向角散射光(Side Scatter,SSC)。FSC主要反映细胞的大小,SSC主要反映细胞质、胞膜、核膜的折射情况以及细胞内颗粒的复杂程度。荧光信号的强弱反映了所测细胞表面抗原的强度或细胞内物质的浓度。光信号通过波长选择通透性滤片后,经PMT接收转化为电信号,再经模/数转换器,转换为可被计算机识别的数字信号,计算机对采集的各种信号用相应的应用软件进行分析处理,以一维直方图、二维、三维散点图或等高线图以及数据表等形式显示出来[6-8]。
2 实验设计部分
2.1 仪器演示
鉴于AriaⅡ型流式细胞仪既可用于流式分析又可用于细胞的无菌分选,对存放环境要求较高,目前置于吉林大学畜牧兽医学院生物技术综合实验室(见图1)。选修细胞生物学实验课的本科生及研究生人数较多,我们采取仪器现场观摩、学生分组轮换形式对仪器进行讲解。

图1 AriaⅡ流式细胞仪
学生应更换工作服、拖鞋后方可进人流式细胞仪实验室。教师先讲解流式细胞仪的组成由液流系统、光学系统、电子控制系统、数据处理系统及细胞分选系统5个部分,并分别介绍每一部分的具体构造及在整个系统中所起的作用,待分析的标本在仪器中经过的“路径”,将流式细胞仪原理介绍贯穿入各个系统中,使学生对流式细胞仪有个整体的感官认识。逐一开启稳压电源、计算机、激光电源进入开机程序,强调开机过程中的应注意那些问题。运行 BD FACSDiva Software软件并进入软件界面,此部分做重点讲解:软件的组成部分及每一部分的具体作用;流式细胞术的常用术语介绍:FSC、SSC、流式通道、门、A、H、W、CV等;流式结果的表示形式:单参数直方图、双参数点图或等高线图、叠加图,FSC-SSC为物理参数图,采用散点图表示,细胞染一种荧光,一般用直方图表示,双色或多色,常用散点图或等高线图表示,当然也可以把散射光参数与荧光参数随意组合,并可根据需要进行相互转换[9];以单色和双色实验为例,利用BD公司培训用的荧光微球,现场演示单色和双色实验标本的分析方法,包括文件的建立、标本的准备、参数的设定、样品的采集、结果分析、数据的导入导出等;最后进行仪器关机及日常维护的讲解。通过上述学习,学生对流式细胞术的理论知识、仪器的原理及构造有了更为深刻、系统的认识,为后续实验的完成奠定了基础。
2.2 实验内容
2.2.1 仪器、材料与试剂
流式细胞仪,生物安全柜,CO2培养箱,低温高速离心机,移液器(1mL、200 μL),枪头(1 mL、200 μL),DMEM(Hyclone);pCI-EGFP质粒(实验室构建),293T细胞,lipofectin2000(Invitrogen),Balb/C 小鼠,FITCAnti-Mouse CD4(Biolegend),PE-Anti-Mouse CD8a(Biolegend),CY5/PE-Anti-Mouse CD3e(Biolegend)。
2.2.2 方法
实验一:pCI-EGFP质粒转染293T细胞后EGFP蛋白的表达。
(转染方法按lipofectin2000(Invitrogen)进行。)
(1)转染前1天将293 T细胞用无抗生素培养液接种到6孔板中,当细胞达到70% ~80%融合时即可进行细胞转染。
(2)转染液的准备。A液:用无血清培养液稀释3μg质粒至15μL,B液:用无血清培养液稀释10μL脂质体至15μL。轻轻混合两种液体,室温放置20 min。
(3)转染准备。细胞用1.5 mL无血清培养液漂洗2次,再加入2 mL无血清培养液。
(4)转染。将A/B混合液缓慢加到6孔板中,摇匀,37℃培养4 h后,更换10%DMEM培养液中继续培养。
(5)转染24 h后,将细胞用胰酶消化,分散后用PBS漂洗2次,并重悬于PBS中,密度为(5~10)×106cells/mL。
(6)流式细胞仪检测。阴性对照为未转染质粒的293 T细胞。
实验二:小鼠脾脏T淋巴细胞亚类的检测
(1)将制备好的脾脏T淋巴细胞悬液取2×106个淋巴细胞于EP管中。
(2)加入1mL的荧光洗液,1 500 r/min离心10 min,洗涤2次。
(3)每管加入FITC-Anti-Mouse CD4单克隆抗体(0.5 mg/mL)、PE-Anti-Mouse CD8a 单克隆抗体(0.2 mg/mL)、CY5/PE-Anti-Mouse CD3e(0.2 mg/mL)的荧光洗液200μL重新悬浮细胞,混匀后4℃避光孵育30 min。
(4)加入1 mL荧光洗液,1 500 r/min离心10 min,洗涤2次。最后用500μL荧光保存液重悬。
(5)流式细胞仪检测。相同方法,同时分别制备各染色抗体单染对照管和空白管。
2.2.3 结果与分析
实验一:pCI-EGFP质粒转染293T细胞后EGFP蛋白的表达。
GFP(绿色荧光蛋白)是来自海洋生物水母的一种天然荧光蛋白,它在细菌、真菌、动物和植物细胞中表达时都能够发出荧光,这使它成为一种理想的荧光标记蛋白。增强型绿色荧光蛋白(EGFP)基因是在水母来源的野生型GFP基因的基础上,替换了影响荧光表达效率的88个密码子中的92个碱基所构建的合成基因,可以显著提高其在动物细胞中的荧光效能,大大增强了该报告分子的灵敏度,其激发光波长为488 nm,发射光波长为507 nm,同时由于Em值的显著提高等诸多特性使EGFP非常适用于流式细胞术(FCM)分析[10-11]。因此突变型EGFP基因比野生型更适用于作为报告基因和筛选标记,目前广泛应用于细胞生物学、分子生物学和发育生物学等领域[12]。
图2为FSC-SSC物理参数图,确定待检测的细胞群;图3为EGFP单参数直方图(峰图),“P2”门为表达EGFP的阳性细胞情况。
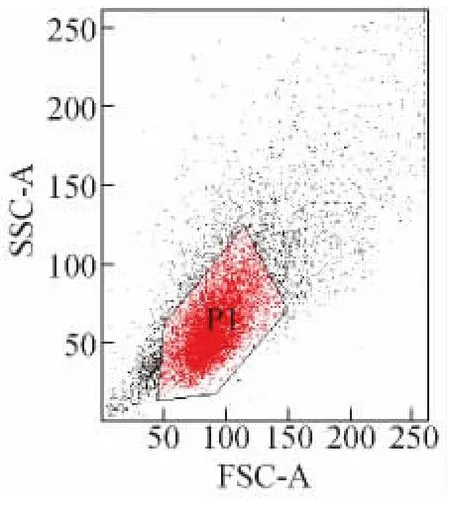
图2 FSC-SSC物理参数图
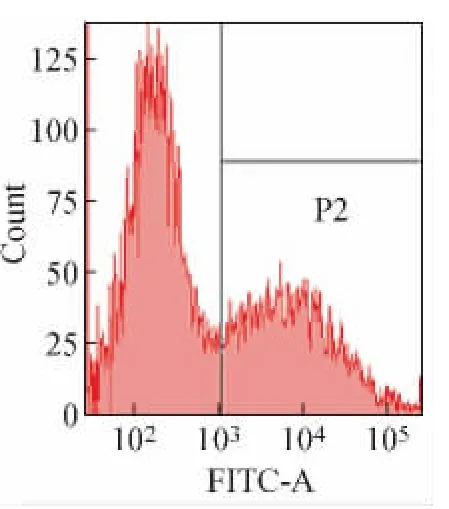
图3 EGFP单参数直方图
实验二:小鼠脾脏T淋巴细胞亚类的检测。
淋巴细胞是正常机体免疫系统功能最重要的一类细胞群。在免疫应答过程中,脾脏淋巴细胞发育成为功能不同的亚类,各亚类的数量和功能发生变化时,表明机体的免疫状态发生变化[13]。流式细胞仪可同时检测一种或几种淋巴细胞细胞表面抗原,通过不同的淋巴细胞亚类数量的测定来确定机体的免疫状态[14-15]。
图4为FSC-SSC物理参数图,确定待检测的淋巴细胞群;图5为CD3+/CD4+双参数散点图;图6为CD3+/CD8+双参数散点图。Q1:CD4单阳性细胞;Q2:CD3+/CD4+双阳性细胞;Q3:CD3-/CD4-双阴性细胞;Q4:CD3+单阳性细胞;Q1-1:CD8单阳性细胞;Q2-1:CD3+/CD8+双阳性细胞;Q3-1:CD3-/CD8-双阴性细胞;Q4-1:CD3+单阳性细胞。

图4 FSC-SSC物理参数图
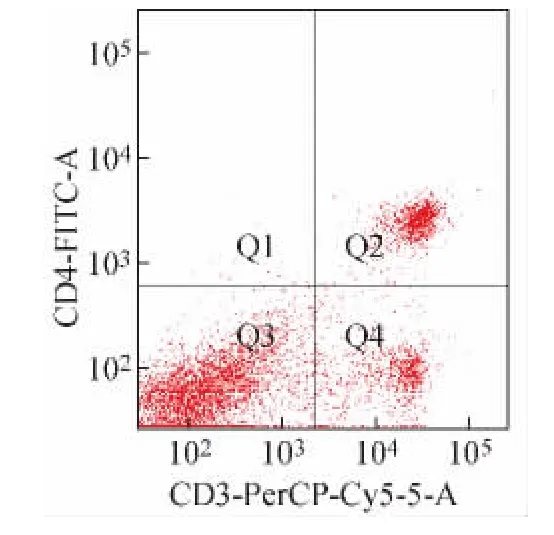
图5 CD3+/CD4+双参数散点图

图6 CD3+/CD8+双参数散点图
3 结语
该实验教学实现了教学和科研的有机结合,既重温了细胞培养技术,又加深了对FCM基础知识的理解和掌握。从细胞标本的制备到上机检测、结果分析等一系列步骤中,既培养了学生动手操作能力、科研分析及解决问题的能力,也充分调动了学生的积极性,增加了师生之间的互动,优化了教学过程,提高了教学质量,取得了满意的教学效果。在提高流式细胞仪利用率的同时,也最大程度地发挥了现有仪器设备的资源优势和师资特长,使学生接受了最好的专业训练。
[1] 邓喜林,林跃智,李 蕊,等.流式细胞术在免疫学上的应用及其发展前景[J].东北农业大学学报,2009,40(6):137-140.
[2] 郭术俊.流式细胞术在免疫学中的应用[J].齐齐哈尔医学院学报,2012,33(5):636-637.
[3] 刘 涛,张 巍,王凤阳,等.流式细胞仪在免疫学研究中的应用[J].动物医学进展,2008,29(3):102-105.
[4] 王淑静,毕建杰,郝建民.流式细胞仪在动物疫病检测中的应用[J].实验科学与技术,2012,10(1):34-36.
[5] 杜立颖,张丽君.流式细胞术新实验的开发[J].实验技术与管理,2004,21(6):17-20.
[6] 张峻峰,刘道亮,赵占民,等.流式细胞术在微生物快速检测领域的研究进展[J].食品工程,2010(3):19-22.
[7] 贾永蕊.流式细胞术在DNA检测中的应用[J].中国医学装备,2010,7(4):4-6.
[8] 王书奎,周振英.实用流式细胞术彩色图谱[M].上海:第二军医大学出版社,2004.
[9] 刘爱平.细胞生物学荧光技术原理和应用[M].合肥:中国科技大学出版社,2007.
[10] 魏 欣,张 野,李 军,等.真核表达载体pEGFP-claudin-1的构建及其在293T细胞中的表达[J].细胞与分子免疫学杂志.2008,24(5):444-446.
[11] 谷 雨,李 青,叶 菁,等.EGFP-CIDE-3及 DsRed 1-CIDE-3融合基因真核表达载体的构建及其在293T细胞中的表达和定位[J].医学研究生学报,2008,21(9):911-915.
[12] 徐洁杰,张伟娟,王浩明,等.增强型绿色荧光蛋白基因真核表达载体的构建[J].四川大学学报,2005,42(2):386-388.
[13] 汪道鑫,虞春华,叶颖俊,等.T淋巴细胞的研究进展[J].第四军医大学学报,2009,30(24):3193-3195.
[14] 杨 红.流式细胞术检测25例肺癌患者T淋巴细胞亚群表型分析[J].中国实用医药,2009,26(4):36-37.
[15] 胡茂志,孟 闯,潘志明,等.流式细胞术在活化T淋巴细胞检测中的应用[J].动物医学进展,2009,30(2):82-85.

