发光费氏弧菌对常用色素的生物毒性评价
郭柔杉,李 翔,潘 力,*
(1.华南理工大学生物科学与工程学院,广东广州510006;2.广东食品药品职业学院,广东广州 510520)
发光细菌法(luminescence bacteria test,LBT)是一种具有快速、灵敏和廉价等优点的直接生物毒性测试方法[1]。发光细菌法的原理是在荧光素酶的催化作用下,菌体中的还原型黄素单核苷酸(FMNH2)和分子氧及一长链醛发生氧化还原反应,生成黄素单核苷酸(FMN)、羧酸(RCOOH)和水,并伴随光释放的过程。理化和生物有毒物质会影响发光菌各类代谢从而改变发光强度。目前,该法常用于检测化学无机毒性物质[2]及有机污染物的毒性[3],水体中人工合成抗生素[4]及生物残留物[5]的单一及联合毒性,以及重金属类毒物[6-7]的毒性研究。而应用于检测食品中有害物质生物毒性方面,除检测三聚氰胺[8]外未见更多报道。因此,本研究拟以常见食品添加剂色素为对象,利用发光费氏弧菌对其生物毒性进行研究,通过发光抑制率的不同来比较不同色素的毒性大小,以期为食品急性生物毒性监测的研究提供初步参考。目前常用色素包括天然色素和人工合成色素,以后者使用居多。而人工合成色素是用煤焦油中分离出来的苯胺染料为原料制成的,故又称煤焦油色素或苯胺色素,如柠檬黄及日落黄等。按国家标准[9]规定,其在果汁饮料中最大使用量为0.1g/kg。这些人工合成的色素因易诱发中毒和腹泻,还存在致畸和致突变的可能[10]。目前检测色素的方法常见的有色谱法[11-12]、分光光度法[13]、单扫描示波极谱法[14]等,除却前处理复杂和成本高等因素外,上述方法均以针对色素本身含量而进行,而无法反映出含色素样品的整体生物毒性。本研究则在综合毒性的评价方面具有优势。本研究选取常用色素红曲红、柠檬黄、日落黄、胭脂红、亮蓝和苋菜红作为天然色素、偶氮类色素和二苯甲烷类色素的代表,通过研究其在水溶液中及在果汁中对发光费氏弧菌发光量的抑制情况来评价其生物毒性。
1 材料与方法
1.1 材料与仪器
费氏弧菌(NRRLB-11177)购于ATCC;菌体保护剂 D-葡萄糖66g、NaCl 4.0g、L-组氨酸2.0g、BSA 0.5g,37℃溶于水,调pH(7.0±0.2),定容到100mL;冻干菌粉活化液 NaCl20g、MgCl2·6H2O 2.035g、KCl 0.30g,溶解后定容到1L,4℃保存;柠檬黄、红曲红、日落黄、胭脂红、亮蓝、苋菜红 市售;液体培养基 NaCl 30g、NaH2PO4·H2O 6.10g、K2H2PO4·3H2O 2.75g、MgSO4·7H2O 0.204g、(NH4)2HPO40.5g、甘油3mL、胰蛋白胨5g、酵母膏0.5g、双蒸水1000mL,调pH(7.0±0.2),分装于锥型瓶中,高压蒸汽灭菌121℃,20min。
SpectraMax M5多功能读板机 美国Molecular Devices(MD);Sartorius PB-10 PH计 德国Sartorius;Philips榨汁机 广东中山飞利浦电子公司;SORVALL生物冷冻离心机 德国Sigma。
1.2 实验方法
1.2.1 发光菌的培养 将发光费氏弧菌接种于在琼脂培养基生长,2~5d后挑取单菌落到新平板上生长,2~5d后接入含有50mL液体培养基的锥形瓶,20℃,180r/min培养21h。
1.2.2 发光菌冻干粉制备 用预冷的离心机离心菌液,(4±2)℃,8000r/min,15min。弃上清液,用预冷氯化钠溶液以10%比例重悬菌体。重复上述操作1~2次,将重悬后菌液转入烧杯,置于冰上,缓慢以5%的比例加入保护剂,混匀。将此菌悬液冻干制备成菌粉,分装后-20℃保存。并使用标准硫酸锌溶液对冻干粉发光度的抑制率进行验证,以确保菌粉发光情况正常。
1.2.3 费氏弧菌测试方法 于制备好的冻干菌粉中每管加入100μL预冷无菌水,静置10min。分别吸取10μL菌液至500μL活化液中,静置15min后,测得费氏弧菌原始发光量。将样品梯度溶液和菌悬液加入96孔白板,采用2%浓度NaCl溶液为空白溶液,测定方法依照费氏弧菌冻干粉检测国际标准ISO11348-3的规定进行,同一浓度样品均平行测定3次,取其平均值后按照1.2.5所示方法计算发光度抑制率。
1.2.4 果汁的制备 将新鲜水果洗净,切块,榨汁,过滤,8000r/min离心5min,滤纸过滤取上清液,备用。
1.2.5 发光抑制率计算方法 发光抑制率Ht的计算公式见式(1)。

式中,Ht—平衡时间下,样品对发光量的抑制率;Ict—加入被测样品前发光菌被校正后的发光强度;It—样品与发光菌在平衡时间下,发光菌的发光强度。
Ict的计算公式见式(2):

式中,I0—被测样品加入前发光菌的发光强度;—校正因子的平均值。

式中,fkt—校正因子;Ikt—空白溶液检测孔的发光强度;I0—在加入空白溶液前发光菌的初始发光量;t—平衡时间;n—检测孔数。
任一校正因子与平均值的偏差百分比计算公式见式(5):

式中,fkti——校正因子中的任一值。
1.2.6 数据统计分析 实验结果采用origin8.0软件中plot项绘制图表,并用fitting中linear项进行拟合,得到线性方程和相关系数。利用excel中STDEVP函数计算出每个样品检测3次后数据的误差限,利用origin8.0软件绘制Yerror图。
2 结果与分析
2.1 不同浓度下各色素对费氏弧菌发光度的影响
为了解色素浓度和费氏弧菌发光抑制率之间的关系,选取六种色素质量浓度依次为1、5、50、100mg/L的溶液,观察其对费氏弧菌发光的抑制情况。将测得的抑制率与色素浓度的对数值进行线性回归得到回归方程,结果如图1(a)所示。
研究发现六种色素溶液的质量浓度与费氏弧菌发光抑制率之间呈正相关,回归方程的相关系数R2在0.8760~0.9873之间,对数据进行误差限分析,结果如图1(b)所示,其误差限范围在0.1595~6.6329之间。表1中体现出各色素回归直线的详细信息。

图1 六种色素对费氏弧菌发光的抑制效应Fig.1 Inhibitory effect of six kinds of pigments on V.fischeri luminescence
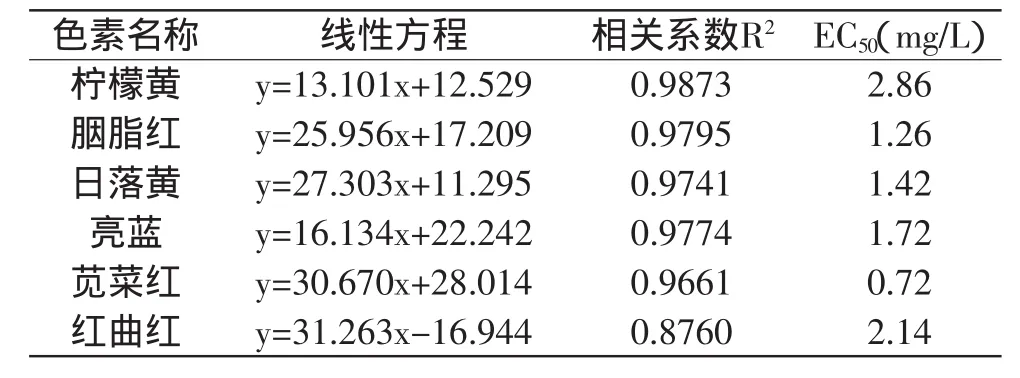
表1 六种色素对费氏弧菌的毒性Table 1 Inhibitory rate of pigments against luminescent intensity of Vibrio fisheri in aqueous solution
结果表明,各色素回归直线的斜率k值表现为:柠檬黄最小,其次为亮蓝,k值最大的为红曲红色素。即随浓度增大,柠檬黄和亮蓝的毒性增加最为平缓,而红曲红色素的毒性随浓度增加,明显增大。由回归方程计算各色素的EC50值,即当抑制率达到50%时所需的色素浓度值,用以作为毒性大小的评判参考。通过方程得到各色素的EC50值在0.72~2.86mg/L之间,其中柠檬黄值最大,苋菜红值最小,表示在食用毒性上添加柠檬黄危害相对较小,而苋菜红毒性相对较大。以上结果表明色素浓度与费氏弧菌发光的抑制存在定量关系,因此可以利用费氏弧菌发光法快速评价其生物毒性。
2.2 果汁中色素对费氏弧菌发光度的影响
为研究色素添加到果汁中对发光菌的发光抑制情况,选取含有色素质量浓度依次为1、5、50、100mg/L的果汁添加到费氏弧菌活化液中,将测得的抑制率与色素的对数浓度进行线性回归,结果如图2(a)所示。对数据进行误差限分析,误差限范围为0.1124~6.0794,如图2(b)所示。根据回归方程得到零等价剂量ZED[14]最大不超过0.04mg/L。
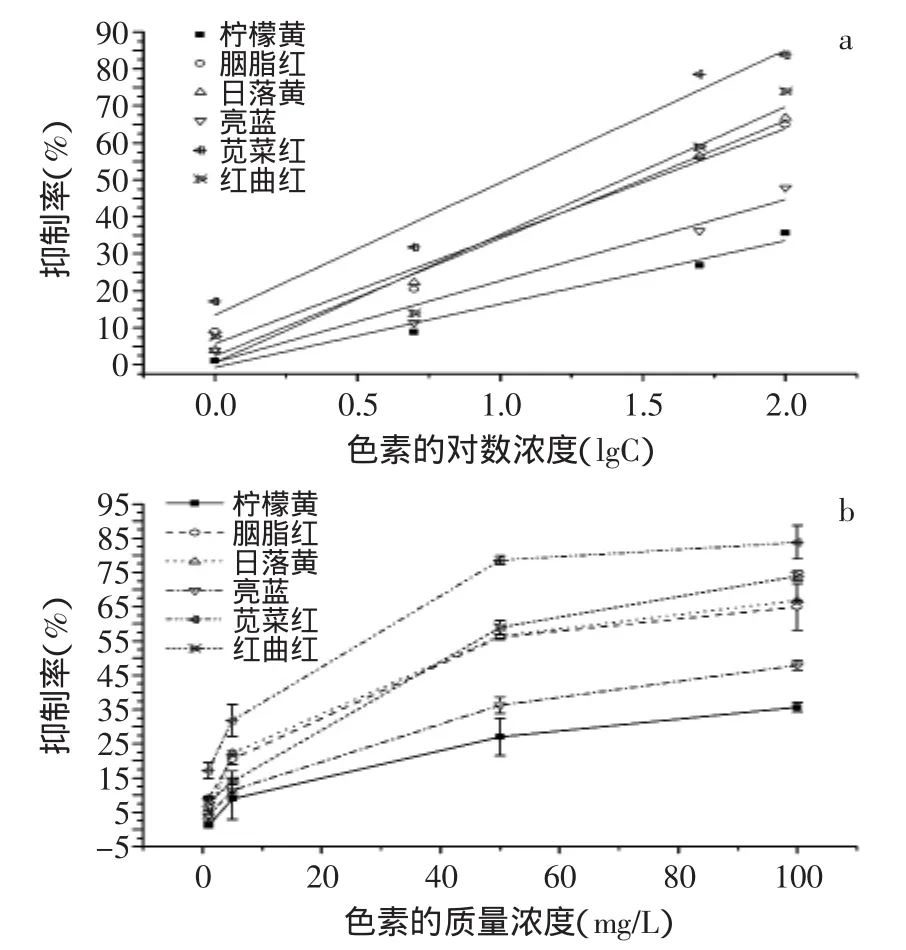
图2 六种色素在果汁中对费氏弧菌发光强度的剂量-效应关系Fig.2 Inhibitory effect of pigments in fruit juice on V.fischeri luminescence
表2中体现出各果汁回归直线的详细信息。研究表明,测定果汁中的色素浓度越大,对费氏弧菌的发光度抑制率越高,两者仍然呈现正相关。同时本研究根据ISO11348-3中对费氏弧菌检测中样品制备的要求,已将鲜榨果汁的pH调节至6.0~8.5范围,然后再添加色素,以此确保检验的准确性。

表2 不同浓度色素在果汁中对费氏弧菌的毒性Table 2 Inhibitory rate of pigments against luminescent intensity of Vibrio fisheri in fruit juice
研究表明,六种色素在果汁中对费氏弧菌发光度的抑制关系线性相关系数在0.9136~0.9951之间。由回归方程计算出EC50值在1.02~2.96mg/L之间,仍旧是柠檬黄的值最大,苋菜红的值最小。EC50值的变化趋势为:人工合成色素在果汁中的EC50增加,而天然色素的EC50降低,说明果汁对人工合成色素生物毒性具有一定的正面影响,对天然色素生物毒性具有一定负面作用。ZED值表现出,柠檬黄与红曲红色素在果汁中的生物毒性较其他色素要小。但本研究中市售天然色素红曲红并未如预计中出现极低的抑制率,反映出该色素在生产中可能添加防腐剂等其他成分,导致对费氏弧菌发光强度出现明显的抑制情况。
为综合研究色素同一浓度下,在水溶液和果汁中对费氏弧菌发光度的抑制情况,特将抑制率做如下对比,如图4所示。
研究发现:首先,色素在果汁中对费氏弧菌的发光抑制率均低于在水溶液中的情况,说明果汁对费氏弧菌发光有一定保护作用。通过研究将鲜榨果汁单独加入发光菌中,发现对发光抑制率出现了负增长,分别体现为:在梨汁中达到-12.3110%、苹果汁中达到-8.0480%、橙汁中达到-5.1803%和柑橘汁中达到-7.5631%。其次,色素在果汁中对费氏弧菌发光抑制率随着色素浓度的增加而快速上升,其上升程度大于色素在水溶液时的影响。说明在果汁中添加色素量应严格遵照相关标准,否则少许超量将引起毒性大幅攀升。最后,无论色素所处溶液环境如何,均没有改变相对的毒性高低,依然显示柠檬黄毒性最弱,苋菜红毒性最强。
3 结论与讨论
研究表明,色素的生物毒性强度可以用发光菌法检测。费氏弧菌发光强度的抑制率与色素的浓度呈正相关,相关系数R2在0.8760~0.9873之间。由EC50值发现,在食用毒性上添加柠檬黄危害相对较小,而苋菜红毒性相对较大。

图4 同一浓度色素在水溶液和果汁中对费氏弧菌发光抑制率Fig.4 The inhibitory rate of six kinds of pigments in different concentrations against luminescent intensity of Vibrio fisheri in fruit juice
果汁中色素的生物毒性强度也可通过发光菌法检测。费氏弧菌发光强度的抑制率与果汁的色素的浓度仍然呈正相关,相关系数在0.9136~0.9951之间。注:1.每种色素对应的并列两柱中,左柱代表色素在水溶液中的发光抑制率,右柱代表色素在果汁中的发光抑制率;2.图4a~d中色素浓度分别为1、5、50、100mg/mL。与费氏弧菌检验有机污染物等研究得到的结果相一致[2],EC50值仍然表现出,柠檬黄毒性较小,苋菜红毒性较大。且果汁对人工合成色素生物毒性具有一定正面影响,对天然色素生物毒性具有一定的负面作用。色素在果汁中对费氏弧菌发光抑制率随浓度增加而上升的幅度明显大于在水溶液中。
上述结果表明色素对费氏弧菌发光强度具有一定影响,体现为浓度和发光抑制率之间存在正相关性,提供了利用费氏弧菌评估色素等食品添加剂生物毒性的初步方法,在评估未知样品的整体毒性时优势则更明显,成为可应用于食品安全的生物检验手段。
[1]韦东普,马义兵,陈世宝.应用淡水发光细菌测定土壤Cu急性毒性的影响因素研究[J].农业环境科学学报,2009(7):1386-1391.
[2]Shahid Parvez, Chandra Venkataraman, Suparna Mukherji.Toxicity assessmentoforganic pollutants: Reliability of bioluminescence inhibition assay and univariate QSAR models using freshly prepared Vibrio fischeri[J].Toxicology in Vitro,2008,22(7):1806-1813.
[3]K Froehner, T Backhaus, LH Grimme.Bioassays with Vibrio fischeri for the assessment of delayed toxicity[J].Chemosphere,2000,40(8):821-828.
[4]T Backhaus,M Scholze,LH Grimme.Vibrio fischeri[J].Aquatic Toxicology,2000,49(1/2):49-61.
[5]Javier Bayo, José M Angosto, M Dolores Gómez-López.Ecotoxicological screening of reclaimed disinfected wastewater by Vibrio fischeri bioassay after a chlorination-dechlorination process[J].Journal of Hazardous Materials,2009,172(1):166-171.
[6]Antje Brack,Jürgen Strube,Peter Stolz,et al.Vibrio fischeri[J].Biochimica et Biophysica Acta(BBA)- General Subjects,2003,1621(3):253-260.
[7]E Fulladosa, JC Murat, M Martínez, et al.Patterns of metals and arsenic poisoning in Vibrio fischeri bacteria[J].Chemosphere,2005,60(1):43-48.
[8]张国辉,赵吉,邵玉琴,等.发光弧菌快速检测液态奶中的三聚氰胺[J].食品科学,2010,31(6):145-147.
[9]中华人民共和国国家标准.GB 2760-2007食品添加剂使用卫生标准[S].中国标准出版社,2007.
[10]蒋利刚,程东,韩晓莹,等.柠檬黄对雄性小鼠生殖细胞的影响[J].生物医学工程研究,2011,30(3):174-176.
[11]杨国先.饮料中合成色素的方法研究[J].食品工业科技,2002,23(3):66-67.
[12]李帮锐,冯家力,潘振球,等.高效液相色谱-质谱/质谱联用法测定饮料中的人工合成色素[J].中国卫生检验杂志,2007,17(4):579-585.
[13]陈晓红,李小平,姚浔平.高效液相色谱-质谱联用法测定饮料中人工合成色素的研究[J].中国卫生检验杂志,2005,15(8):941-942.
[14]皇甫鑫,廖翀,杨坪,等.金属化合物对发光菌的毒性效应及不同发光菌的敏感度差异研究[J].环境科学学报,2010,30(9):1787-1792.

