免疫磁珠富集技术联合选择性培养基快速检测单增李斯特菌
闻一鸣,李志清,童吉宇,向军俭
广东省分子免疫与抗体工程重点实验室 暨南大学抗体工程研究中心,广东 广州 510632
免疫磁珠富集技术联合选择性培养基快速检测单增李斯特菌
闻一鸣,李志清,童吉宇,向军俭
广东省分子免疫与抗体工程重点实验室 暨南大学抗体工程研究中心,广东 广州 510632
闻一鸣, 李志清, 童吉宇, 等. 免疫磁珠富集技术联合选择性培养基快速检测单增李斯特菌. 生物工程学报, 2013,29(5): 672−680.
Wen YM, Li ZQ, Tong JY, et al. Rapid detection ofListeria monocytogenesby immunomagnetic separation combined with selective medium. Chin J Biotech, 2013, 29(5): 672−680.
单增李斯特菌是一种危害极大的食源性致病菌,建立快速及特异的检测方法对于食品安全监控尤为重要。文中联合免疫磁珠与选择性培养基对不同浓度 (101~105CFU/mL) 单增李斯特菌进行检测,并对3种李斯特菌、金黄色葡萄球菌及副溶血弧菌进行交叉试验;同时模拟食物污染,探索免疫磁珠-平板法检测样品的检测限以及该方法的最快检测时间。结果显示特异性免疫磁珠联合选择性平板法可检出浓度为103CFU/mL及以上的单增李斯特菌;牛奶样品仅需6 h增菌能被检出,检测限为0.7 CFU/mL。联合使用免疫磁珠富集技术与选择性培养基,能在30 h内完成对牛奶样品的检测,较国标法减少38 h以上,且具有同等的灵敏度。
单增李斯特菌,免疫磁珠,选择性培养基,检测限
李斯特菌是一类普遍存在于环境中的细菌,而单增李斯特菌则是李斯特菌中唯一的一种人畜共患病致病菌[1],也是常见的食源性致病菌之一[2],它能引起肠胃炎症、脑膜炎、败血病、流产等临床症状,对新生儿、孕妇、老年人及免疫力低下人群的危害尤为严重,致死率高达20%[3-4]。单核增生李斯特氏菌广泛存在于各种食物中,并能在食品加工后的冷冻及真空包装等条件下存活,是食品安全的一大隐患[5-6]。
目前,检测单核增生李斯特氏菌的传统方法是通过对样品进行二次增菌,利用选择性分离培养基和显色培养基进行分离与鉴定。选择性分离培养基如 PALCAM、OXA,或显色培养基如CHROMagar李斯特培养基,它们主要通过成分中的某种物质与细菌的代谢产物发生化学反应并产生颜色变化,从而区分不同的菌株[7-8]。选择性培养基常用于区分不同种属的细菌,但难以鉴别属内的不同菌株;显色培养基具有高特异性的特点,但由于其价格昂贵、检测周期长等缺点,实际应用范围不广。
在检测成分较复杂的样品时 (如食品、水样和土壤),样品的预处理过程是必不可少的环节。免疫磁珠分离技术 (Immunomagnetic separation,IMS) 是一种具有高特异性、快速、操作简便等优势的富集方法[9-10],其原理是磁珠表面的活性基团先与特异性抗体进行偶联,形成免疫磁珠,然后在液相中与目的待测物特异性结合,最后通过磁场作用将待测物分离并收集。该技术根据抗原抗体之间的特异性反应,高效浓缩目的样品,并保留样品原有生物活性,利于下游的检测或应用,因此广泛应用于生物、医药和环境工程等学科,尤其适用于微生物检测的样品前处理[11-12]。
本文先利用免疫磁珠对样品进行特异性筛选及富集,再联合选择性培养基进行微生物学鉴定,最后通过一步增菌法成功检测出液态中的单增李斯特菌;此外,通过模拟受污染食物样品初步确定了该方法在食品检测中的检测限。
1 材料与方法
1.1 主要试剂和仪器
PALCAM 李斯特基础培养基,胰酪胨大豆酵母浸膏肉汤 (TSB-YE),胰蛋白胨大豆肉汤(TSB) 购于广东环凯微生物科技有限公司,纯牛奶购于超市。Dynabeads M-280甲苯磺酸基活化磁珠 (美国Invitrogen公司),混匀仪Dynal-MIX1(美国 Invitrogen公司),磁分离器 (西安北美基因公司),Multiskan酶标仪 (Thermo公司),台式恒温摇荡器 (培英公司),人工气候箱 (广东省医疗器械厂),H-3000N扫描电子显微镜 (日本日立公司)。
1.2 菌株
单增李斯特菌L. monocytogenesCMCC 54002 (血清型 1/2c)、CMCC 54003 (1/2a) 和ATCC 19115 (4b),英诺克李斯特菌 (L. innocuaLI456),威尔斯李斯特菌L.welshimeri,格氏李斯特菌Listeria grayi,副溶血弧菌Vibrio parahaemolyticusATCC 17802,金黄色葡萄球菌Staphylococcus aureusATCC 6538,铜绿假单胞菌Pseudomonas aeruginosaATCC 15442,大肠杆菌Escherichia coliO157: H7 8099和枯草芽胞杆菌Bacillus subtilisATCC 9372。以上所用菌株均由广东省微生物研究所馈赠。
1.3 免疫磁珠的制备
1.3.1 抗体的纯化
运用硫酸铵沉淀及 ProteinG亲和层析法纯化腹水型 1B10A7抗体 (该抗体为实验室前期制备的单增李斯特菌特异性单克隆抗体),SDS-PAGE鉴定纯化后的单克隆抗体,−20 ℃储存备用。
1.3.2 间接ELISA测定抗体效价及抗体特异性分析
以甲醛灭活的浓度为109CFU/mL的LM作为包被抗原,4 ℃孵育16 h;含5%脱脂奶粉的0.015 mol/L PBST封闭酶标板,37 ℃孵育1 h;加入梯度稀释的1B10A7抗体,37 ℃孵育1 h;加入 HRP标记羊抗鼠 IgG抗体,37 ℃孵育30 min;加入TMB底物显色,避光反应10 min;2 mol/L H2SO4终止反应,酶标仪测OD450值;以浓度为108CFU/mL的3种LM (1/2c、1/2a及4b血清型)、英诺克李斯特菌、威尔斯李斯特菌、格氏李斯特菌、金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌O157和枯草芽胞杆菌作为包被抗原,4 ℃孵育 16 h;含 5%脱脂奶粉的 0.015 mol/L PBST封闭酶标板,37 ℃孵育1 h;1B10A7抗体稀释4 000倍作为一抗加入,37 ℃孵育1 h;加入HRP标记羊抗鼠IgG抗体,37 ℃孵育30 min;加入TMB底物显色,避光反应10 min;2 mol/L H2SO4终止反应,酶标仪测OD450值。
1.3.3 磁珠偶联抗体
根据DYNABEADS M-280 TOSYLACTIVATED试剂盒说明书,甲苯磺酰基活化磁珠溶于Buffer A (0.1 mol/L硼酸缓冲液,pH 9.5),加入20 μg的1B10A7单抗和Buffer C (3 mol/L硫酸铵,pH 9.5),37 ℃涡旋孵育18 h;磁分离器分离上清与磁珠,用含有0.5% BSA的0.01 mol/L PBS封闭磁珠,37 ℃孵育1 h;最后重溶于含有0.1%BSA的0.01 mol/L PBS。同理制备无关抗体与磁珠结合,作为阴性对照组。
1.4 IMB-选择性平板法检测单增李斯特菌
1.4.1 LM的培养
分别将3种LM (CMCC 54002、CMCC 54003和ATCC 19115) 接种于TSB-YE液态培养基,置摇床中30 ℃培养18 h。
1.4.2 菌液的稀释
以灭菌的0.01 mol/L PBS对菌液进行梯度稀释。细菌原液浓度约为109CFU/mL,取500 μL原液加入至4.5 mL PBS中,混合后再取500 μL加至4.5 mL PBS中,以相同的方法把菌液稀释到104CFU/mL和103CFU/mL。取50 μL各浓度菌液,涂布于 TSB-YE固体培养基,37 ℃培养24 h,以确定菌浓度。
1.4.3 免疫磁珠捕菌
每种细菌每个浓度各取1 mL与25 μL免疫磁珠 (包括实验组和阴性对照组) 混合,置于Dynal-MIX1混匀仪中37 ℃反应1 h;0.01 mol/L PBST洗涤2次,磁分离器分离上清;免疫磁珠重溶于50 μL PBS,涂于无菌的PALCAM固体培养基中;37 ℃孵育24 h,计算细菌的数量。
1.4.4 扫描电镜下观察免疫磁珠与单增李斯特菌的结合
取1 mL浓度为104CFU/mL的LM (CMCC 54002) 与25 μL免疫磁珠在37 ℃下反应1 h,2.5%戊二醛洗 1次,磁分离除去上清;2.5%戊二醛处理样品,室温下静置2 h,磁分离弃上清,PBST洗3次;磁分离弃上清,PBST洗3次;30%、50%、70%、85%、95%和100%乙醇脱水各2次;乙酸异戊酯置换2次;临界点干燥器处理对样品进行CO2临界点干燥;干燥后的样品经喷金后置于扫描电镜下观察。
1.4.5 IMB-PALCAM灵敏性分析
接种LM于TSB-YE液体培养基,置摇床中30 ℃培养18 h。参照1.3.2的方法,把菌液浓度稀释至浓度为 105、104、103、102、101CFU/mL。取50 μL各浓度菌液,涂布于TSB-YE固体培养基,37 ℃培养24 h,以确定菌的浓度。免疫磁珠捕菌步骤参照1.3.3。
1.4.6 IMB-PALCAM交叉性分析
英诺克李斯特菌、格氏李斯特菌和威尔斯李斯特菌分别接种于TSB-YE液体培养基,金黄色葡萄球菌接种于胰蛋白胨大豆肉汤,副溶血弧菌接种于含3%氯化钠的LB培养基中,接种后置于摇床中30 ℃培养18 h。参照1.3.2,把各种菌株的菌浓度调至104CFU/mL,每种菌各取1 mL与25 μL已偶联1B10A7单抗的磁珠反应,同时取1 mL同样浓度的菌液与25 μL偶联无关抗体的磁珠反应,37 ℃孵育1 h,0.01 mol/L PBST洗2次,重溶至50 μL PBS,涂布于PALCAM平板,置于37 ℃培养箱培养24 h。次日计算平板上菌落数。
1.5 IMB-PALCAM检测人工污染食品样品
1.5.1 IMB-PALCAM 检测不同浓度人工污染牛奶样品
接种LM于5 mL TSB-YE液体培养基,于摇床中培养18 h;次日以无菌PBS倍比稀释菌液,菌浓度调至102CFU/mL水平,再进行倍比稀释 (2×、4×、8×和 16×),每浓度各取 1 mL 菌液与9 mL纯牛奶混合,作为人造食物污染样品。每个浓度下的样品各取1 mL,加入到9 mL无菌的TSB-YE液体培养基中培养,30 ℃培养24 h;次日,每个浓度各取1 mL菌液与20 μL免疫磁珠于37 ℃下反应1 h,PBST洗2次,磁分离后溶解于50 μL PBS,涂于PALCAM培养基中,于37 ℃培养箱中培养24 h后,计数。
1.5.2 IMB-PALCAM 检测不同增菌时间下的人造污染牛奶样品
接种LM于5 mL TSB-YE液体培养基,于摇床中培养18 h;次日以无菌PBS倍比稀释菌液,菌浓度调至低于 10 CFU/mL水平,设置 6个不同增菌时间的实验组,分别加入1 mL该浓度下菌液和9 mL纯牛奶,增菌2 h、4 h、6 h、8 h、10 h和12 h。增菌后每组各取1 mL牛奶样品与20 μL免疫磁珠反应,步骤参照1.5.1。
1.6 数据分析方法
本实验数据经Microsoft Excel与SPSS处理。
2 结果
2.1 腹水型鼠源单克隆抗体的纯化效果及效价测定
将纯化后的 1B10A7鼠源单抗进行 SDSPAGE,后经考马斯亮蓝染色,在55 kDa和25 kDa附近有明显条带,且杂带较少,抗体纯度较高。经间接 ELISA测定,甲醛灭活 LM与 1B10A7鼠源单抗特异性结合,抗体效价约为1.6×104。
2.2 腹水型鼠源单克隆抗体的特异性分析
如图1所示,1B10A7鼠源单抗与3种血清型的LM菌存在较好的反应性,与非单增李斯特菌株反应性较弱,但该抗体与英诺克李斯特菌和金黄色葡萄球菌存在一定的交叉反应。
2.3 免疫磁珠-选择性平板法 (IMB-PALCAM)检测3种单增李斯特菌的结果
如表1所示,IMB-PALCAM检测3种不同血清型的LM均呈阳性结果。
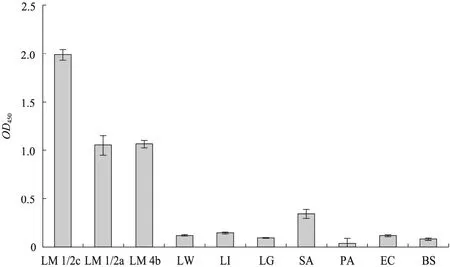
图1 1B10A7单抗特异性分析Fig. 1 Specificity analysis of 1B10A7 monoclonal antibody. LM 1/2c: Listeria monocytogenes CMCC54002; LM 1/2a: Listeria monocytogenes CMCC54003; LM 4b: Listeria monocytogenes ATCC19115; LW: Listeria welshimeri; LI:Listeria innocua; LG: Listeria grayi; SA: Staphylococcus aureus; PA: Pseudomonas aeruginosa; EO: Escherichia coli O157: H7; BS: Bacillus subtilis.
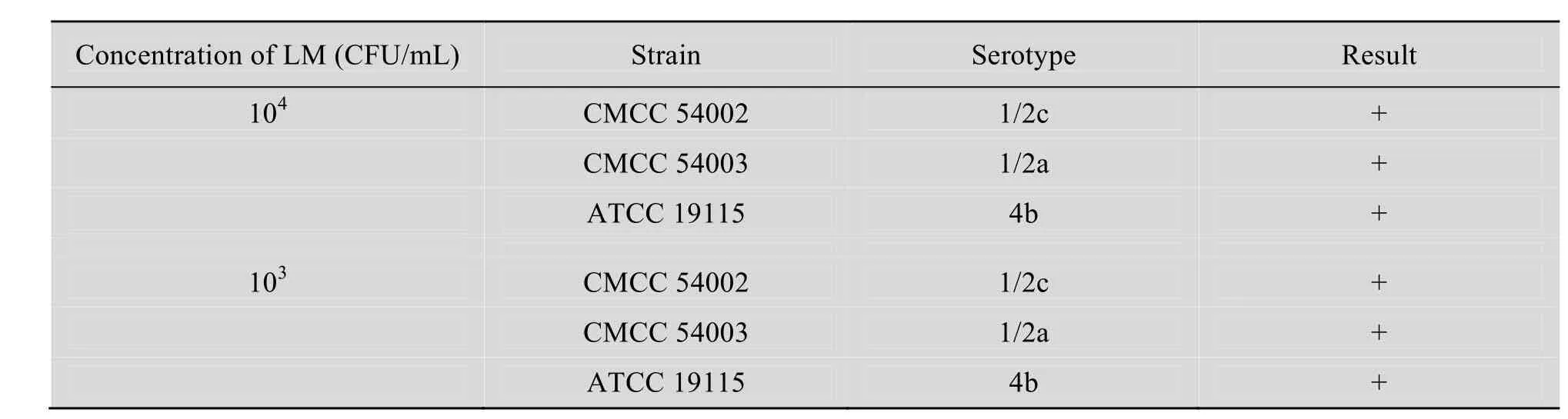
表1 IMB-PALCAM检测不同血清型LMTable1 Detection of Listeria monocytogenes of different serotypes by IMB-PALCAM
2.4 扫描电镜下观察免疫磁珠与单增李斯特菌的结合
免疫磁珠与LM菌体在PBS中结合,经过戊二醛固定及乙醇梯度脱水后,在扫描电子显微镜(SEM) 下观察两者的结合,结果如图2所示,粒径为2.8 μm的磁珠与抗体偶联后,能在液态中与LM 表面的抗原表位结合,形成复合物,说明制备的免疫磁珠能成功捕获LM。
2.5 IMB-PALCAM法灵敏性分析结果
IMB-PALCAM法检测101~105CFU/mL浓度下的LM,结果如表2所示,该法能检测浓度为103CFU/mL以上的LM;对于浓度在102CFU/mL及以下水平的 LM,则无法检出。因此IMB-PALCAM 法检测 LM 的检测限确定为103CFU/mL。

图2 扫描电镜下观察免疫磁珠与单增李斯特菌的结合Fig. 2 Combination of immunomagnetic beads and Listeria monocytogenes in SEM. (A) LM were captured by immunomagnetic beads. (B) Control (Immunomagnetic beads only).
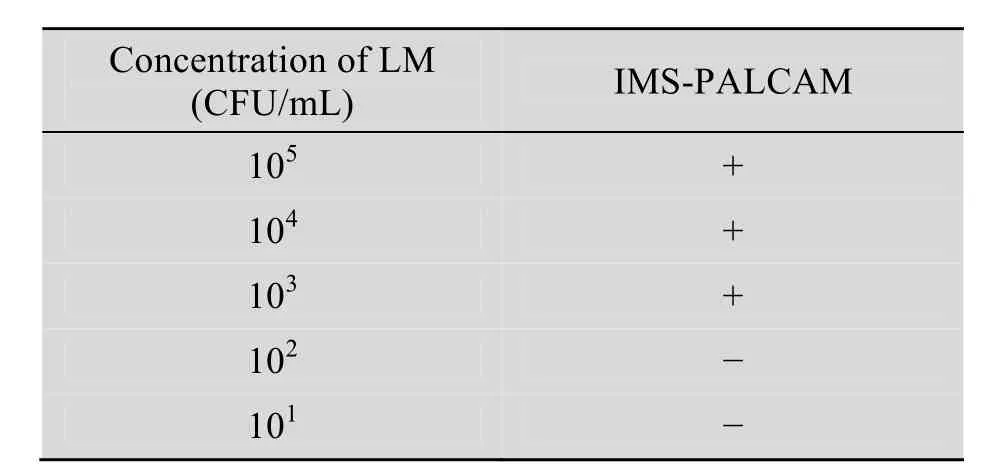
表2 IMB-PALCAM灵敏度分析Table 2 Sensitivity analysis of IMB-PALCAM
2.6 IMB-PALCAM法交叉性分析结果
经培养16 h以上包括单增李斯特菌、英诺克李斯特菌、格氏李斯特菌、威尔斯李斯特菌在内的李斯特菌属能在PALCAM固体基础培养基上形成灰黑色菌落,金黄色葡萄球菌形成浅黄色菌落,而副溶血弧菌却不形成肉眼可见的菌落(图3)。经过IMB-PALCAM方法检测104CFU/mL下的各种细菌,发现英诺克李斯特菌与金黄色葡萄球菌存在一定的交叉作用,其中英诺克李斯特菌形成与 LM 相似的灰黑色菌落,金黄色葡萄球菌则形成浅黄色菌落,从肉眼上能与LM区分开。
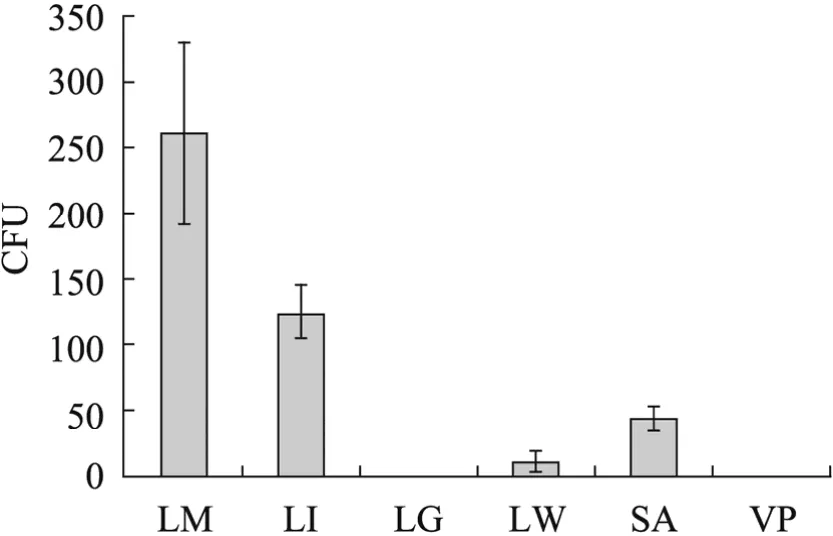
图3 IMB-PALCAM法检测不同种细菌的交叉反应分析Fig. 3 Cross reaction analysis of IMB-PALCAM on different bacteria. LM: Listeria monocytogenes; LI:Listeria innocua; LG: Listeria grayi; LW: Listeria welshimeri; SA: staphylococcus aureus; VP: Vibrio parahaemolyticus; CFU: colony forming unit.
2.7 IMB-PALCAM 检测人造食品污染样品结果
2.7.1 IMB-显色培养基法检测不同浓度人造污染牛奶样品
如表3所示,通过模拟制造受LM污染的食物样品,经24 h增菌,IMB-PALCAM法能检测到LM浓度为102CFU/mL以下的受污染牛奶样品,检测限为6 CFU/mL。
2.7.2 IMB-显色培养基法检测不同增菌时间下的人造污染牛奶样品
随着受污染牛奶样品增菌时间的延长,免疫磁珠的捕菌数量增加,且呈现正相关。当增菌时间在6 h、8 h、10 h和12 h时,IMS-显色培养基法能捕获增菌后牛奶中的LM (表4)。

表3 IMB-PALCAM法检测牛奶样品中的LMTable 3 Detection of Listeria monocytogenes using IMB-PALCAM in milk samples
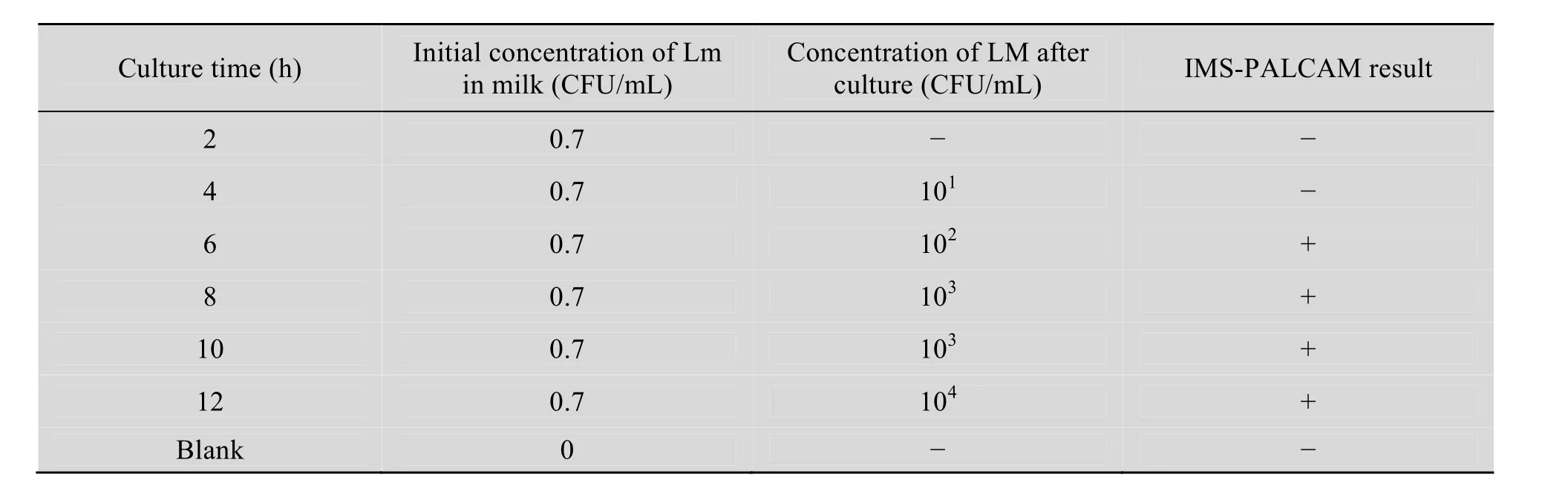
表4 IMB-PALCAM法检测增菌时间不同的牛奶样品Table 4 Detection of milk samples in different culture time using IMB-PALCAM
3 讨论
本实验室在前期已制备单增李斯特菌特异性抗体的过程中,已成功筛选出几株各具特点的单抗,它们主要能够识别经甲醛灭活后LM的抗原表位,其中只有1B10A7细胞株所分泌的抗体能识别活菌表面抗原表位,并具有较高的亲和力[13],从而适用于制备单增李斯特菌特异性免疫磁珠且应用于平板检测法。
本研究应用IMS-PALCAM法检测LM,当菌浓度高于103CFU/mL时,免疫磁珠的捕菌率在2%以上,能从1 mL菌液中富集到102CFU以上的 LM;当菌浓度低于 103CFU/mL时,IMS-PALCAM法难以直接鉴别菌液中的LM,国外有报道指出,免疫磁珠富集技术与平板培养法联用的检测限在102~103CFU/mL之间[14-15],由于在受污染食品中含菌量相对较低,或细菌活性不佳,IMS-PALCAM 法检测食物样品时,仍需要对样品进行预增菌[16]。
单核增生性李斯特菌是一种常见的食源性致病微生物,能导致严重的食源性疾病且具有致死性,在牛奶、芝士、海鲜等多种食物中均有检出[17-18],因此针对该菌的食品检测与监控尤为重要[19]。传统国标法主要通过二次增菌法对LM分离培养,结合选择性平板及生化鉴定进行检测,结果准确,但耗时较长,需要3~7 d;近年发展起来的显色培养基鉴别法与API Listeria法则加快了检测速度,但仍然需要二次增菌,且检测成本较高。本文研究的免疫磁珠-选择性平板法具有快速检测、步骤简单、结果可靠的特点,对于含菌量在102CFU/mL以下的牛奶样品,经6 h增菌后就能鉴定样品是否染菌。
然而,由于LM与英诺克李斯特菌存在较高的同源性[20-21],1B10A7单抗不仅能特异性结合LM,还与英诺克李斯特菌存在交叉反应,推测该单抗识别的是这两种李斯特菌表面的共有表位。若需进一步区分两种菌,可利用李斯特显色培养基或 API Listeria等方法进行后续验证。Wadud等[22]应用免疫磁珠与显色培养基(IMS-ALOA) 检测LM,但由于该方法所需的显色培养基成本较高,应用范围不广。Yang等[23]结合IMS和实时荧光PCR的方法建立了一套快速的检测方法,但该方法对仪器和实验条件的要求甚高,不利于普及应用。相比之下,本研究中所建立的检测方法更适和用于进行食物样品的初步筛选,为相关的食品安全检测与监控奠定了基础。
[1]Gasanov U, Hughes D, Hansbro PM, et al. Methods for the isolation and identification ofListeriaspp.andListeria monocytogenes: a review. FEMS Microbiol Rev, 2005, 29(5): 851−875.
[2]Farber JM, Losos JZ.Listeria monocytogenes: a foodborne pathogen. Can Med Assoc J, 1988,138(5): 413−418.
[3]Wing EJ, Gregory SH. An updated model of cell-mediated immunity-listeriosis: clinical and research aspects. Allergy Asthma Proc, 2000,21(4): 209−214.
[4]Liu DY. Identification, subtyping and virulence determination ofListeria monocytogenes, an important foodborne pathogen. J Med Microbiol,2006, 55(6): 645−659.
[5]Schlech WF 3rd, Luo Q, Faulkner G, et al.Interaction ofListeriaspecies with human cell monolayers. Clin Invest Med, 1994, 17(1): 9−17.
[6]Mead PS, Slutsker L, Dietz V, et al. Food-related illness and death in the United States. Emerg Infect Dis, 1999, 5(5): 607−625.
[7]Reissbrodt R. New chromogenic plating media for detection and enumeration of pathogenicListeriaspp. -an overview. Int J Food Microbiol, 2004,95(1): 1−9.
[8]Notermans SH, Dufrenne J, Leimeister-Wächer M,et al. Phosphatidylinositol-specific phospholipase C activity as a marker to distinguish between pathogenic and nonpathogenicListeriaspecies.Appl Environ Microbiol, 1991, 57(9): 2666−2670.
[9]Pyle BH, Broadaway SC, McFeters GA. Sensitive detection ofEscherichia coliO157:H7 in food and water by immunomagnetic separation and solid-phase laser cytometry. Appl Environ Microbiol, 1999, 65(5): 1966−1972.
[10]Safarik I, Safarikova M. Magnetic techniques for the isolation and purification of proteins and peptides. Biomagn Res Technol, 2004, 2(1): 1−7.
[11]Corchero JL, Villaverde A. Biomedical applications of distally controlled magnetic nanoparticles.Trends Biotechnol, 2009, 27(8): 468−476.
[12]Gracias KS, McKillip JL. A review of conventional detection and enumeration methods for pathogenic bacteria in food. Can J Microbiol, 2004, 50(11):883−890.
[13]Li ZQ. Production of antibodies of high specificity and affinity for constitutively and stably expressedListeriamonocytogenessurface antigens [D].Guangzhou: Jinan University, 2012 (in Chinese).
李志清. 单增李斯特菌特异性的膜表面蛋白的抗体的制备[D]. 广州: 暨南大学, 2012.
[14]Ripabelli G, Sammarco ML, Grasso GM.Evaluation of immunomagnetic separation and plating media for recovery ofSalmonellafrom meat. J Food Prot, 1999, 62(2): 198−201.
[15]Uyttendaele M, Van Hoorde I, Debevere J. The use of immuno-magnetic separation (IMS) as a tool in a sample preparation method for direct detection ofL.monocytogenesin cheese. Int J Food Microbiol,2000, 54(3): 205−212.
[16]Stevens KA, Jaykus LA. Bacterial separation and concentration from complex sample matrices: a review. Crit Rev Microbiol, 2004, 30(1): 7−24.
[17]Dalton CB, Austin CC, Hayes PS, et al. An outbreak of gastroenteritis and fever due toListeria monocytogenesin milk. N Engl J Med, 1997,336(2):100−105.
[18]Johansson T, Ahola-Luttila H, Pirhonen T, et al.Improved detection ofListeria monocytogenesin soft
[19]mould-ripened cheese. J Appl Microbiol, 2000,88(5): 870−876.
[20]Zhang JL, Yang LX. Foodborn pathogenic contamination status and detection methods ofListeria monocytogenes. J Med theor & Prac, 2012,25(8): 910−911 (in Chinese).
张加林, 杨林娴. 单增李斯特菌的食源性污染状况及检测方法. 医学理论与实践, 2012, 25(8):910−911.
[21]Carroll SA, Hain T, Technow U, et al.Identification and characterization of a peptidoglycan hydrolase, MurA, ofListeria monocytogenes, a muramidase needed for cell separation. J Bacteriol, 2003, 185(23): 6801−6808.
[22]Popowska M. Analysis of the peptidoglycan hydrolases ofListeria monocytogenes: multiple enzymes with multiple functions. Pol J Microbiol,2004, 53(Suppl): 29−34.
[23]Wadud S, Leon-Velarde CG, Larson N, et al.Evaluation of immunomagnetic separation in combination with ALOAListeria chromogenicagar for the isolation and identification ofListeria monocytogenesin ready-to-eat foods. J Microbiol Meth, 2010, 81(2): 153−159.
[24]Yang H, Qu LW, Wimbrow AH, et al. Rapid detection ofListeria monocytogenesby nanoparticle-based immunomagnetic separation and real-time PCR. Int J Food Microbiol, 2007,118(2): 132−138.
October 19, 2012; Accepted: December 18, 2012
Junjian Xiang. Tel: +86-20-85223259; E-mail: txjj@jnu.edu.cn
广东省部产学研结合项目 (No. 2010B090301037) 资助。
Rapid detection ofListeria monocytogenesby immunomagnetic separation combined with selective medium
Yiming Wen, Zhiqing Li, Jiyu Tong, and Junjian Xiang
Guangdong Province Key Laboratory of Molecular Immunology and Antibody Engineering,Antibody Engineering Center of Jinan University,Guangzhou510632,Guangdong,China
Listeria monocytogenesis a pathogenic bacterium, therefore, it is essential for food safety monitoring to establish a rapid and specific detecting method. In this study, immunomagnetic beads and selective medium were combined to detectListeria monocytogenesat different concentrations (101−105CFU/mL). Other three types ofListeriaspp.,Staphylococcus aureusandVibrio parahaemolyticuswere also detected to conduct the cross-reaction analysis. Meanwhile,contaminated milk samples were prepared to explore the limit of detection of immunomagnetic beads combining with selective medium. Results showed thatListeria monocytogenes with the concentration of 103CFU/mL and above was successfully detected. Milk samples were detected within 6 hours, with a detection limit of 0.7 CFU/mL. The method developed is capable of detecting milk samples within 30 h, which is 38 h faster compared with national standard method with the same sensitivity.
Listeria monocytogenes, immunomagnetic beads, selective plating, limit of detectiond
Supported by: Produce-Learn-Research Projects of Education Department in Guangdong Province (No. 2010B09301037).
(本文责编 陈宏宇)

