一种复合芽孢菌制剂对富营养化污水的净化作用研究
李剑锋,高中文,符佳精,雷健美,肖兵南,※
(1.湖南民康生物技术研究所,湖南长沙 410125;2.湖南省宁乡县畜牧水产品检测中心,湖南宁乡 410600)
1 引言
养殖小区鱼塘的水体有机化合物含量过量,超出水微生物转化能力,就会形成水体富营养化,使得水体中浮游藻类和其他水生植物大量繁殖,导致水体溶解氧下降,水体呈现蓝色、红色、棕色、乳白色等水质恶化的现象(Ferreira et al.,2011)。
生物处理法是一种比较经济有效的手段,可通过调节水体环境的微生态平衡修复被污染的水体(张锡辉等,2003)。近年来,国外众多学者致力于对富营养化水体的生物净化研究,已开发出多种有效的环境生物制剂,如美国研究者研制的Clear-Flo系列、利蒙LLMO系列微生物制剂,以及日本Higa博士研制的EM制剂等 (Devaraja et al.,2002;Mayer et al,2010;Higa,1991)[1]。面对我国水资源污染日益严峻的形势,开发一种多效的生物制剂变得尤为重要。因此,本研究从污染水样品中筛选出的4株高效除氮磷、较强去除C O D能力的菌株,分别培养,制备成复合菌制剂,经对富营养化的养殖小区池塘污水进行处理试验,测定其活性和效能,以期为复合菌制剂的实际应用提供科学依据。
2 材料和方法
2.1 菌种
菌种由本研究所分离[2]和保存。分离样品来源于长沙市郊区富营养化的鱼塘淤泥和污水。
2.2 培养基[3]
2.2.1 合成污水:按杨小龙等(2 0 1 2)[4]报道的方法,制备合成污水培养基:富营养化池塘淤泥水和猪场废水按1∶2比例混匀后,静置2~3 d,取上清液灭菌待用。
2.2.2 液体培养基:葡萄糖5g/L,酵母粉0.5g/L,NaCl1g/L,KNO30.36g/L,(N H4)2S O40.235g/L,KH2PO40.44g/L,MgSO4·7H2O0.37g/L,CaCl20.05g/L,微量元素(Mohamed et al.,1999)1mL/L,pH=7.0。
2.2.3 固体培养基:麦麸300g、豆粕粉600g、细糠100g、酵母浸膏0.4g、(NH4)2SO43.2g、MnSO40.6g、K2HPO46g、KH2PO43g、MgSO41g、Fe2(SO4)30.1g、CaCO32g,pH=7。
2.3 菌种培养[5,6]
2.3.1 液体培养:侧孢芽孢杆菌、地依芽孢杆菌、短小芽孢杆菌和纳豆芽孢杆菌4菌株经活化后,活化种子液分别以5%的接种比例量接于100mL液体培养基中,分别培养24h和48h,取样稀释涂布平板,30℃培养48h,进行活菌计数.重复实验两次,每次设置3组平行,分析菌株生长情况。在此基础上,确定培养条件,对选用的菌株进行培养。
2.3.2 固体培养:对4种菌,分别用消毒的固体培养基按10%的比例接种液体培养菌,30℃培养24h和48h,取样平板培养计数菌含量。
2.4 菌种制剂[7~9]
2.4.1 液体扩大培养与菌粉制剂
2.4.1.1 液体扩大培养:按1 0%接种量取复合菌种子液,离心后菌体接入装有300mL复合培养基的500mL三角瓶中,同上条件培养,得到二级种子液。以豆粕(60g/L),糖蜜(30g/L)为原料配制扩大培养液在20L种子发酵罐中灭菌后,接入发酵30~36h.发酵条件:温度30℃,pH7.0,搅拌转速350r/min,罐压 0.11Mpa。
2.4.1.2 菌种吸附制剂:发酵液中加入无菌的沸石粉,吸附2h后低温离心,收集沉淀;沉淀经37℃干燥、粉碎、过筛后真空包装,常温保藏.采用菌落平板计数法,检测固定化前后复合菌中活菌数变化,即液体培养吸附菌剂。
2.4.2 固体扩大培养与菌种制剂:按10%的比例接种灭菌固体培养基中,进行浅盘发酵,发酵36~48h,发酵条件:30℃,相对湿度80%。发酵物料经4 5℃真空干燥、粉碎、过筛后,采用菌落平板计数法,检测干燥化前后各菌中活菌数变化;按比例称取4种菌物料混合均匀,真空包装,常温保藏,即固体培养菌净水粉剂。
2.5 菌种净水效果测定[10~11]
2.5.1 复合菌和单菌对合成废水的净化能力比较
按5%接种量取单一菌和复合菌种子液,离心后菌体经无菌水洗涤,接入合成废水中,30℃、120r/min下振荡培养,设置3个平行,每隔12h取样测定培养液的OD600及培养液中的COD、N H4+-N、NO3--N、NO2--N的含量,比较复合菌和单菌分别对合成废水的净化效果。
2.5.2 复合菌对池塘净水效率的测定
(1)实验室测定:采集富营养化的池塘淤泥水,搅拌混匀静置,取上清液15L分装于20L的容器中,随即测定其各指标初始浓度,并以40mg/L的投放量接入复合菌剂,搅拌后置于露天常温(24~33℃)下,每隔2 4 h搅拌一次,取样测定水中pH、COD、NH4+-N、OD等指标的变化情况,连续测定5 d.重复3次,根据结果判定复合菌剂的效能。
(2)池塘测定:用液体发酵菌剂和固体发酵菌剂分别对2口严重污染(程度相似)的鱼塘进行净化,按每立方水2g,按料液比1∶100兑水,全塘泼洒。测定泼洒前后水质变化。
2.6 分析方法[4,11]
化学需氧量(COD)的测定采用快速消解分光光度法,硝态氮(N O3--N)的测定采用紫外分光光度法,亚硝态氮(NO2--N)的测定采用N-(1-萘基)-乙二胺分光光度法,铵态氮(N H4+-N)的测定采用纳氏试剂比色法,总磷(TP)的测定采用钼酸铵分光光度法,溶解氧(DO)的测定采用碘量法,菌体生长量的测定采用浊度法 (OD600)(国家环保总局,2002)。
3 结果
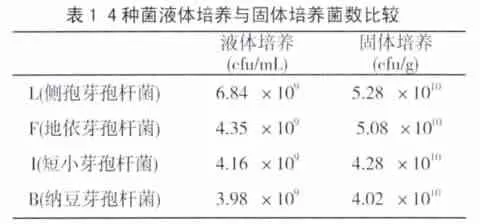
3.1 菌株培养
为了提高除磷能力,用本试验分离了一株具有较强聚磷能力的地衣芽胞杆菌F,与菌株L和B、I三种菌分别培养2 4 h后,经检测,四株菌活菌数含量高(见表1)。同时,菌F与菌株B、I、L进行复合培养,结果发现,菌株F和菌株B、I、L之间存在较明显的协同作用。因此,选择菌株F和菌株B、L、I作为复合菌菌种进行复合培养,得到复合菌种子液。
?
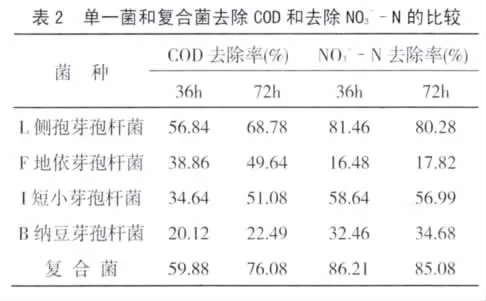
3.2 单菌和复合菌对污水的净化能力测定
3.2.1 实验室测定:检测了所筛选的4株菌及其复合菌对硝态氮(NO3--N)的去除效果。结果发现,菌株L的去除N效率较高(表2)。在对初始C O D和N O3--N分别为4998.86mg/L与72.82mg/L的污水处理72h后,COD和NO3--N的去除率分别达68.78%和80.28%。其他三株菌COD和NO3--N的去除率分别为 49.64%、17.82%,51.08%、56.99%,22.49%、34.6 8%。复合菌去 COD和NO3--N的效果最强,比任何单一菌株好,对COD和NO3--N的去除率达76.08%和85.08%。
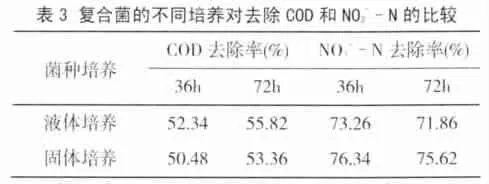
3.2.2 固体培养与液体培养复合菌对污水净化效果测定
?
复合菌的液体培养和固体培养物分别对污染程度相似的二口鱼塘进行净化,按每立方水2g,以料液比1∶100兑水,全塘泼洒。测定泼洒前后水质变化,对COD和N O3--N的去除率分别达55.82%、53.36%和71.86%、75.62%(见表3)。
?
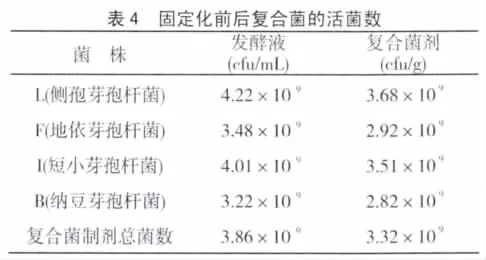
3.3 复合菌吸附与未吸附对池塘污水的净化效果
3.3.1 固化对菌活力影响的测定:采用菌落平板计数法检测了液体培养吸附前后复合菌中4株菌的活菌数变化(表4),结果发现,吸附后得到的复合菌剂中四株菌的活菌数可达到1 09cfu/g,保持了较高的活菌数水平,说明该吸附制剂方法可行。同样,测定固体培养干燥前后4种菌的活菌数,活菌含量达6 5%。
?
3.3.2 固化复合菌剂对富营养化池塘的净化效果测定:利用每立方米水2 g固化复合菌剂对富营养化池塘污水进行了处理试验发现,处理5d后,水质得到了极大改善,明显优于处理前.其水的pH值稳定在6.5~7.0之间,COD、NH+4-N、NO-2-N及T P的去除率均达80%以上(表5);其中,DO含量在实验中也下降,但相对幅度小,主要是由于复合菌中的菌株属于好氧菌,在生长中消耗了水中的溶解氧。
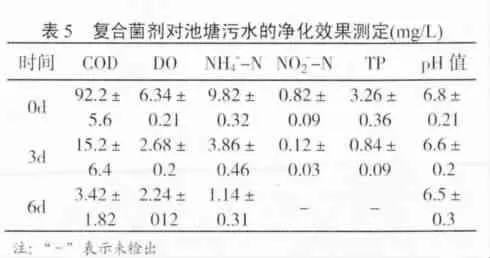
?
4 讨论
复合菌剂是基于微生态学理论,利用微生物菌群的联合作用,由两种或两种以上有益的且互不拮抗的微生物菌种制备的活菌制剂。研究证明,复合菌群在工业、农业和畜牧业方面有着重要的作用。1982年,Higa博士研制出一种由七大类微生物组成的E M制剂,该菌剂具有分解废料残渣中有机物、改善生物生长环境等多种生物活性,在农业、畜牧业及环保等方面应用较多[12]。E M菌剂的研制成功引起了各国研究者对复合菌技术的关注,尤其在养殖业和环保领域。Yang等(1997)采用复合微生物细胞固定化颗粒对初始水溶性化学需氧量 (SCOD)和铵态氮分别为250mg/L和26mg/L的合成废水进行处理,SCOD与铵态氮去除率分别为9 6%和8 4%。周家正等(2009)以蜡样芽胞杆菌、乳杆菌、水单胞菌等组成的复合制剂采用高效复合生物反应器(HBR)处理污水后,污水中COD去除率可达58.0%~77.3%,氨基氮去除率为55%~89%;彭智平等[13](2011)CMP、PMP、FMP等3种复合菌剂对猪场沼液处理后,TP、COD、N H4+-N的最高去除率分别达83.0%、54.9%、48.4%。由于污水是一个多重污染的环境,单一的微生物只能解决其中一个或者部分问题,因而针对污水的特点,选用特定微生物组成的菌群进行处理是一种有效的途径。
环境中兼具去除COD和N、P等多效去除能力的微生物较少[14]且不容易分离,本文采用定向筛选方法,从污染水中分离出了具有除N、P,以及降低COD能力的菌株,对之间无拮抗作用的菌株进行复合培养,得到的复合菌可以高效去除污水中的COD和无机盐氮,去除效果优于单菌。复合菌固定后制备的复合菌剂在污水样品处理中展现出了良好的效果,对富营养化池塘污水处理5d后,COD和NH4+-N去除率分别达94.65%、78.32%,T P和N O2--N去除率均达100%,这为高浓度有机氮污水处理提供了一种有效可行的方法。
5 结论
5.1 从富营养化废水中分离到4株具有高效去除C O D活性的菌株L将其用于合成废水处理,72h后COD和N O3--N的去除率分别达6 8.7 8%%和8 0.2 8%,经形态、生理生化鉴定,初步鉴定侧孢杆菌(Bacillus laterosporus Laubach).
5.2 将菌株L与地衣芽胞杆菌(Bacillus Subtilis)、短小芽孢杆菌(Bacillus pumilus Meyer and Gottheil)、纳豆芽孢杆菌(Bacillus natto)进行复合培养,结果发现,复合菌剂不但具有了单菌的优良去除活性,而且较大地提高了单菌对污染物的去除效果。
5.3 本文所建立的复合菌剂生产方法保持了复合菌剂中菌株较高的活菌数水平(达到1 09c f u/m L以上),且复合菌剂在对富营养化池塘污水样品的处理中显示出了较好的活性和处理效能。 □
[1]Devaraja T N,Yusoff F M,Shariff M.Changes in bacterialpopulations and shrimpp roduction in ponds treated with commercialmicrobial products[J].Aquaculture,2002,206:245~256.
[2]高中文,雷健美,肖兵南,等.养殖小区池塘水净化菌的分离与净化特性研究[J].湖南畜牧兽医,2013,(1):6~8.
[3]Chen Y,Yang X L,Cao Y S.Study on isolation,identificationand phosphate accumulating capacity of Arthrobacter sp.[J].Journal of Anhui Agricultural Science,2011,39(1):447~450(in Chinese)
[4]杨小龙,李文明,曹郁生,等.一种复合菌制剂对富营养化污水的净化作用研究,环境科学学报,2012,32(9):2071~2076.
[5]Diaz-Ramireza I J,Escalante-Espinosaa E,Favela-Torres E,et al.2008.Design of bacterial defined mixed cultures for biodegradation ofspecific crude oil fractions,using population dynamics analysis byDGGE[J].International Biodeterioration&Biodegradation,62:21~30
[6]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[7]Dong X Z,Cai M Y.Common Manual of Systematic DeterminativeBacteriology[M].Beijing:Science Press(in Chinese),2001.
[8]Endo T,Nakano M.Influence of a probiotic on productivity,meatcomponents,lipidmetabolism,caecalflora and metabolites,andraising environment in broiler production[J].Anim Sci J,1999,70(4):207~218.
[9]Ferreira J G,Andersen Jh,Borja A,et al.2011.Overview ofeutrophication indicators to assess environmental status within the european marine strategy framework directive[J].Estuarine,Coastal and Shelf Science,93(2):117~131
[10]Grady CPL,Daigger Jr G T,Limh C.张锡辉,刘勇弟,译.废水生物处理(第2版)[M].北京:化学工业出版社,2003.
[11]国家环保总局(SEPA).2002.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社,2002,246~250.
[12]Higa Teruo.Effective microorganisms:a biotechnology for mankind[A].First International Conference on Kyusei Nature Farming[C].Washington.1991:8~12。
[13]彭智平,李文英,杨少海,等.微生物菌剂处理猪场沼液效果研究[J].中国农学通报,2011,27(1):366~369.
[14]Peng ZP,LiWY,Yang Sh,et al.Study on treatment of piggery biogas slurry with microorganism preparation[J].ChineseAgricultural Science Bulletin,2011,27(1):366~369(in Chinese).

