血管内支架置入术治疗症状性颅内动脉狭窄的临床研究
曹炳华 胡新星 秦 超* 程道宾 叶子明 陈相任 林翠婷王天宝 方烂基
(广西医科大学第一附属医院1神经内科,2放射科,南宁市 530021)
脑血管病是造成人类死亡和致残的重要原因,其中75%~85%是缺血性脑血管病。越来越多的研究证明动脉狭窄是缺血性脑卒中的一个重要病变基础。在我国,缺血性脑卒中患者中颅内动脉狭窄者约占1/3[1],尽管采用抗血小板或抗凝治疗,但因颅内血管狭窄所致的卒中率仍高达10% ~24%[2]。近年来血管内支架成形术治疗症状性颅内动脉狭窄日趋成熟,但仍存在不少问题。本文对68例颅内动脉狭窄的患者行血管内支架置入术,报告如下。
1 资料与方法
1.1 一般资料 收集2009年2月 至2012年10月在我院神经内科住院经DSA确诊为颅内动脉中重度狭窄患者68例,男57例,女11例,年龄22~81岁,平均年龄(59.6±11.9)岁,其中大脑中动脉狭窄18例,颈内动脉颅内段狭窄18例,基底动脉狭窄11例,椎动脉颅内段狭窄21例,双侧颈内动脉颅内段狭窄7例,双侧椎动脉颅内段狭窄1例;临床诊断为TIA患者6例,后循环缺血患者16例,脑梗死患者46例,除1例22岁患者外,其余患者皆有一个或多个动脉粥样硬化危险因素,既往有高血压者39例,糖尿病者16例,高脂血症者25例,高同型半胱氨酸(HCY)者16例,所有患者入选条件均符合介入神经放射诊断治疗规范Ⅱ[2]。
1.2 影像学及手术前、后评估 所有患者均行头颅CT/MRI检查,并根据患者的病情需要,在征得患者及家属的同意后进行常规的全脑血管造影术,明确责任病灶处血管狭窄的程度及侧支代偿的情况,颅内动脉血管狭窄率的测量采用华法令-阿司匹林症状性颅内动脉病变(WASID)标准计算,狭窄程度=(狭窄部近心端正常血管直径Dn-狭窄部血管直径Ds)/狭窄部近心端正常血管直径Dn×100%,显示脑血管有一定程度狭窄,狭窄范围在70% ~90%,支架置入前后均行TCD检查及NIHSS评分。
1.3 治疗方法 术前3~5 d常规服阿司匹林肠溶片100~300 mg/d和硫酸氢氯吡格雷片75mg/d。术前2 h泵入尼莫同,3 ml/h(视血压调速)。术中行局麻23例,全麻45例、全身肝素化以保证激活凝血时间为正常水平的2.5~3倍(200~250 s),密切监测生命体征。以改良Seldinger穿刺法行股动脉逆行穿刺,置入6F动脉鞘,在超滑导丝引导下送入椎动脉造影管至弓上各血管,分别行选择性脑动脉造影,通过导丝导管交换技术,把6F的导引导管置于颈内动脉或椎动脉颈段,在路图指引下,将微导丝通过狭窄段,置于狭窄段远端合适部位并固定,沿微导丝引入支架,小心通过狭窄段,行造影再次明确支架定位后,以压力泵扩张球囊使支架跨狭窄段完全释放,68例患者73处狭窄均采用美国Wingspan支架,支架释放后经导引导管造影,评估血管血流改善情况。
1.4 术后处置 术后患者在 ICU中严密监护24~48 h,右下肢制动,术后4 h拔鞘,加压包扎至24 h;抗凝3 d(低分子肝素0.4 mL,皮下注射,每12 h/次或阿加曲班1支,静脉滴注,每天2次);继续泵入尼莫同,3 m l/h(视血压调速),维持3 d;术后第3天复查头颅CT、TCD;同时用阿司匹林 100 mg/d和氯吡格雷75 mg/d至少3个月。
1.5 随访 对出院病人进行短期(3~6月)随访,统计术后临床脑血管事件的发生率。
1.6 统计学方法 用SPSS 16.0统计软件对数据进行分析,术前术后患者狭窄率采用计量资料的配对t检验,NIHSS评分采用秩和检验(非正态分布资料),检验水准为 α =0.05。
2 结果
68例患者共置入73枚支架,其中3例因颅内血管过度迂曲,支架未能达到狭窄部位,手术成功率为95.59%。术后2例出现新发颅内缺血事件,2例出现颅内出血,其余患者均反应良好,围手术期并发症发生率为6.15%。术后患者临床症状及体征有不同程度的改善。术前术后DSA狭窄率比较[(78.61% ±8.15%)、(18.14% ±4.79%),P <0.05]差异有统计学意义,术前术后 NIHSS 评 分 比 较 [(5.48% ± 1.38%),(2.31% ±0.97%),P <0.05]差异有统计学意义。各动脉段支架置入前后影像学表现见图1~图4。
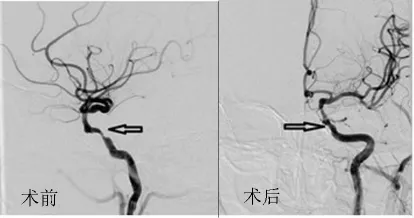
图1 颈内动脉颅内段支架置入前后

图2 椎动脉颅内段支架植入前后

图3 大脑中动脉颅内段支架置入前后
3 讨论
3.1 颅内动脉狭窄支架置入术的有效性及成功率 本组68例患者共置入73枚支架,其中3例因颅内血管过度迂曲,支架未能达到狭窄部位,手术成功率为95.59%,余支架置入均一次成功,支架位置准确,膨胀良好,血流通畅。颅内血管支架置入后管腔狭窄明显改善,远端血管分支明显增加,临床症状及体征得到改善,NIHSS评分较术前降低,术后狭窄率得到明显改善(见图)。截止2000年,一个多中心治疗的统计结果显示,共行CAS治疗4 757例,随访6~12个月,仅1.42%的患者发生同侧脑缺血事件[3]。目前国内外已有相当数量的报道证实了脑动脉狭窄成形术的成功率和有效性[4,5],只要严格掌握适应证,选择合适的病例、材料和方法,并进行术前多方位的评估等,就有可能获得满意的疗效。但是由于颅内血管解剖位置的特殊性,血管弯曲多,个体差异性大,故术前对病变血管走形及狭窄部位的定位尤为重要。Mori等[6]提出了颅内动脉狭窄A、B、C三型,分型依据血管狭窄的长度、成角及是否有偏心。其后姜卫剑等[7]也提出了LMA分型,分型依据手术路径的弯曲程度。这些分型为术前评估介入治疗技术的成功率提供了客观依据。本组1例因椎动脉V4段严重迂曲,支架受阻于此,为避免损伤小脑后下动脉而终止手术,2例支架受阻于颈内动脉虹吸段,为避免强行通过血管歪曲部位而损伤动脉内膜,加上该部位极易导致支架变形,定位及打开亦相对困难,权衡利弊后决定放弃治疗。可见术前评估手术入路及分型尤为重要。同时手术的成功率与支架的选择也有一定关系。近年来wingspan自膨式支架的运用,极大提高了手术的成功率,D Fiorella等[8]总结了 82 例 Wingspan支架置入病例,手术实施成功率达98.8%。本组68例患者共73处动脉狭窄部位均置入Wingspan支架,手术成功率达95.59%,与文献报道相接近。
3.2 颅内支架置入术安全性及并发症的防治 血管内支架置入的围手术期严重并发症主要包括:过度灌注综合征(hyperperfusion syndrome,HS)、急性血栓形成、血管破裂和远端血管栓塞等,其他还有血管痉挛和穿刺相关并发症等;导管导丝相关的并发症由于材料及制造工艺的进展已甚为少见;远期并发症主要是再狭窄。
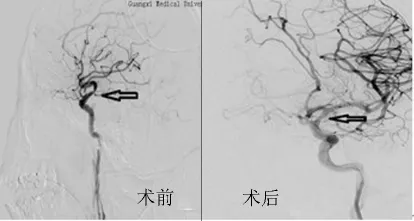
图4 基底动脉支架植入前后
3.2.1 高灌注 本组2例发生颅内出血,其中1例发生于术中,是因微导丝刺破豆纹动脉所致;1例发生于术后,考虑为高灌注所致。术后均急查头颅CT显示蛛网膜下腔出血及脑实质出血,患者病情严重,预后差,其家属放弃治疗。由于颅内动脉走行曲折;动脉壁薄,缺乏弹性;周围无软组织包绕、支撑,故颅内支架成形术易发生颅内出血。Terada等报道了106例颅内血管成形术,其中4例(3.77%)于术中至术后发生脑出血。鉴于上述情况,可采取以下方法降低颅内血管破裂的发生率[9]:①选用相对小的支架或球囊,这样可以避免对颅内血管的过度扩张;②尽量选用柔软度高的球囊扩张支架,或选用颅内专用的自膨式支架,对血管的损伤小;③球囊扩张或支架释放时,球囊充盈速度不宜过快,压力不宜过高;④手术过程中时刻保持所有介入材料头端在术者视野中,特别是导引导丝的头端。另外术后高灌注综合征易发生于动脉严重狭窄、多处狭窄同时开通或血压控制不佳的患者,故避免同时处理多处狭窄,严格控制术后血压≤120/80 mmHg是非常必要的举措[10]。
3.2.2 血栓或板块脱落 本组2例患者术后偏身肌张力增高,肌力较术前明显减低,CT及MRI提示新发脑梗死,考虑为狭窄段血管血栓脱落或支架部位斑块脱落所致,经抗血小板聚集、改善微循环、稳定斑块、降脂、控制血压、康复理疗等处理,出院时仅遗留有轻微的肢体瘫痪。Ogasawara等[11]认为CAS中栓子的危险性与斑块的性质及狭窄的严重程度有关,低回声斑块及大于90%的严重狭窄可导致较大数目的栓子颗粒。随着保护伞及滤器保护技术的逐渐应用,有效地降低了此并发症的发生率。相关研究表明,CAS术中使用保护装置可将因斑块脱落所造成的脑栓塞风险从5.5%降低到1.8%[12],同时熟练掌握导丝导管技术,选择合适的球囊和支架对于防止栓塞的发生也非常重要。
综上所述,本研究结果表明,通过血管内支架置入术治疗颅内血管狭窄是安全的、有效的,创伤性小,成功率高,近期疗效明显,远期疗效尚有待进一步随访观察。
[1] Wong KS,Huang YN,Gao S,et al.Intracranial stenosis in Chinese patients with acute stroke[J].Neurology,1998,50(3):812-813.
[2] Chimowitz MI,Lynn MJ,Howlett-Smith H,et al.Comparison ofwarfarin and aspirin for symptomatic intracranial arterial stenosis[J].New England Journal of Medicine,2005,352(13):1305-1316.
[3] Wholey MH,Wholey M,Mathias K,et al.Global experience in cervical carotid artery stent placement[J].Catheterization and Cardiovascular Interventions,2000,50(2):160 -167.
[4] 黄清海,刘建民,洪 波,等.血管内支架成形术治疗颅内动脉狭窄的中期随访结果[J].介入放射学杂志,2004,13(3):224 -227.
[5] Levy EI,Hanel RA,Bendok BR,et al.Staged stent-assisted angioplasty for symptomatic intracranial vertebrobasilar artery stenosis[J].Journal of Neurosurgery,2002,97(6):1294-1301.
[6] Mori T,Kazita K,Chokyu K,et al.Short-Term arteriographic and clinical outcome after cerebral angioplasty and stenting for intracranial vertebrobasilar and carotid atherosclerotic occlusive disease[J].American Journal of Neuroradiology,2000,21(2):249 -254.
[7] 姜卫剑,杜 彬,王拥军,等.症状性颅内动脉狭窄的造影分型与支架成形术[J].中华内科杂志,2004,42(8):545-549.
[8] D Fiorella,EI Levy,AS Turk,et al.USmulticenter experience with the wingspan stent system for the treatment of intracranial atheromatous disease periprocedural results[J].Stroke,2007,38(3):881 -887.
[9] 殷 勤,徐格林,刘新峰.支架成形术治疗症状性颅内动脉粥样硬化性狭窄的并发症及其防治[J].中国脑血管病杂志,2010,(1):36 -39.
[10] JiangWJ,Wang YJ,Du B,etal.Stenting of symptomatic M1 stenosis ofmiddle cerebral artery:an initial experience of40 patients[J].Stroke,2004,35(6):1375 -1380.
[11] Ogasawara K,Mikami C,Inoue T,et al.Delayed cerebral hyperperfusion syndrome caused by prolonged impairmentof cerebrovascular autoregulation after carotid endarterectomy:case report[J].Neurosurgery,2004,54(5):1258 -1262.
[12]白晓娟.颈动脉狭窄血管内支架置入安全性的系统评价[J].中国组织工程研究与临床康复,2009,13(17):3304-3307.

