野木瓜三萜皂苷类化合物抗炎活性研究
张 伦 ,杨光忠 ,欧泽亮 ,杨 芳,王德彬*
(1.中南民族大学 药学院,武汉 430074;2.拜尔斯道夫日化有限公司 研发部,武汉 430056)
野木瓜又名假荔枝根、假荔枝、绕绕藤、沙藤,为木通科野木瓜属植物[1].其根、茎、叶具有祛风止痛及舒筋活络的功效,临床用于各种手术止痛及肿瘤止痛,对风湿痛、各种神经性头痛、腰椎骨质增生等疗效显著[2].野木瓜中含有丰富的皂苷,主要包括去甲五环三萜皂苷类化合物[3-6]、木脂素类化合物[7-8]和黄酮苷类化合物[9],此 外,还含有多糖、酚类化合物[10-11]等.已有研究表明野木瓜注射液具有抗炎镇痛作用[12-13].本课题组前期从野木瓜藤茎正丁醇部位分离得到的两个三萜皂苷类化合物1、2,已有文献对化合物1做了初步的抗肿瘤研究[14-15],化合物2 的活性研究未见报道.因此,本研究拟对这两个三萜皂苷类化合物进行抗炎活性筛选,并探讨其可能存在的机制.
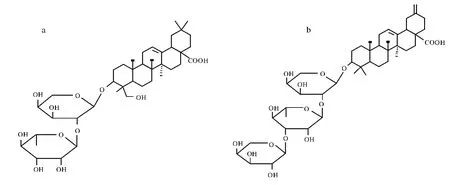
图1 化合物的结构a.化合物1;b.化合物2Fig.1 The structure of the compounds a.3-O-α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranosyl-hederagenin;b.3-O-α-L-arabinopyranosyl-(1→3)-α-L-rhamnopyranosyl-(1→2)-α-L-arabinopyranosyl-akebonic acid
1 材料与方法
1.1 细胞株
小鼠巨噬细胞RAW264.7由本室冻存.
1.2 材料和试剂
野木瓜藤茎购自广西南宁,经广西壮医医院副主任药师黄锦威鉴定为木通科野木瓜属植物,化合物1和2为课题组从其正丁醇提取物中分离出来,它们的结构经1H NMR,13C NMR 和ESIMS 确证[6,14].LPS、地塞米松、Hochest33258(美国sigma公司);胎牛血清(四季清公司);DMEM 培养基(美国Gibco公司);Griess试剂盒(碧云天公司);小鼠IL-1β试剂盒(达科为生物技术有限公司);其余试剂均为国产分析纯.
1.3 仪器
InfiniteM200型酶标仪;DFC425C(12730222)型荧光倒置显微镜.
1.4 方法
1.4.1 RAW264.7细胞培养及传代小鼠RAW264.7巨噬细胞加入含10%胎牛血清、100U/mL青霉素和链霉素的DMEM 培养基,置于含5%CO2、37 ℃恒温培养箱中培养.细胞生长至70%~80%融合后进行传代,1~2d换液1次,3~4d传代1次.
1.4.2 MTT 法检测药物对细胞活性的影响 按文献[16]中 的MTT法,测定化合物1,2对小鼠巨噬细胞RAW264.7的细胞毒活性.将生长状态良好的RAW264.7细胞以每孔95μL(约1×104个)传代培养于96孔板中,置于含5%CO2、37℃恒温培养箱中培养2~3h,细胞贴壁后,加入不同浓度的化合物5μL,使其终浓度达到0,2.5,5,10,20,40,80μmol·L-1.溶剂对照组不加化合物,但加入DMSO 使其终浓度为0.2%(与高浓度化合物所含的DMSO 终浓度相同).每组4个复孔.37℃,5%CO2的恒温培养箱中培养72h 后,加入MTT 孵育4h后,弃上清,每孔加入DMSO 150μL,震荡10min,在492nm 处检测吸光度A492.
1.4.3 实验分组 将RAW264.7细胞悬液调整浓度为1×104个/孔,加入96孔板内,每孔85μL,每组4个复孔,置37℃、5%CO2孵箱培养.根据MTT检测结果,实验分为6 组.各组处理方法:①正常组,只加培养基培养;②模型组,只加LPS,终浓度为10μg/mL;③阳性对照组,分别加入终浓度为10μg/mL LPS和10μmol·L-1地塞米松;④低、中、高剂量组,分别加入终浓度为10μg/mL LPS和5、10、20μmol·L-1化合物.
1.4.4 Griess法测定一氧化氮含量 按照1.4.3处理,培养72h后取细胞上清液采用Griess法,按NO 检测试剂盒说明书操作.
1.4.5 ELISA 检测IL-1β含量 根据Griess法检测结果,选取化合物1按照1.4.3处理,培养72h后取细胞上清液采用ELISA 法,按试剂盒说明书操作.
1.4.6 Hochest33258荧光染色对细胞凋亡形态学观察 通过Hochest33258 荧光染色法观察化合物1促进炎性细胞凋亡的作用.按照1.4.3处理,培养72h后弃上清,D-Hanks溶液洗一遍(尽量不吹打),加入固定液(甲醇∶冰醋酸=3∶1)200μL/孔,4℃处理5 min 后用D-Hanks溶液洗一遍(尽量不吹打),加入5μg/mL Hochest33258染液50μL/孔,37℃孵育15~30min后,置于荧光倒置显微镜下观察,拍照.
1.4.7 统计学分析数据用表示,采用GraphPadPrism 统计软件,多组间比较采用单因素方差分析,组间比较采用t检验,P<0.05为有统计学意义.
2 结果与分析
2.1 药物对细胞活力的影响
MTT实验结果显示,化合物1,2在0~20μmol·L-1浓度对RAW264.7细胞活力的影响与空白对照组相比,均无显著性差异.说明化合物1,2在 这个浓度范围内对RAW264.7细胞无毒性,该结果为后续试验提供依据,本研究所使用的药物有效浓度,均在这一浓度范围之内.
2.2 化合物1,2对炎性细胞NO 释放的影响
图2a 显示不同浓度化合物1 对LPS 刺激RAW264.7细胞释放NO 的影响;图2b显示不同浓度化合物2对LPS刺 激RAW264.7细胞释放NO的影响.由图2可知,正常组中RAW264.7细胞上清液NO 水平很低,给予10μg/mL LPS诱导72h后,NO 水平显著增加.而实验组NO 释放受到明显抑制,并呈现一定的剂量依赖关系,化合物1,2在高剂量20μmol·L-1时抑制NO 释放的强度高于阳性对照药地塞米松(10μmol·L-1),且在高剂量时化合物1表现出较强的活性.
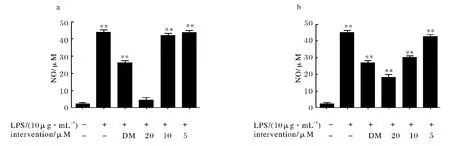
图2 不同浓度化合物对LPS刺激RAW264.7细胞释放NO 的影响(与正常组比较:**P<0.01;与模型组比较:##P<0.01)Fig.2 The influence of produce NO with different concen trations of compounds in RAW264.7macrophages stimulated by LPS(Compared with the normal group:**P<0.01;Compared with the model group:##P<0.01)
2.3 化合物1对炎性细胞IL-1β产生的影响
IL-1β的分泌与药物的浓度呈剂量依赖性关系,药物高浓度对IL-1β的抑制率最高,随用药浓度的降低对IL-1β的抑制率逐渐下降.与模型组相比,化合物1在高、中、低三个浓度均对IL-1β的产生有强抑制作用,显示出强的抗炎活性.结果见图3.
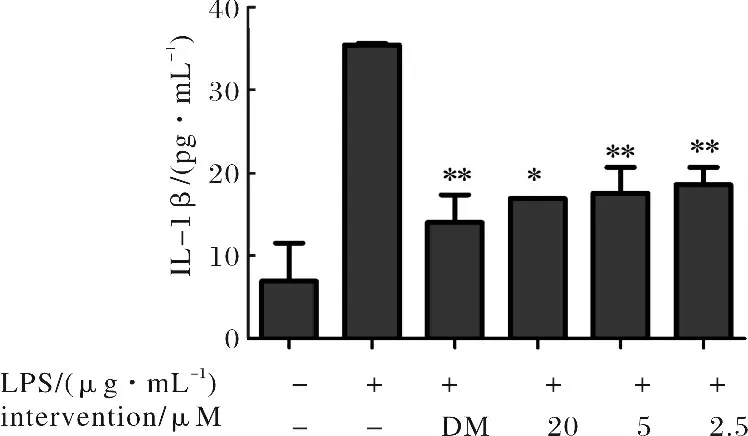
图3 不同浓度化合物1对LPS刺激RAW264.7细胞释放IL-1β的影响(与模型组比较:*P<0.05,**P<0.01)Fig.3 The influence of produce IL-1βwith different concen trations of compound 1 in RAW264.7macrophages stimulated by LPS(Compared with the model group:*P<0.05,**P<0.01)
2.4 化合物1促进炎性细胞凋亡的形态学观察
图4a、4b分别为正常组、炎症模型组细胞形态,细胞呈微弱荧光;图4c~4f分别为阳性对照组、高浓度组、中浓度组、低浓度组细胞形态,其中正常细胞呈微弱荧光,凋亡细胞呈强蓝色荧光且染色体固缩.给予不同浓度药物可以观察到不同程度的细胞凋亡现象,高浓度组观察到了大量发出高亮荧光的固缩染色体,有明显的细胞凋亡现象.

图4 皂苷化合物1促进炎性细胞凋亡的形态学观察(4a:正常细胞组;4b:LPS诱导组;4c:地塞米松组;4d:高浓度组;4e:中浓度组;4f:低浓度组)Fig.4 The observation of apoptosis with compound 1 in RAW264.7macrophages stimulated by LPS(4a:normal cell group;4b:LPS induced group;4c:dexamethasone group;4d:high dose group;4e:medium dose group;4f:low dose group)
3 讨论
巨噬细胞是重要的抗炎免疫细胞,它在非特异性免疫、体液免疫以及肿瘤免疫等方面起着重要作用.LPS是巨噬细胞最有效的激活剂,LPS诱导的RAW264.7细胞模型已经被广泛用于炎症反应研究.当RAW264.7 细胞受到LPS 的刺激时,可分泌大量炎症因子.IL-1β是激活的巨噬细胞分泌的主要炎症因子之一,在炎症和免疫反应中发挥非常重要的作用;一氧化氮(NO)是具有生物活性的气体分子,是细胞间信息传递的重要调节因子,并有介导细胞免疫和炎症毒性的功能.NO 的过量生成与炎症密切相关[17],在急性炎症部位,致炎物质和炎症介质可诱导或增加NO 的合成和释放,NO 本身具有细胞毒性,还能与游离基团反应生成如ONOO-等的分子,导致毒性增加,从而促进炎症部位渗出和水肿[18].本实验采用LPS 诱导小鼠RAW264.7细胞建立炎症细胞模型,通过观察野木瓜三萜皂苷类化合物1、2 对炎性细胞产生NO、IL-1β的影响,发现两种化合物均剂量依赖性抑制NO释放,且化合物1能抑制IL-1β的产生.
在炎症反应过程中,中性粒细胞和其它的滞留细胞通过凋亡机制,在膜完整状态下被巨噬细胞识别和清除,从而避免继发的炎症反应.凋亡,是机体调控炎症反应的发展和防止炎症后组织器官损伤与瘢痕形成的重要机制.近年来发现急性胰腺炎与胰腺腺体细胞凋亡有关[19-21],细胞凋亡参与了急性胰腺炎的发病[22-23].在众多研究中也发现炎症时细胞损伤释放的一些无机小分子、细胞因子、炎症介质及毒性物质作用均会影响细胞的凋亡.这些细胞活性分子及一些应激因素参与细胞的凋亡过程,在引导细胞凋亡的基因调控方面具有重要的意义[24].本研究观察到不同浓度化合物1 均可促进炎性细胞发生凋亡,且高浓度时细胞凋亡明显,推测可能是炎症反应中炎症灶内NO、IL-1β等炎症因子促进细胞凋亡,限制了炎症反应的扩大.
本文通过野木瓜两种三萜皂苷化合物抑制炎性细胞NO,IL-1β等炎症因子的释放进行抗炎活性筛选,两种三萜皂苷化合物均具有一定的抗炎活性,其中化合物1具有较强的抗炎活性,其发挥抗炎作用的机制可能是通过抑制炎性因子的释放进而促进炎性细胞的凋亡来实现的,本研究为进一步探讨野木瓜抗炎活性成分奠定了基础.
[1]江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,2001:2185-2186.
[2]刘 勇,刘贤旺,范崔生.野木瓜本草考证[J].江西中医学院学报,2004,16(6):54-55.
[3]王淮宾,于德泉,梁晓天,等.野木瓜YM10和YM12的结构[J].药学学报,1989,24(6):444-451.
[4]Wang H B,Yu D Q,Liang X T,et al.Yemuoside YM7,YM11,YM13,and YM14:four nortriterpenoid saponins from Stauntonia chinensis[J].Planta Medica,1989,55(3):303-306.
[5]Wang H B,Yu D Q,Liang X T,et al.Struetures of two nortnterpenoid saponins from stauntonia chinensis[J].Journal of Natural Products,1990,53(2):313-318.
[6]Wang H B,Yu D Q,Liang X T.Yemuoside I,a new nortnterpenoid glycoside from stauntonia chinensis[J].Journal of Natural Products,1991,54(4):1097-1101.
[7]Wang H B,Yu D Q,Liang X T,et al.The structures of two ligan glyeosides from stauntonia chinensis[J].Journal of Natural Products,1989,52(2):342-345.
[8]Wang H B,Yu D Q,Liang X T,et al.The structures of a new neolignan glyeoside from stauntonia chinensis[J].Journal of Natural Products,1992,55(2):214-216.
[9]王淮宾,于德泉,梁晓天,等.野木瓜黄酮成分的分离和鉴定[J].中草药,1992.23(11):567-569.
[10]杨 磊,高 昊,王乃利,等.野木瓜酚性成分研究[J].中国药物化学杂志,2007,17(4):242-245.
[11]王文平,郭祀远,李 琳,等.野木瓜中多糖提取工艺研究[J].食品科技工艺技术,2007(1):99-101.
[12]张孝友,谭毓治,赵诗云.野木瓜片镇痛抗炎作用的实验研究[J].广东药学院学报,1998,14(3):195-196.
[13]Peng X L,Gao X L,Chen J,et al.Effects of intravenous injections paederiae and stauntonia on spontaneous pain,hyperalgesia and inflammation induced by cutaneous chemical tissue injury in the rat[J].Acta Physiol,2003,55:516-524.
[14]To D C,Tran M H,Mi K L,et al.Cytotoxic compounds from the roots of pulsatilla koreana[J].Natural Product Sciences,2009,15(4):250-255.
[15]蒋 丹,高其品,屠鹏飞.预知子化学成分及生物活性研究[D].长春:东北师范大学,2006.
[16]李喜艳,王加启,魏宏阳,等.MTT 比色法检测赖氨酸、蛋氨酸对体外培养的奶牛乳腺上皮细胞增殖的影响[J].生物技术通报,2010,20(3):143-148.
[17]Lala P K,Chakraborty C.Role of nitric oxide in carcinogenesis and turn our progression[J].Lancet Oncol,2001,2(3):149-56.
[18]王翔岩,齐 云,蔡润兰,等.肉苁蓉多糖的巨噬细胞活化作用[J].中国药理学通报,2009,25(6):787-90.
[19]Kaiser A M,Saluja A K,Lu L,et al.Effects of cycloheximide on pancreatic endonuclease activity,apoptosis,and severity of acute pancreatitis[J].Am J Physiol,1996,271:C982-C993.
[20]Mayakovsky A S,Perkins P,Zaninovic V,et al.Mechanisms of cell death after pancreatic duct obstruction in the opossum and the rat[J].Gastroenterology,1996,110:875-884.
[21]Kaiser A M,Saluja A K,Sengupta A,et al.Relationship between severity,necrosis,and apoptosis in five models of experimental acute pancreatitis[J].Am J Physiol,1995,269:C295-C1304.
[22]袁耀宗,龚白华,楼恺娴,等.生长抑素及Octreotide对急性胰腺炎细胞凋亡的作用机制[J].中国危重病急救医学,2000,12:402-405.
[23]吴泽建,张阳德,雷正明,等.细胞凋亡在大鼠急性胰腺炎发病机制的探讨[J].中国现代医学杂志,2003,13:13-15.
[24]张喜平,林 谦.急性胰腺炎时炎症介质与细胞凋亡关系的研究进展[J].世界华人消化杂志,2005,13(23):2773-2777.

