低氧对发育期幼鼠大脑皮层GAP-43表达的进行性影响
陈燕 张春来 余广 赵春玲
(泸州医学院生理教研室,四川 泸州 646000)
阻塞性睡眠呼吸暂停低通气综合征(Obstructive sleep apnea hypopnea syndrome,OSAHS)是儿童常见的睡眠问题,对儿童健康危害较大,在儿童中可引起多种并发症[1]。国外流行病学调查显示[2],OSAHS在儿童中的发病率为1%~3%。儿童OSAHS与成人有很大差异,是一个独立的临床综合征。目前,对儿童OSAHS的研究远没有成人广泛,尚有很多问题需要解决。生长相关蛋白(GAP-43)是研究神经生长发育和损伤修复的重要标记物之一。目前,许多利用成年大鼠制作的各种脑损伤模型都观察到GAP-43表达的变化。然而,关于生长发育期幼鼠缺氧性脑损伤后,这一反映损伤后修复的重要指标有何变化,尚未见相关报道。因此,本实验选择21 日龄的幼鼠,通过模拟OSAHS 的典型病理生理特征,建立慢性间断性低氧(CIH)幼鼠模型,观察CIH 幼鼠在生长发育的不同时间点大脑皮层GAP-43表达的变化,以探讨这些变化与神经元损伤修复间的关系。
1 材料与方法
1.1 实验动物与分组
健康雄性21日龄Stragu-Dawley幼鼠60只,体质量50±5 g,由泸州医学院动物科提供(动物合格证号:SYXK(川)2004-065)。随机分为对照组和慢性间断性低氧组(CIH 组),每组30只,每组又分为2,4,6w3个时间点,每个时间点10只幼鼠。
1.2 方法
1.2.1 CIH 幼鼠模型复制
参照杨宇[3]等的方法制作CIH 幼鼠模型。将CIH 组幼鼠每日置于自制的缺氧舱内,舱内放入大量碱石灰和硅胶以吸收二氧化碳和水蒸气,舱壁留有小缝隙与舱外相通,使舱内气压与大气压平衡。实验期间,每天9∶00a.m.~5∶00p.m.向箱内循环充入氮气和排出混合空气,每次循环6min,通过HBO-2B型控氧仪(浙江建德梅城电化分析仪器厂)监测缺氧舱内的氧浓度以程控输气和排气装置,使每一次循环缺氧舱内最低氧浓度为8%,然后排除低氧气体同时吸入空气,使氧浓度逐渐恢复到21%。缺氧舱内二氧化碳浓度始终<3%,温度保持22±2℃,连续缺氧直至取材。缺氧期间,大鼠摄食、饮水正常。对照组置于相同的缺氧舱内,通入空气,余处理同CIH 组。
1.2.2 标本制备
每组各时间点大鼠停止处理后,乙醚麻醉,用4%多聚甲醛灌注固定后取脑。在视交叉后缘、大脑脚与桥脑交界处把脑冠状切为3块,置于4%多聚甲醛中后固定4h以上,将固定好的脑组织进行常规脱水、二甲苯透明、石蜡包埋。
1.2.3 GAP-43免疫组织化学染色
石蜡连续切片,常规脱蜡至水,进行GAP-43 多克隆抗体的免疫组织化学标记,步骤如下:加入3%H2O2室温孵育10min,阻断内源性过氧化物酶;抗原微波修复;加入正常山羊血清37℃孵育30min,甩去多余液;滴加兔多克隆抗体GAP-43 50μL(1∶200),4 ℃过夜;滴加即用型二步法非生物素检测试剂盒中聚合物辅助剂50μL(1∶1);滴加即用型二步法非生物素检测试剂盒中的试剂2;DAB显色5~10min,苏木精轻度复染,脱水、透明、封固。阴性对照用PBS液代替一抗,其余处理相同。
1.2.4 GAP-43半定量分析
GAP-43的标记强度用光密度(Optical density,OD)值表示。应用Nikon ECLIPSE 88i显微摄影系统及Image-Pro Plus 6.0图像分析软件测定大鼠大脑皮层GAP-43的吸光度值。各组每一只大鼠脑切片的大脑皮层随机选取3个400×视野,分别测定其中阳性染色的OD 值,求其平均值,作为该大鼠大脑皮层的OD 值。同时,测定同一张切片上视束的吸光度值作为背景,GAP-43的吸光度值减去背景的吸光度值得到矫正吸光度值,即GAP-43免疫反应产物的实际吸光度值。用COD 值进行比较分析,以避免非特异性染色所造成的误差。
1.3 统计学分析
采用SPSS 13.0统计学软件完成统计处理分析。实验数据采用表示,组内前后时间点的比较采用单因素方差分析(One-Way ANOVA),组间对应时间点的比较采用t检验(Independent-samples t test),P<0.05为差异具有显著性。
2 结果
GAP-43免疫反应阳性产物为棕黄色点状或颗粒状沉淀,主要分布于大脑皮层神经元胞浆中。组间对应时间点比较,CIH组各时间点GAP-43的COD 值均高于对照组,差异具有显著性(P<0.05)。对照组内前后时间点比较,随着时间增加,GAP-43的COD值逐渐降低;与对照2周组比较,对照4周组和对照6周组GAP-43的COD值明显降低,差异具有显著性(P<0.05);而对照4周组与对照6周组比较,GAP-43的COD值差异无显著性(P>0.05)。CIH 组内前后时间点比较,CIH6周组GAP-43的COD值较CIH2 周组和CIH4 周明显降低,差异具有显著性(P<0.05);而CIH2周组与CIH4周比较,GAP-43的COD 值差异无显著性(P>0.05),见表1和图1。
表1 对照组和CIH 组各时间点大脑皮层GAP-43的COD 值(,n=10)
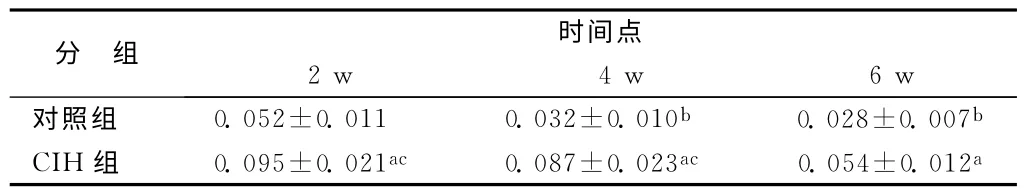
表1 对照组和CIH 组各时间点大脑皮层GAP-43的COD 值(,n=10)
注:与对照组对应时间点比较,aP<0.05;与对照2 周组比较,b P<0.05;与CIH6周组比较,cP<0.05。
3 讨论
阻塞性睡眠呼吸暂停低通气综合征(Obstructive sleep apnea hypopnea syndrome,OSAHS)可发生在婴儿期至青春期任何年龄阶段的儿童,2~5 岁为发病高峰期[2]。大鼠出生后第20~22日龄是大鼠的断奶期,研究表明[4],这与人类认知发育的幼儿期相当。一般将3月~12月龄大鼠称为成年大鼠,3月龄以前称为发育早期大鼠[5]。故本实验选择21日龄SD 幼鼠作为实验对象,将CIH 时间设定在幼鼠发育早期,从而观察CIH 对发育早期幼鼠大脑皮层GAP-43表达有何影响。
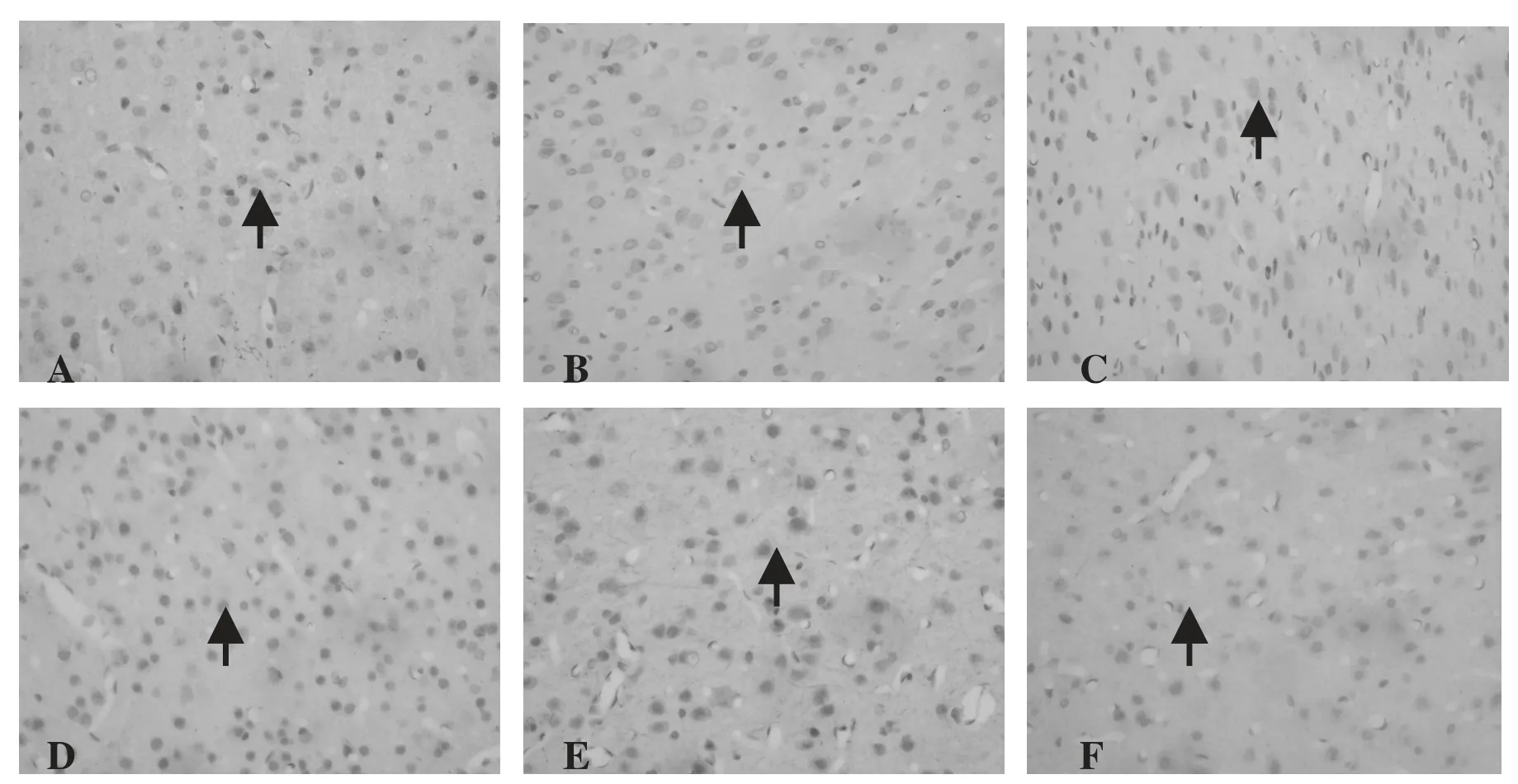
图1 对照组和CIH 组各时间点大脑皮层GAP-43的阳性表达(×400)
生长相关蛋白(Growth associated protein-43,GAP-43)是神经元特异性蛋白,主要存在于分化定性并开始轴突生长的神经元中,在脑功能活跃区(如:大脑皮质、海马)表达量很高。研究表明[6-9],在神经系统的初期发育阶段中,GAP-43在神经元胞浆中的含量较高;随着脑的发育成熟,GAP-43的表达逐渐降低;当出现脑损伤时,其表达又会增高。因而将GAP-43 视为研究神经生长发育和损伤修复的重要标记物之一[10]。本实验观察到,在生长发育的各时间点,CIH 幼鼠大脑皮层神经元GAP-43表达均较对照组明显增强,并且表达高峰持续时间较长(4w),这与其他学者利用成年大鼠制作的各种脑损伤模型中观察到GAP-43出现短暂增高(3~14d)不同[9,11],说明发育早期大鼠脑损伤后,脑组织自我修复非常活跃,提示缺氧性脑损伤后,神经系统启动保护机制并修复受损的神经元,通过GAP-43的不断增加促进突触的不断生长是神经进行修复的重要方式之一。
1 周永海,蔡晓红,张存雪,等.慢性间歇低氧对幼鼠学习记忆的影响[J].中国行为医学科学,2007,l6(1):13-15.
2 Liner LH,Marcus CI.Ventilatory management of sleep-disordered breathing in children[J].Curr Opin Pediatr,2006,18(3):272-276.
3 杨宇,谭胜玉,张新民,等.间歇性缺氧对大鼠认知功能和海马CA1区超微结构的影响[J].中国神经免疫学和神经病学杂志,2007,3(14):157-163.
4 Jiang W,Duong TM,de Lanerolle NC.The neuropathology of hyperthermic seizures in the rat[J].Epilepsia,1999,40(1):5-19.
5 Hoffmann H,Hunt P,Spear NE.Ontogenetic differences in the association of gustatory and tactile cues with lithium chloride and footshock[J].Behav Neural Biol,1990,53(3):441-450.
6 Hsu JY,Stein SA,Xu XM.Temporal and spatial distribution of growth-associated molecules and astroglial cells in the rat corticospinal tract during development[J].J Neuronsci Res,2005,80(3):330-340.
7 Farina V,Gadau S,Lepore G,et al.Growth-associated protein expression in the frontal and occipital cortices of callosotomized rats[J].Funct Neurol,2004,19(3):181-184.
8 郭云良,孙国岚,龚薇薇,等.脑缺血再灌注后生长相关蛋白和勿动蛋白基因表达与神经行为功能的关系[J].中国临床康复,2004,8(25):5424-5425.
9 Granziera C,D′Arceuil H,Zai L,et al.Long-term monitoring of post-stroke plasticity after transient cerebral ischemia in mice using in vivo and ex vivo diffusion tensor MRI[J].Open Neuroimag J,2007,1:10-17.
10 Kawasaki T,Nishio T,Kawaguchi S,et al.Spatiotemporal distribution of GAP-43in the developing rat spinal cord:a histological and quantitative immunofluorescence study[J].Neurosci Res,2001,39(3):347-358.
11 Harris NG,Mironova YA,Hovda DA.Pericontusion axon sprouting is spatially and temporally consistent with a growth-permissive environment after traumatic brain injury[J].J Neuropathol Exp Neurol,2010,69(2):139-154.

