6种透皮吸收促进剂对盐酸普萘洛尔乳膏透皮吸收性能的影响
杨柳,王爱武,苗杰,霍然,徐广琪(1.山东大学附属省立医院药剂科,济南250021;2.山东中医药大学,济南 250355;3.山东大学附属省立医院烧伤整形科,济南 250021;4.山东大学医学院,济南250012)
盐酸普萘洛尔为非选择性竞争抑制肾上腺素β受体阻滞药,临床上可用于治疗心绞痛、心律失常、高血压等疾病[1]。自2008年,法国Bordeaux儿童医院的Léauté-Labrèze C等[2]发现盐酸普萘洛尔可用于血管瘤的治疗后,大量临床研究表明盐酸普萘洛尔治疗婴幼儿血管瘤有效,能够促进瘤体萎缩变薄[3]。目前国内常用的有片剂和注射剂两种剂型。但口服盐酸普萘洛尔有可能导致低血糖、低血压等不良反应,同时其大部分通过肝脏时被代谢,生物利用度差[4-5];而外用制剂具有不受肝脏首关效应和肠胃道破坏影响、可直达病灶的独特优点。笔者在前期临床研究[6]已证实盐酸普萘洛尔外用对血管瘤有较好的疗效。为了进一步优化盐酸普萘洛尔乳膏的处方和工艺,本试验考察了氮酮、油酸、丙二醇、氮酮+油酸、氮酮+丙二醇、油酸+丙二醇6种透皮吸收促进剂对盐酸普萘洛尔乳膏透皮吸收性能的影响,为其处方优化提供参考。
1 材料
1.1 仪器
ZTY智能透皮试验仪(河南省巩义市科瑞仪器有限公司);LC-2010AHT液相色谱仪(北京普析通用仪器有限公司);BSA223S电子天平(北京赛多利斯科学仪器有限公司)。
1.2 药品与试剂
盐酸普萘洛尔原料药(湖北兴银河化工有限公司,批号:20110712,纯度:≥99%);盐酸普萘洛尔对照品(中国食品药品检定研究院,批号:100783-200401,纯度:≥98%);硬脂酸(山东金达双鹏集团有限公司);白凡士林(南昌白云药业有限公司);单硬脂酸甘油酯(杭州油脂化工有限公司);聚山梨酯80(天津市红岩化学试剂厂);甘油(湖南尔康制药有限公司);羟苯乙酯(台山市新宁制药有限公司);氮酮(天津市科密欧化学试剂有限公司);油酸、丙二醇(天津市大茂化学试剂厂);甲醇 为色谱纯,庚烷磺酸钠、磷酸二氢钾均为分析纯,水为生理盐水。
1.3 动物
健康Wistar大鼠60只,♀♂各半,SPF级,体质量175~225g,购于山东大学实验动物中心,许可证号:SCXK(鲁)2009000101。
2 方法与结果
2.1 供试品的制备
油相:110g硬脂酸,75g单硬脂酸甘油酯,100g白凡士林,20g透皮吸收促进剂;水相:30g聚山梨酯80,150g甘油,1g羟苯乙酯,20g盐酸普萘洛尔原料药,蒸馏水适量。将上述处方中的油相和水相分别加热至(75±2)℃,将油相缓缓倒入水相中,边加边搅拌,分别制成含有2%氮酮、2%油酸、2%丙二醇、2%氮酮+2%油酸、2%氮酮+2%丙二醇、2%油酸+2%丙二醇的盐酸普萘洛尔乳膏。同法制备不含透皮吸收促进剂的盐酸普萘洛尔乳膏和不含盐酸普萘洛尔原料药的空白基质。
2.2 离体皮肤的制备
将大鼠腹部脱毛,用湿纱布擦拭干净,饲养1d,保证脱毛部位皮肤无损伤。实验时将大鼠颈椎脱臼处死,剪下脱毛处皮肤,小心剥离皮下脂肪及黏液组织,选取完整皮肤,用生理盐水洗净,滤纸吸干,4℃冰箱短期保存,备用。
2.3 扩散装置与接收介质的选择
采用ZTY智能透皮试验仪进行体外透皮吸收试验。扩散池由2个玻璃组件组成,鼠皮夹在中间形成上下室,上室是供给池,下室是接收池,放入(32±0.5)℃恒温水浴中。扩散池的有效扩散直径为25mm,接收池容积为25ml。在透皮释放介质的选择上,通过比较盐酸普萘洛尔在生理盐水及不同pH磷酸盐缓冲液中的溶解度,发现在不损害皮肤组织结构的条件下,以生理盐水为接收介质最佳。
2.4 色谱条件
色谱柱:Shimadzu Shim-pack VP-ODS C18(250mm×4.6mm,5μm);流动相:甲醇-含0.1%庚烷磺酸钠的0.05mol/L磷酸二氢钾溶液(57∶43),流速:1.0ml/min;检测波长:290nm;进样量:20μl;柱温:室温。在上述色谱条件下,盐酸普萘洛尔对照品、供试品及空白基质的色谱见图1。
2.5 线性关系考察
精密称取105℃干燥至恒重的盐酸普萘洛尔对照品5mg,置于10ml量瓶中,用生理盐水稀释定容至刻度。精密量取上述溶液1ml,置于10ml量瓶中,用生理盐水稀释定容至刻度,配制成50μg/ml的标准溶液。精密量取上述标准溶液1.00、2.00、3.00、4.00、5.00、6.00、7.00ml,分别置于10ml量瓶中,加生理盐水稀释定容至刻度,摇匀,制得5.00、10.00、15.00、20.00、25.00、30.00、35.00μg/ml的系列溶液,经0.45μm 微孔滤膜过滤后进样测定。以盐酸普萘洛尔的质量浓度(c)为横坐标、峰面积(y)为纵坐标,进行线性回归。得回归方程为y=0.022c-0.0036(r=0.9999)。结果表明,盐酸普萘洛尔检测质量浓度的线性范围为5.00~35.00μg/ml。
图1 高效液相色谱图A.对照品;B.供试品;C.空白基质;1.盐酸普萘洛尔Fig 1 HPLC chromatogramsA.substance control;B.test samples;C.blank matrix;1.propranolol hydrochloride
2.6 精密度试验
用生理盐水溶解适量的盐酸普萘洛尔对照品,过滤后按“2.4”项下色谱条件进样测定,连续进样6次,记录峰面积。结果,RSD=1.14%,表明该检测方法精密度良好。
2.7 回收率试验
将盐酸普萘洛尔对照品溶液,加入已知含量的透皮吸收溶液(2%油酸、2%氮酮)中,配制成样品溶液,另以空白基质为对照,各3份,过滤后按“2.4”项下色谱条件进样测定,记录峰面积,计算回收率,结果见表1。

表1 回收率试验结果(n=3)Tab 1Results of recovery tests(n=3)
2.8 体外透皮试验
用滤纸吸干鼠皮表面水分,角质层向上夹于扩散池中,在鼠皮上均匀涂上空白基质、含有不同透皮吸收促进剂的盐酸普萘洛尔乳膏和不含透皮吸收促进剂的盐酸普萘洛尔乳膏,涂药量约为0.25g/cm2。供给池上口用保鲜膜封住,接受池加满生理盐水并加入磁子。将扩散池置于(32±0.5)℃的恒温水浴槽中,搅拌速度恒定,分别于0.5、1、2、4、6、8、10、12h取出接收液15ml,同时补充同体积且等温的生理盐水。将各时段的接收液经0.45μm微孔滤膜过滤,取续滤液,采用高效液相色谱法测定接收液中盐酸普萘洛尔的峰面积。以盐酸普萘洛尔吸收峰面积A=A样品-A空白,按外标法计算接收液中盐酸普萘洛尔的含量,并计算单位面积累积透过量(Q)=[cn·V+∑(ci×V1)]/s。式中,Q为药物单位面积经皮累积渗透量,s为有效皮肤渗透面积,V为接收池中接收液体积,ci为第1次至上次取样时接收液中药物浓度,cn为该次取样时接收液中药物浓度,V1为所取接收液的体积。对药物渗透曲线(Q-t)的稳态部分作切线,切线的斜率即为药物经皮渗透速率(J)。对加入透皮吸收促进剂的盐酸普萘洛尔乳膏的经皮渗透参数与无促进剂乳膏的经皮渗透参数进行t检验。促渗性能即按下列公式计算:QEF=Q12h(促进剂)/Q12h(无促进剂),JEF=J12h(促进剂)/J12h(无促进剂)。不同透皮吸收促进剂对盐酸普萘洛尔乳膏透皮吸收性能的影响见表2。
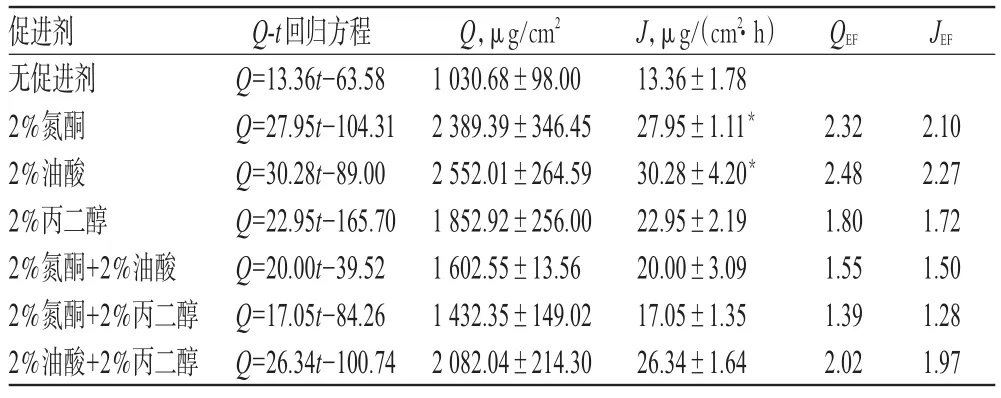
表2 不同透皮吸收促进剂对盐酸普萘洛尔乳膏透皮吸收性能的影响(n=3)Tab 2 Effects of different penetration enhancers on percutaneous enhancers absorption of Propranolol hydrochloride cream(n=3)
由表2结果表明,6种透皮吸收促进剂对盐酸普萘洛尔乳膏均有促透作用,促透作用依次为:油酸>氮酮>油酸+丙二醇>丙二醇>氮酮+油酸>氮酮+丙二醇>无促进剂。其中油酸对盐酸普萘洛尔的促透作用最好,其Q约为2552.01μg/cm2,是无促进剂乳膏的2.48倍;J约为30.28μg/(cm2·h),是无促进剂乳膏的2.27倍。
3 讨论
透皮吸收制剂是一种新型药物剂型,具有可维持稳定的血药浓度、避免胃肠道酶解作用和肝脏的首关效应、降低药物的毒副作用、给药方便等优点。而皮肤表皮的角质层对大多数外用药物形成一道难以渗透的生理屏障,添加适宜的透皮吸收促进剂是通过改变皮肤角质层扁平细胞的有序叠集结构,增大角质层细胞间隙的空隙,使药物迅速进入皮内而被吸收[7]。透皮吸收中常用的促进剂有氮酮、油酸、丙二醇及其组合物等。氮酮是目前常用的化学促渗剂之一,其渗入皮肤中能影响表皮角质层中扁平角化细胞的有序叠集结构,也作用于细胞类脂质双分子层,增加双分子层的流动性,降低相变温度,从而增加药物的渗透性。丙二醇能渗入角质层并在其中形成蓄积,增加药物在角质层中的溶解性质和分配性质[8],特别适合于在丙二醇中有较大溶解度的药物。油酸为含有不饱和双键的长链脂肪酸,与皮肤中的脂肪酸有相似的结构,但由于双键的存在而形成不对称空间结构,两者相互作用使角质细胞间形成空隙,细胞间类脂分子排列发生变化,增加了类脂的流动性,这些腔隙成为药物分子穿过角质层的通道,减小了扩散阻力,使皮肤的渗透性增大[8]。另外,盐酸普萘洛尔为阳离子型药物,油酸对阳离子药物有独特的促进效果,油酸与阳离子药物形成离子对而提高了脂溶性,对角质层具有较好的渗透性。
有关透皮吸收促进剂对盐酸普萘洛尔透皮吸收性能的影响,孙群[9]曾以盐酸普萘洛尔原料药作为供试液进行了研究,结果显示氮酮为其最佳促进剂。笔者以盐酸普萘洛尔乳膏为研究对象,探讨了不同透皮吸收促进剂对其透皮吸收性能的影响。结果表明盐酸普萘洛尔乳膏加入透皮吸收促进剂的渗透效果优于不加促进剂,单用油酸优于与氮酮、丙二醇等合用的促透效果。其原因可能是,氮酮与乳膏基质中的凡士林等有较强的亲和力,降低了向角质层的分配比例,从而影响了其促透效果[10];丙二醇具有较大黏度,油酸与丙二醇合用后黏度增加,抑制了皮肤的水合作用,使水溶性药物经皮渗透性降低。
[1] 杨宝峰.药理学[M].7版.北京:人民卫生出版社,2008:325.
[2] Léauté-Labrèze C,Dumas de la Roque E,Hubiche T,et al.Propranolol for severe hemangiomas of infancy[J].N Engl J Med,2008,358(24):2649.
[3] 孙中运,衣明纪.普萘洛尔治疗婴儿血管瘤的临床疗效及风险[J].中国药师,2011,14(1):124.
[4] Holland KE,Frieden IJ,Frommelt PC,et al.Hypoglycemia in children taking propranolol for the treatment of infantile hemangioma[J].Arch Dermatol,2010,146(7):775.
[5] Sans V,de la Roque ED,Berge J.Propranolol for severe infantile hemangiomas:follow-up report[J].Pediatrics,2009,124(3):423.
[6] 张健,霍然.普萘洛尔在婴幼儿增生期血管瘤治疗中的临床应用[D].济南:山东大学,2010:9-11.
[7] 方世平,孙曼春,王智勇,等.月桂氮酮和薄荷脑对姜赤凝胶体外透皮吸收的影响[J].中国医院药学杂志,2006,26(3):280.
[8] 侯雪梅,李国栋,李卫华.化学促渗剂及机制的探讨[J].上海医药,2008,29(5):232.
[9] 孙群.促透剂对盐酸普萘洛尔透皮吸收的影响[D].杭州:浙江大学,2004:35-38.
[10] 张星一.透皮吸收促进剂在经皮给药系统中的质控和评价方法[J].中国新药杂志,2010,19(4):273.

