国产齐考诺肽注射液对大鼠镇痛效果的影响Δ
屠伟峰,邓丽珍,马亚平,尹晴,杨学敏,康旭,聂涛(.广州军区广州总医院麻醉科/全军临床麻醉中心,广州 5000;.深圳翰宇药业股份有限公司/多肽药物国家地方联合工程实验室,广东深圳 58057)
神经病理性疼痛是由外伤、肿瘤和感染等各种原因引起的神经损伤,主要表现在损伤愈合后数周甚至数年依然存在疼痛超敏和自发性疼痛等痛觉异常,使得患者痛苦不堪,甚至丧失劳动能力。近来研究发现,N型钙离子通道阻滞药齐考诺肽(Ziconotide,ZIC)可产生显著抗神经病理性疼痛的作用,其强度是吗啡的300倍,且长时间使用该药不会产生耐受性和成瘾性[1-2],为顽固性神经病理性疼痛、癌性疼痛的治疗带来了新希望。但由于进口齐考诺肽是直接从芋螺毒素中提取,其成本过高,使得此药在国内临床的应用受到极大的限制。为此,深圳翰宇药业股份有限公司采用化学合成法自主研发出了该产品。但由于其所采取的合成工艺和配合制剂不同,可能造成其镇痛药效不同,故本研究以进口齐考诺肽注射液为对照,考察了国产齐考诺肽注射液对大鼠腰5脊神经病理性疼痛的抑制作用,为临床试验提供依据。
1 材料
1.1 仪器
Von Frey Kit触觉测量套件及其工作台(意大利Ugo Basile公司)。
1.2 药品与试剂
齐考诺肽注射液(深圳翰宇药业股份有限公司,批号:ZIC-2011030101,规格:100μg/ml),齐考诺肽注射液(以色列Elan公司,批号:49191PRN2,规格:100μg/ml),两种制剂的剂量、外包装和保存条件完全相同,根据需要用0.9%的氯化钠溶液(生理盐水)稀释成相应浓度的溶液;水合氯醛(天津市百世化工有限公司,批号:20101025,规格:每瓶100g)。
1.3 动物
SPF级SD大鼠,♂,体质量180~220g,由南方医科大学动物实验中心和广东省实验动物中心提供,合格证编号:SCXK(粤)2006-0015。分笼饲养,自由饮食,室温23~26℃,相对湿度为55%~65%,白天黑夜各12h循环照明。
2 方法
2.1 建模与鞘内置管
采用经典的腰5脊神经结扎加切断术建立神经病理性疼痛模型,并进行鞘内置管。具体步骤如下:取大鼠,10%水合氯醛0.35~0.4ml/100g腹腔麻醉后,备皮、消毒,分离左侧腰5脊神经,结扎后切断;再于腰5与腰6脊正中间隙置入长约10cm的PE-10导管,见有清亮脑脊液流出即可;逐层缝合切口,待大鼠苏醒后,单笼喂养。
2.2 分组与给药
参考国外经典文献[3]及预实验结果进行相应剂量分组,于建模手术后7d(记为7d)将建模成功的大鼠随机分为7组,每组8只。模型组鞘内注射生理盐水20μl;国产齐考诺肽低、中、高剂量组鞘内注射国产齐考诺肽注射液,剂量分别为每只30、100、300ng;进口齐考诺肽低、中、高剂量组鞘内注射进口齐考诺肽注射液,剂量分别为每只30、100、300ng,鞘内注射总体积均为每只20μl。
2.3 行为学测试
各组大鼠建模手术前3、1d(记为-3d、-1d)及建模手术后4、6d(记为4d、6d)需进行50%机械性撤足阈值(PWT)的测定;并于建模手术后3、8d(记为3d、8d)进行鞘内导管利多卡因测试,确保给药时导管位置的正确性及数据的可靠性;建模手术后7d鞘内给药,监测各组大鼠给药前1h(记为-1h)及给药后1、2、4、8h的50%PWT。
2.4 50%PWT的测定
待各组大鼠安静后,采用Up-Down方法[4]检测大鼠不同时间点的50%PWT。选8根强度呈对数递增方式的Von Frey纤维丝(0.41、0.70、1.20、2.04、3.63、5.50、8.51、15.14g)分别对大鼠后肢左右脚足心部进行机械性刺激,每次刺激持续时间为6~8s。以2.041g为初始刺激强度,若撤足反应为阴性则选用刺激强度递增的相邻Von Frey纤维丝继续刺激;若撤足反应为阳性则选用刺激强度递减的相邻Von Frey纤维丝继续刺激。如此反复,以第一个转折点的前一点为起点,连续6次的刺激结果为最终的撤足反应模式。根据公式计算50%PWT(g)=10(Xf+kδ)/10000,式中Xf为最末次测试Von Frey 纤维丝的对数值;k可根据撤足反应模式查表[4]得出;δ为8根Von Frey纤维丝间对数差值的均值。另根据公式计算最大效应百分比(MPE,%),用以评价抗神经病理性疼痛的效果,MPE=(给药后撤足阈值-基础撤足阈值)/(15g-基础撤足阈值)×100%,其中撤足阈值即为50%PWT,基础撤足阈值为-1d的50%PWT[5]。
2.5 利多卡因测试
经已置入的鞘内导管给予2%利多卡因10μl,再用10μl生理盐水冲管,封闭导管外口,观察给药后大鼠双下肢的运动情况。如在30s内出现双下肢麻痹无法运动,则可认为置入的导管内口位于蛛网膜下腔,表明置管成功。
2.6 统计学分析
运用SPSS 1310统计软件,采用秩和检验和单因素方差分析方法,所有数据以±s表示。P<0.05表示差异具有统计学意义。
3 结果
各组大鼠不同时间点50%PWT的变化见图1,各组大鼠给药后不同时间点MPE的变化见表1。
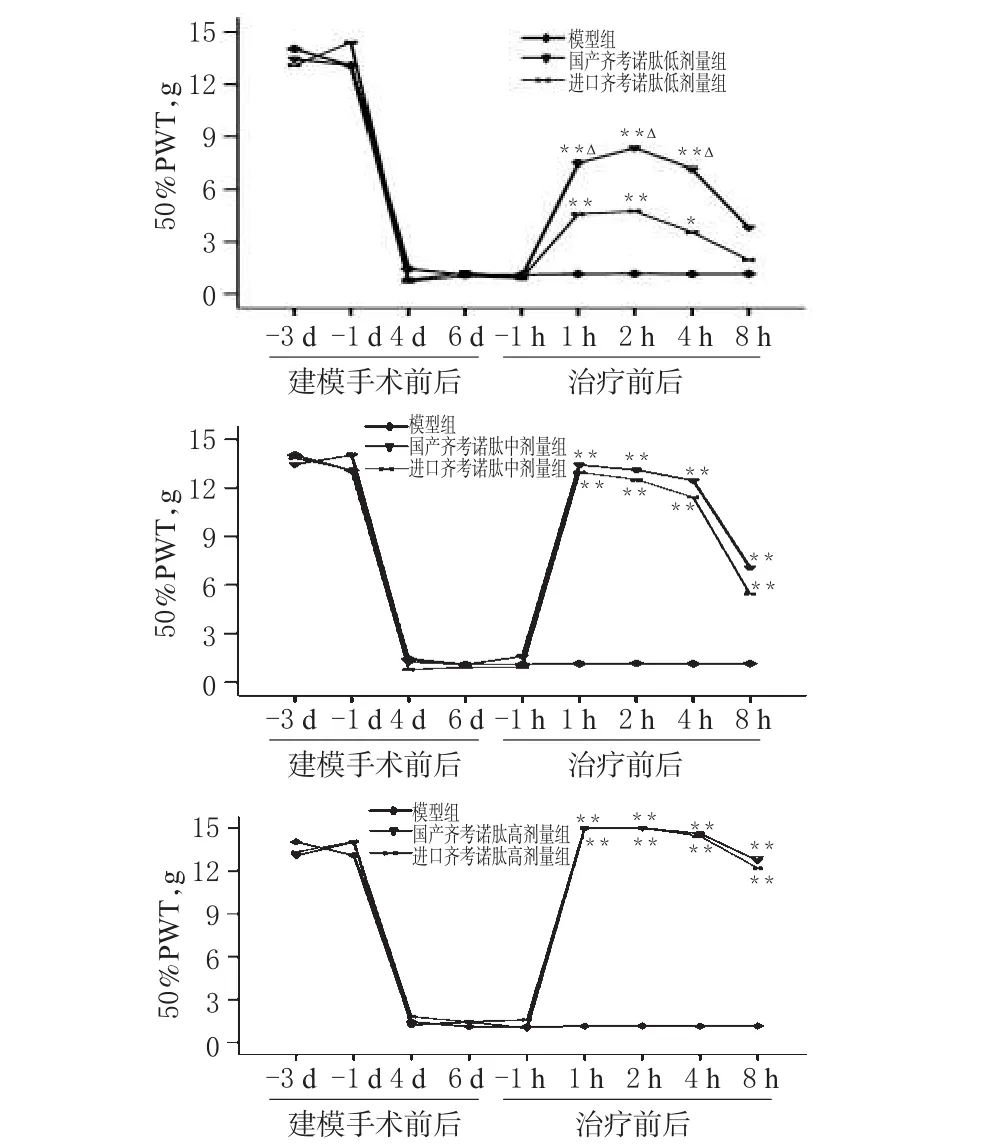
图1 各组大鼠不同时间点50%PWT的变化与模型组比较:*P<0.05,**P<0.01;与同剂量进口齐考诺肽组比较:△P<0.01Fig 1 Changes of 50%PWT in each group at different time pointsvs.model group:*P<0.05,**P<0.01;vs.imported Ziconotide injection at same dose:△P<0.01
结果表明,每只大鼠鞘内单次注射进口齐考诺肽注射液或国产齐考诺肽注射液30、100、300ng均可剂量依赖性地抑制大鼠神经病理性疼痛超敏反应,给药后1h内50%PWT达最高值,并在该水平左右可维持4h。与模型组比较,国产和进口齐考诺肽低、中、高剂量组大鼠给药后各时间点的50%PWT、MPE均明显增加(P<0.01),且呈明显量效关系;与同剂量的进口齐考诺肽组比较,国产齐考诺肽中、高剂量组大鼠给药后1、2、4h的50%PWT、MPE差异无统计学意义(P>0.05)。给药后4h内,国产齐考诺肽低、中、高剂量组大鼠的平均MPE分别为(47.83±15.16)%、(85.12±13.21)%、(99.11±2.53)%,表明中、高剂量组基本甚至完全抑制了模型大鼠的神经病理性疼痛超敏反应。
4 讨论
表1 各组大鼠给药后不同时间点MPE的变化(±s,n=8)Tab 1 Changes of MPE in each group at different time points(±s,n=8)
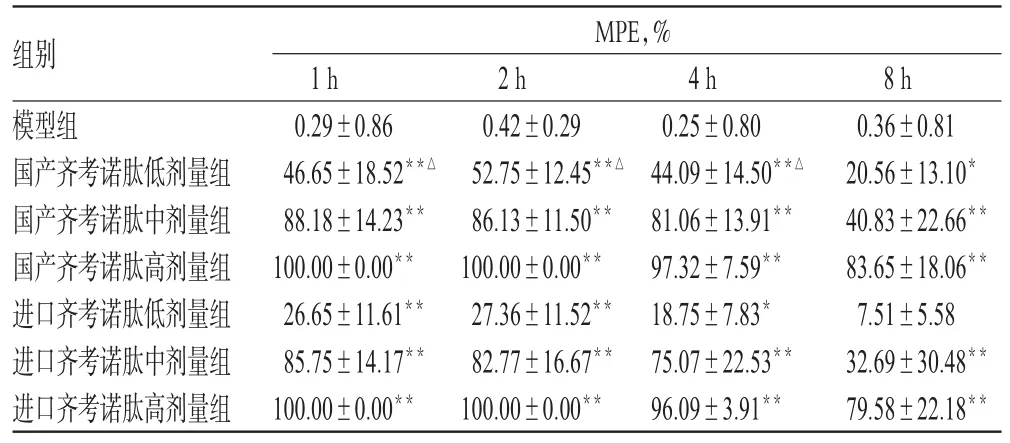
表1 各组大鼠给药后不同时间点MPE的变化(±s,n=8)Tab 1 Changes of MPE in each group at different time points(±s,n=8)
与模型组比较:*P<0.05,**P<0.01;与同剂量进口齐考诺肽组比较:△P<0.01vs.model group:*P<0.05,**P<0.01;vs.imported Ziconotide injection at same dose:△P<0.01
MPE,%组别模型组国产齐考诺肽低剂量组国产齐考诺肽中剂量组国产齐考诺肽高剂量组进口齐考诺肽低剂量组进口齐考诺肽中剂量组进口齐考诺肽高剂量组1h 0.29±0.8646.65±18.52**△88.18±14.23**100.00±0.00**26.65±11.61**85.75±14.17**100.00±0.00**2h 0.42±0.2952.75±12.45**△86.13±11.50**100.00±0.00**27.36±11.52**82.77±16.67**100.00±0.00**4h 0.25±0.8044.09±14.50**△81.06±13.91**97.32±7.59**18.75±7.83*75.07±22.53**96.09±3.91**8h 0.36±0.8120.56±13.10*40.83±22.66**83.65±18.06**7.51±5.5832.69±30.48**79.58±22.18**
N型钙离子通道与慢性疼痛的形成密切相关,它主要分布于背根神经细胞及脊髓背角神经的突触末梢,通过触发谷氨酸及P物质等神经递质释放,参与疼痛的传递与调控。齐考诺肽作为一种特异性N型钙离子通道阻滞药,其镇痛机制主要是可逆性地阻滞N型钙离子通道、调控疼痛介质的释放、阻断疼痛信号的传递,从而缓解或抑制疼痛。目前其已被多个国家批准用于治疗各种术后疼痛、慢性疼痛、难治性疼痛,以及对阿片类药物不敏感的疼痛[6],其鞘内注射较吗啡更具潜力且不必担心药物的耐受性、成瘾性及呼吸抑制。国外众多专家更是认为齐考诺肽与吗啡联合应用是值得推荐的一种镇痛方案[7]。
本研究结果显示,国产和进口齐考诺肽对神经病理性疼痛模型大鼠有显著的镇痛作用。正常大鼠经建模手术后50%PWT明显下降,待建模手术后第7天神经病理性疼痛形成后,单次鞘内注射小剂量(每只30ng)国产和进口齐考诺肽注射液便可有效对抗模型大鼠的神经病理性疼痛,如按每只100、300ng剂量注射镇痛效果更佳。因此可认为,国产和进口齐考诺肽对大鼠腰5脊神经病理性疼痛均具有较好的镇痛效应。
[1] Schmidtko A,Lötsch J,Freynhagen R,et al.Ziconotide for treatment of severe chronic pain[J].Lancet,2010,375(9725):1569.
[2] 史学莲,刘小立.齐考诺肽(ziconotide):一种非阿片类镇痛药物[J].实用疼痛学杂志,2010,6(4):298.
[3] Bowersox SS,Gadbois T,Singh T,et al.Selective N-type neuronal voltage-sensitive calcium channel blocker,SNX-Ⅲ,produces spinal antinociception in rat models of acute,persistent and neuropathic pain[J].J Pharmacol Exp Ther,1996,279(3):1243.
[4] Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Methods,1994,53(1):55.
[5] Hama A,Sagen J.Antinociceptive effects of the marine snail peptides conantokin-G and conotoxin MVIIA alone and in combination in rat models of pain[J].Neuropharmacology,2009,56(2):556.
[6] Alicino I,Giglio M,Manca F,et al.Intrathecal combination of ziconotide and morphine for refractory cancer pain:a rapidly acting and effective choice[J].Pain,2012,153(1):245.
[7] Pope JE,Deer TR.Ziconotide:a clinical update and pharmacologic review[J].Expert Opin Pharmacother,2013,14(7):957.

