津力达口服液对2 型糖尿病模型大鼠血液和肾脏氧化应激标志物的影响
国 蓉,邹俊杰,何逸飞,刘志民
2 型糖尿病已成为21 世纪人类的一个主要健康威胁,到2030年,糖尿病患者的总人数将上升到5.52 亿[1]。在糖尿病的发生和发展过程中,大血管病变是2 型糖尿病患者早亡及致残的主要原因[2],而氧化应激在其中起着关键作用[3]。氧化应激定义为反应性的活性氧簇的增加和(或)固有的抗氧化支持物质的受损,这一过程常见于长期血糖和脂调节紊乱[4]。但是,尽管氧化应激在糖尿病的发生发展中起到非常关键的作用,但大多数临床试验并未显示出抗氧化剂和维生素有任何长期的疗效[2]。因此,越来越多的报道关注口服降血糖药物减少氧化应激的作用。津力达口服液是由人参、黄精、苍术等多味中药组成的制剂,具有降糖、减轻多种糖尿病临床症状的作用。本研究以高脂饲养的大鼠为模型,观察津力达口服液在治疗糖尿病肾病方面的作用,为临床防治糖尿病肾病提供理论基础。
1 材料与方法
1.1 动物 雄性SD 大鼠100 只,体质量180~200 g,由第二军医大学实验动物中心提供[生产许可证号:SCXK(沪)2007-0003;使用许可证号:SYXK(沪)2007-0003]。无特定病原体(SPF)环境饲养,温度20~25℃,湿度56%,自由饮水,12/12 h 昼夜规律,喂食时间为每日下午5:00 至次日上午8:00。
1.2 试药与试剂 津力达口服液(石家庄以岭药业股份有限公司,批号:971218,规格10 ml/支;主要成分:人参、黄精、麦门冬、葛根、苍术、佩兰、苦参、丹参);链脲佐菌素(STZ)(Sigma),疾病模型动物脂类诱导饲料购自江苏美迪森生物公司,谷胱甘肽过氧化物酶(GSH-Px)、脂质过氧化物的产物丙二醛(MDA)测定试剂盒由南京建成生物工程研究所提供。鼠血清超氧化物歧化酶(superoxide dismutase,SOD)、一氧化氮(NO)及一氧化氮合酶(NOS)试剂盒均购自EMD biosciences 公司。
1.3 仪器 自动生化分析仪(日立),酶联检测紫外分光光度计(岛津UV2401PC),TL-820 系列冷冻切片机(泰维),BX53 显微镜(奥林巴斯)。
1.4 方法
1.4.1 2 型糖尿病模型建立:大鼠适应性饲养2 d后随机分组,建立模型的大鼠予脂类诱导饲料喂养4 周后予链脲佐菌素(STZ)溶于柠檬酸缓冲液(pH 4.3,0.1 mol/L)30 mg/kg 一次性腹腔注射;正常对照组给予普通饲料喂养4 周后予同剂量的柠檬酸缓冲液(pH 4.3,0.1 mol/L)腹腔注射。继续普通饲料喂养2 周后禁食8 h,按2 g/kg 灌服20%D-葡萄糖溶液,做口服糖耐量试验,0 min 和120 min 血糖分别>7.0 mmol/L 和11.0 mmol/L 为造模成功。本实验中最终得到75 只成功造模大鼠,取40 只进行下一步实验。
1.4.2 大鼠分组:造模成功的40 只2 型糖尿病大鼠随机分为糖尿病模型组和津力达治疗组,每组20只。另取20 只正常大鼠作为正常对照组。津力达治疗组给予津力达口服液5 ml/kg 灌胃、2/d,正常对照组及糖尿病模型组给予同剂量0.5%羟甲纤维素钠溶液灌胃,持续8 周后处死。
1.5 生化指标检测 实验8 周时测大鼠体质量,在最后一次灌胃后将大鼠禁食12 h,后用戊巴比妥钠(40 mg/kg)麻醉,开胸取主动脉血,血清在-70℃保存备用。同时检测血糖、甘油三酯(TG)和总胆固醇(TC)(日立自动化生化分析仪),迅速取出肾脏,分离皮质,-70℃液氮保存备用,实验终止后动物断头处死。
1.6 肾组织高级糖化终产物(advanced glycation end,AGE)、GSH-Px、SOD、丙二醛(MDA)测定AGE 采用Monnier 等[5]方法:将肾皮质剪碎,匀浆、离心,沉淀中加氯仿∶ 甲醇(2∶ 1)10 ml 去脂,4℃摇振过夜,经水化冲洗,在HEPES 缓冲液过夜,加入280U 型胶原酶,37℃震荡消化24 h。离心取上清液,用分光光度计在370/440 nm 处测定荧光强度,其值用空白胶原酶校正。消化液中羟脯氨酸(Hyp)含量用氨胺T 法测定,AGE 含量以每mg Hyp 所含荧光强度为一个任意单位,用AU/mg Hyp 表示。其余指标检测方法:上清液按照ELISA 试剂盒的操作说明对样品进行检测,在酶联免疫检测仪上测490 nm波长的样品吸收值,通过标准品的浓度吸收值,绘制标准曲线,再根据样品的吸收值在该曲线上查出相应指标水平。
1.7 血液SOD、GSH-Px、MDA、NO、NOS 及AGE-P测定 给药第4、8 周末分别采取鼠尾血样本,血清离心去除细胞碎片,按照ELISA 试剂盒的操作说明对样品进行检测,在酶联免疫检测仪上测490 nm 波长的样品吸收值,通过标准品的浓度吸收值,绘制标准曲线,再根据样品的吸收值在该曲线上查出相应指标水平。
1.8 肾小球截面积计算 肾组织经甲醛固定后进行HE 染色。应用CMIAS 多功能真彩色病理图像分析系统,每张HE 染色切片随机测定50 个肾小球截面积。
1.9 统计学处理 应用SPSS 18.0 软件进行统计学分析,采用方差分析,α=0.05 为检验水准。
2 结果
2.1 体质量及血生化指标变化 入选时各组体质量、血糖、TG 和TC 水平均无明显差异;饲养8 周期间根据残余食物量计算,糖尿病模型组和津力达治疗组的摄食量也无明显差异。糖尿病模型组和津力达治疗组体质量在给药第8 周均明显低于正常对照组(P<0.05);津力达治疗组空腹血糖、TC、TG 均显著低于糖尿病模型组(P<0.05),除空腹血糖(P<0.05)外,其余指标与正常对照组比较差异无统计学意义(P >0.05)。见表1。
表1 给药第8 周时3 组大鼠体质量及血生化指标比较(±s)

表1 给药第8 周时3 组大鼠体质量及血生化指标比较(±s)
注:与正常对照组比较,aP<0.05;与糖尿病模型组比较,cP<0.05
2.2 肾小球截面积及肾脏抗氧化酶活性、MDA 及AGE 含量变化 相比正常对照组,给药8 周时糖尿病模型组肾脏SOD、GSH-Px 活性下降,MDA 及AGE含量升高(P<0.05);津力达治疗组相比糖尿模型病组肾脏SOD、GSH-Px 活性升高(P<0.05),MDA和AGE 含量降低(P<0.05);糖尿病模型组肾小球截面积及肾脏AGE 含量显著大于、高于正常对照组(P<0.05),津力达治疗组与糖尿病模型组比较肾小球截面积显著减小(P<0.05)。见表2。
表2 给药第8 周时3 组大鼠肾小球截面积及肾脏SOD、MDA、GSH-Px、AGE 含量的变化(±s)
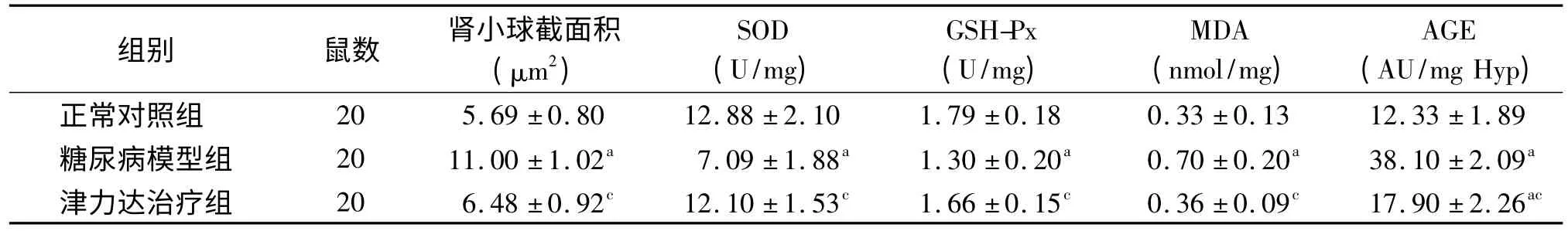
表2 给药第8 周时3 组大鼠肾小球截面积及肾脏SOD、MDA、GSH-Px、AGE 含量的变化(±s)
注:SOD:超氧化物歧化酶,GSH-Px:谷胱甘肽抗过氧化物酶,MDA:丙二醛,AGE:高级糖化终产物;与正常对照组比较,aP<0.05;与糖尿病模型组比较,cP<0.05
2.3 血液氧化应激标志物的变化 与正常对照组比较,给药第4 周末糖尿病模型组血SOD、GSH-PX、NO、NOS 活性显著降低(P<0.05),而MDA 和AGE含量显著增高(P<0.05)。给药第8 周末糖尿病模型组与正常对照组相比上述指标趋势相同,GSH-Px有所回升(P<0.05)。而给药第4、8 周末津力达治疗组上述指标均有所改善(P<0.05)。给药第8 周末,津力达治疗组GSH-Px 比本组给药第4 周末显著升高(P<0.05)。见表3。
表3 给药4、8 周时3 组大鼠血液SOD、MDA、NO、NOS 及AGE 的变化(±s)

表3 给药4、8 周时3 组大鼠血液SOD、MDA、NO、NOS 及AGE 的变化(±s)
注:SOD:超氧化物歧化酶,GSH-Px:谷胱甘肽抗过氧化物酶,MDA:丙二醛,NO:一氧化氮,NOS:一氧化氮合酶,AGE:高级糖化终产物;与正常对照组比较,aP<0.05;与糖尿病模型组比较,cP<0.05;与本组给药第4 周末比较,eP<0.05
3 讨论
自由基和活性氧族以及伴随发生的氧化应激反应在肥胖、高血糖发生、发展中及各种急性、慢性炎症反应中发挥非常重要的作用[6]。氧化应激过程中,内皮细胞线粒体生成的超氧阴离子自由基增多是各种糖尿病并发症机制中的共同关键因素[7-9]。多元醇通路激活、AGE 形成、蛋白激酶C 途径和氨基己糖途径的激活,都会引起细胞功能的严重紊乱,导致各种并发症的发生[10-13]。而AGE 是蛋白质的氨基、脂质和脂蛋白等通过非酶糖基化反应后产生的终末产物。AGE 修饰后的蛋白质将会被免疫细胞降解清除,而AGE 与细胞表面受体的相互作用是氧化应激发生的必要因素[14-15],此外,AGE 修饰后的蛋白质还会导致肾小球细胞外基质(ECM)增加,IV 型胶原等基质蛋白交联,开启相关基因,最终引起肾小球肥大,基底膜增厚,导致糖尿病肾病的发生和发展[16-20]。
祖国医学认为,津液代谢失常、水谷转输利用失衡是消渴病的机理。脾失健运,不能散精上输于肺;肺津无以输布,则口渴多饮,脾不能为胃行其津液。燥热内盛,消杀水谷,则消谷善饥,脾不能转输水谷精微;水谷精微下流膀胱,则小便量多而昧甘;水谷精微不能濡养肌肉,故形体渐瘦。而脾失转输的因素,与脾气虚乏、脾阴不足、湿邪困脾、脾经伏热、气血郁滞等有关。治疗应以健脾运津、益气养阴为主。津力达口服液以益气养阴、健脾运津为主,以清热、化湿、活血为辅。主要成分人参治脾气不足,黄精滋养固摄脾阴,麦门冬、苦参养阴生精,葛根清热,苍术、佩兰化湿,丹参活血。近年来的临床观察也证实了津力达口服液具有十分重要的临床价值[21-24]。
本研究发现,高脂饲养大鼠可致其体质量明显增加,血糖、血清、TG、TC 水平明显升高,津力达治疗组上述指标明显改善。另外,肾脏是比较明显的受累器官,SOD 活性,MDA 浓度及AGE 等均是反映机体氧化应激水平的可靠指标,间接反映肾脏损伤的程度。本研究结果显示,糖尿病模型组血清及肾脏内SOD 较正常对照组显著降低,血清GSH-Px 较正常对照组升高,说明糖尿病模型组肾脏内氧化应激水平升高,抗氧化能力下降。机体内GSH-Px 和NO 水平浓度也间接反映大鼠器官功能的损伤程度。本研究结果显示,糖尿病模型组血清GSH-Px较正常对照组显著降低,NO 显著升高。用津力达口服液干预8 周后,津力达治疗组较糖尿病模型组肾脏及血液各项指标均有一定程度的改善,因此认为津力达口服液可以有效抑制2 型糖尿病模型大鼠体内的氧化应激反应。
综上所述,津力达口服液可改善2 型糖尿病模型大鼠体内氧化应激标志物的表达,可能对糖尿病并发症有一定的防治作用,但其防治糖尿病并发症的疗效、作用机制有待于更深入的体内外实验进行验证。
[1]Whiting D R,Guariguata L,Weil C,et al.IDF diabetes atlas:global estimates of the prevalence of diabetes for 2011 and 2030[J].Diabetes Res Clin Pract,2011,94(3):311-321.
[2]Bonsembiante B,Dalfra M G,Masin M,et al.Adult-onset type 1 diabetes and pregnancy:three case reports[J].Case Report Med,2013,2013:920861.
[3]Hu F B.Globalization of diabetes:the role of diet,lifestyle,and genes[J].Diabetes Care,2011,34(6):1249-1257.
[4]Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414(6865):813-820.
[5]Monnier V M,Sell D R,Nagaraj R H,et al.Maillard reaction-mediated molecular damage to extracellular matrix and other tissue proteins in diabetes,aging,and uremia[J].Diabetes,1992,41(Suppl 2):36-41.
[6]Scott J A,King G L.Oxidative stress and antioxidant treatment in diabetes[J].Ann N Y Acad Sci,2004,1031:204-213.
[7]Sood A,Cunningham C,Lin S.The BB Wistar Rat as a Diabetic Model for Fracture Healing[J].ISRN Endocrinol,2013,2013:349-604.
[8]Tremblay A J,Lamarche B,Deacon C F,et al.Effect of sitagliptin therapy on postprandial lipoprotein levels in patients with type 2 diabetes[J].Diabetes Obes Metab,2011,13(4):366-373.
[9]Kostev K,Rathmann W.Changes in time to insulin initiation in type 2 diabetes patients:A retrospective database analysis in Germany and UK (2005-2010)[J].Prim Care Diabetes,2013,16(3):316-322.
[10]Keski Nisula J,Pesonen E,Olkkola K T,et al.Methylprednisolone in neonatal cardiac surgery:reduced inflammation without improved clinical outcome[J].Ann Thorac Surg,2013,95(6):2126-2132.
[11]Maritim A,Dene B A,Sanders R A,et al.Effects of pycnogenol treatment on oxidative stress in streptozotocin-induced diabetic rats[J].J Biochem Mol Toxicol,2003,17(3):193-199.
[12]Nesic D M,Stevanovic D M,Stankovic S D,et al.Agedependent modulation of central ghrelin effects on food intake and lipid metabolism in rats[J].Eur J Pharmacol,2013,7(5):123-137.
[13]Ishitobi T,Hyogo H,Tokumo H,et al.Efficacy of probucol for the treatment of nonalcoholic steatohepatitis with dyslipidemia:An open-label,pilot study[J].Hepatol Res,2013,11(2):2177-2183.
[14]Blasi C,Kim E,Knowlton A A.Improved Metabolic Control in Diabetes,HSP60,and Proinflammatory Mediators[J].Autoimmune Dis,2012,14(3):1221-1226.
[15]Gruson D,Ahn S A,Rousseau M F.Biomarkers of inflammation and cardiac remodeling:the quest of relevant companions for the risk stratification of heart failure patients is still ongoing[J].Biochem Med (Zagreb),2011,21(3):254-263.
[16]Leon B,Jenkins S,Pepin K,et al.Insulin and extremity muscle mass in overweight and obese women[J].Int J Obes (Lond),2013,23(1):811-839.
[17]Chavali V,Tyagi S C,Mishra P K.Predictors and prevention of diabetic cardiomyopathy[J].Diabetes Metab Syndr Obes,2013,6(3):151-160.
[18]Duprez J,Roma L P,Close A F,et al.Protective antioxidant and antiapoptotic effects of ZnCl2 in rat pancreatic islets cultured in low and high glucose concentrations[J].PLoS One,2012,7(10):e46831.
[19]Wang H.Preventive effects of ophiopogon-polysaccharide on apiponectin in gestational diabetes mellitus rat[J].Asian Pac J Trop Med,2013,6(4):296-299.
[20]Verges B,Avignon A,Bonnet F,et al.Consensus statement on the care of the hyperglycaemic/diabetic patient during and in the immediate follow-up of acute coronary syndrome[J].Diabetes Metab,2012,38(2):113-127.
[21]杜彦侠,陈亮,丁英钧,等.津力达颗粒联合通心络胶囊治疗糖尿病肾病的疗效观察[J].疑难病杂志,2012,11(6):11.
[22]罗方,胡江平.津力达颗粒辅助治疗2 型糖尿病临床观察[J].医药前沿,2012(2):23.
[23]蒋美云.津力达对2 型糖尿病患者胰岛素抵抗的影响[J].中国医药指南,2013,11(8):272-273.
[24]高怀林,张建军,吴以岭,等.津力达颗粒对2 型糖尿病胰岛β 细胞功能的影响[J].时珍国医国药,2010,21(5):1119-1120.

