木果楝内酯抑制人乳腺癌脑转移细胞增殖活性的研究
李 明,刘 霞,郭书翰,董 玫,杜正伦,高鹏志,宋铁鹰,史清文石家庄市第一医院, 河北石家庄 0500; 河北医科大学基础医学院法医学系,河北省法医学重点实验室,河北石家庄 05007
近年来随着医疗技术水平的提高,原位乳腺癌患者生存期明显延长,但当乳腺癌发生远处转移时严重影响了患者的预后,尤其脑转移患者预后最差[1],且据统计,脑转移发生率呈增加趋势[2]。由于目前医学界尚缺乏特效药物降低肿瘤转移率、延长患者生存期,因此开发可有效抑制肿瘤转移、不良反应小、价格低廉的天然植物药物一直是当前医药学界研究的热点。楝科植物木果楝(xylocarpus granatum)是一种生长在热带沿海地带的红树林植物,在我国主要生长于海南地区,民间用其树皮治疗赤痢,种仁用作滋补品[3-4]。已有学者发现木果楝中的植物化合物成分具有抗宫颈癌及肺癌作用[5]。本研究首次检测了三种木果楝内酯抑制人乳腺癌脑转移(KT)细胞增殖的效应,通过检测凋亡相关蛋白p53、Bax和Caspase-3蛋白表达变化,探讨木果楝内酯抑制人乳腺癌脑转移细胞增殖的分子机制。
材料和方法
1 主要材料 三种木果楝内酯化合物Xylogranatin C[6]、Xylocarpin H[7]和Xylomexicanin A[8]由河北医科大学药学院天然药物化学教研室从木果楝种子中纯化提供,经1H-NMR检查,纯度在99%以上(图1);KT细胞由日本千叶大学医学部第二生物化学教室提供,细胞培养用RPMI 1640培养基(美国,GIBCO);噻唑蓝(MTT,美国Sigma公司,M-2128);顺铂(Cisplatin,美国Sigma,034k3693);鼠抗Bax多克隆抗体(sc-7480)、鼠抗p53多克隆抗体(sc-1615-R)以及二抗(sc-2056,sc-2054)均为SANTA CRUZ BIOTECHNOLOGY产品;兔抗Caspases-3多克隆抗体(2305-PC-020;Trevigen,MD,USA),caspase抑制剂Z-VAD-FMK(Promega,USA)。

图 1 木果楝内酯化合物Xylogranatin C (1)、 Xylocarpin H (2)和Xylomexicanin A (3)的结构Fig. 1 Chemical structures of xylogranatins C (1), H (2) and A (3)
2 MTT法检测木果楝内酯化合物抑制KT细胞增殖活性 取对数生长期KT细胞,0.125%胰酶消化,接种于96孔培养板,每孔含1×104个细胞。实验分组为:溶剂对照组(含终浓度0.1% DMSO)、5-氟尿嘧啶(5-FU)、顺铂及木果楝内酯化合物Xylogranatin C、Xylocarpin H和Xylomexicanin A。后5组中药物终浓度分别设为1 μmol/L、10 μmol/L和100 μmol/L;上述实验各组药物均用终浓度0.1% DMSO溶解。每组均设3个复孔,置于饱和湿度、37 ℃和5% CO2培养箱中培养48 h,于培养结束前4 h,各培养孔加入5 mg/ml四甲基偶氮唑蓝(MTT)10 μl,酶联免疫检测仪测定各孔吸光度值(OD值),计算细胞生存率,细胞生存率(%)=实验组OD值/对照组OD值×100%。实验数据用Origin 7.0软件进行处理,受试药物对细胞增殖活性的浓度-效应曲线用Hill数学模型拟合,计算药物的IC50值。
3 Western blot检测凋亡相关蛋白的表达变化将KT细胞接种于培养皿中,待细胞生长融合至60%~70%,分别加入终浓度为10 μmol/L的5-氟尿嘧啶、顺铂和Xylogranatin C的含0.1% DMSO的1640培养基,溶剂对照组加入终浓度为0.1% DMSO的1640培养基,培养细胞24 h,用PBS洗涤细胞后,胰酶消化细胞,离心收集细胞,加入蛋白裂解液,冰浴下超声波处理5 min,15 000 r/min离心15 min,取上清液,BCA法测定蛋白浓度,100 ℃加热3 min使蛋白质变性,取50 μg蛋白在SDSPAGE电泳下分离,分离胶为12%,浓缩胶为5%。根据预染的蛋白Marker指示,小心割取目标蛋白所在的区带,电转移至硝酸纤维膜,用5%脱脂奶粉于室温下摇动封闭1 h。Caspases-3兔多克隆抗体(1∶800)、Bax鼠多克隆抗体(1∶1 000)、p53鼠多克隆抗体(1∶1 000)稀释液封闭4 °过夜,1×TBS洗膜15 min,3次,二抗稀释液(抗鼠1∶20 000,抗兔1∶20 000)孵育20 min,再次洗膜后加入ECL试剂,反应5 min,用X线片曝光1~10 min后,显影。
4 Caspase抑制剂在木果楝内酯化合物抑制人KT细胞增殖中作用 MTT方法同前,96孔培养板,每孔含1×104个细胞,实验分组为:溶剂对照组、终浓度分别为1 μmol/L、10 μmol/L和100 μmol/L的Xylogranatin C组,20 μmol/L的Caspase抑制剂Z-VAD-FMK与1 μmol/L、10 μmol/L和100 μmol/L Xylogranatin C共同孵育组,细胞生存率计算方法同前,比较给予Z-VAD-FMK前后KT细胞的生存率变化。
5 统计学处理 数据用-x±s表示;两组间数据用t检验,多组间数据用单因素方差分析。应用SAS 6.12统计软件进行统计学分析。
结 果
1 三种木果楝内酯化合物对KT细胞增殖抑制作用MTT结果显示:与溶剂对照组(生长率为100%)相比,顺铂对KT细胞的增殖显示了较强的抑制活性,IC50为6.61 μmol/L;Xylogranatin C对KT细胞的增殖亦显示了较强的抑制作用,IC50为5.09 μmol/L,并呈现剂量依赖性;且10 μmol/L Xylogranatin C与顺铂相比具有相同的抑制作用,两者相比无统计学差异(P>0.05);5-FU以及Xylocarpin H和Xylomexicanin A对KT增殖显示较弱或不显示抑制活性。见图2。
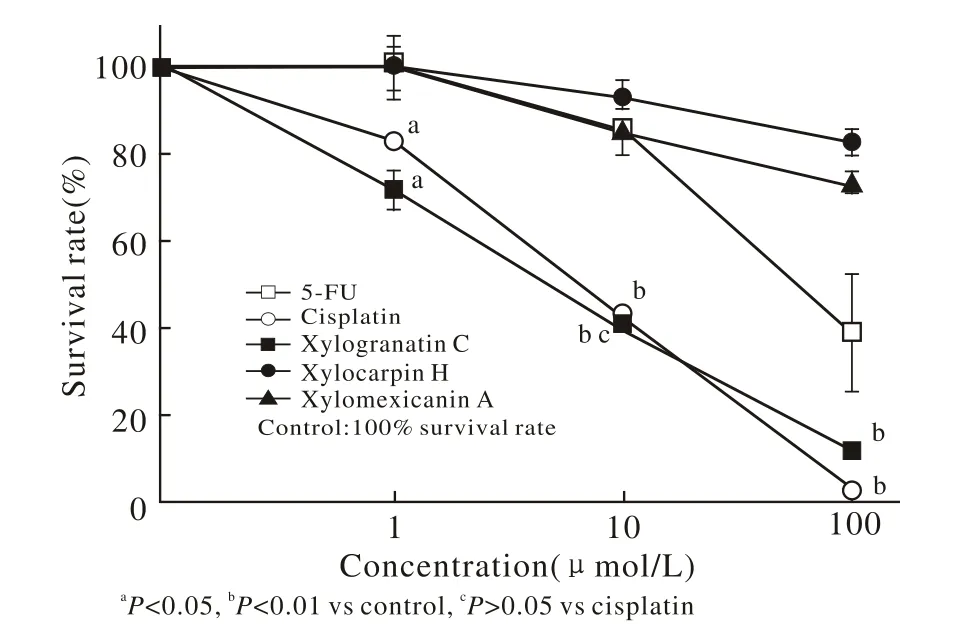
图 2 三种木果楝内酯化合物对KT细胞增殖的抑制作用Fig. 2 Inhibitory effects of xylogranatins C, H and A on proliferation of KT cells
2 Xylogranatin C对KT细胞p53、Bax和Caspaes-3的上调作用 Weston结果显示:Xylogranatin C作用KT细胞后,可上调细胞内p53、Bax和Caspaes-3蛋白的表达,与溶剂对照组相比,有统计学差异(P<0.05);顺铂作用KT细胞后,显著上调细胞内的Bax和Caspaes-3蛋白表达,与溶剂对照组相比较,有统计学差异(P<0.01);Xylogranatin C组与顺铂组比较,Bax和Caspaes-3的蛋白表达低于顺铂组,且有统计学差异(P<0.01)。见图3。

图 3 Xylogranatin C(10 μmol/L)对KT细胞增殖作用的分子机制Fig. 3 Molecular mechanism of xylogranatin C (10 μmol/L)underlying proliferation of KT cells
3 Caspase抑制剂减弱了Xylogranatin C的细胞毒性作用 使用1μmol/L、10μmol/L和100 μmol/L的Xylogranatin C处理KT细胞,KT细胞生存率分别为71.97%、39.91%和11.15%;使用20 μmol/L的Caspase抑制剂Z-VAD-FMK与1μmol/L、10μmol/L和100 μmol/L Xylogra-natin C共同孵育KT细胞后,细胞生存率分别上升为82.78%、46.27%和30.99%。见图4。

图 4 Z-VAD-FMK减弱Xylogranatin C对KT细胞增殖的作用Fig. 4 Role of Z-VAD-FMK in reversing the inhibitory effect of xylogranatin C on KT cells
讨 论
乳腺癌患者预后与其是否发生转移密切相关,一旦发生远端转移,如脑转移、肝脏转移、骨转移等预后较差,生存期明显下降,增加了临床治疗的困难[9]。此外,以腋窝淋巴结转移为首发症状的隐性乳腺癌的发生呈增加趋势[10],目前针对乳腺癌,除手术切除原发灶外,化疗、内分泌治疗及分子靶向治疗相结合在乳腺癌远位转移中的应用受到越来越多的关注[11-12],但寻找高效低毒、价格低廉的抑制肿瘤转移的天然植物药物仍是目前医药学界一直研究的热点,具有一定的临床应用前景。
本实验室前期实验结果证实从楝科植物木果楝种子中提纯的木果楝内酯Xylogranatin C化合物具有较强抑制人肺肿瘤细胞增殖活性的能力[13],其是否具有抑制乳腺癌肿瘤细胞的增殖作用尚未研究。
本实验首次选用从楝科植物木果楝种子中纯化的三种木果楝内酯Xylocarpin H、Xylogranatin C和Xylomexicanin A为实验对象,观察了三种木果楝内酯对人乳腺癌脑转移细胞增殖的抑制活性,实验结果显示Xylogranatin C对KT细胞增殖显示较强的抑制活性,且与顺铂作用相当,而5-FU对KT细胞增殖的抑制作用不明显。
在探究药物抗肿瘤细胞的机制方面,能否引起肿瘤细胞凋亡已成为评价抗癌药物的一项重要指标[14]。目前已知多条途径诱导细胞凋亡,Caspase属于半胱氨酸蛋白酶家族,在细胞凋亡调节网络中起关键作用,Caspase 3被认为是Caspase级联反应中最关键的效应蛋白酶;Bax是另一种促进凋亡因子,Bcl-2/Bax镶嵌在线粒体膜上,调控凋亡诱导蛋白的释放和线粒体功能;此外,p53对诱导和执行细胞死亡起重要作用[15],p53非转录依赖性凋亡调控功能依赖于p53蛋白与Bcl-2蛋白超家族成员(Bak,Bax,Bcl-2)间的相互作用。因此本实验观察了与细胞凋亡相关蛋白因子p53、Bax、Caspase-3的蛋白表达变化。实验研究发现,Xylogranatin C可明显诱导KT细胞内的p53、Bax和Caspase-3蛋白表达上调,表明Xylogranatin C通过诱导KT细胞凋亡抑制了肿瘤细胞增殖。使用Caspase抑制剂Z-VAD-FMK可以减弱Xylogranatin C的细胞毒性作用,提示Xylogranatin C可能通过激活Caspase通路诱导KT细胞凋亡发挥抗肿瘤细胞增殖的作用。
本实验初步研究了木果楝内酯化合物抑制人乳腺癌脑转移细胞增殖的分子机制,限于体外实验的局限性,Xylogranatin C是否能够应用于整体实验抑制肿瘤增殖,以及其抗肿瘤细胞增殖的分子机制还需要进一步研究和完善。
1 苗培田,佟仲生,郝春芳,等.不同亚型转移性乳腺癌转移特点及预后分析[J].中国肿瘤临床,2011,38(4):228-231.
2 李艳,王丕琳,宋茂民,等.乳腺癌脑转移治疗的研究进展[J].中国癌症杂志,2009,19(4):313-317.
3 林鹏,林益明,杨志伟,等.中国海洋红树林药物的研究现状、民间利用及展望[J].海洋科学,2005,29(9):76-79.
4 Yin S, Wang XN, Fan CQ, et al. Limonoids from the seeds of the Marine mangrove Xylocarpus granatum[J] . J Nat Prod, 2007, 70(4): 682-685.
5 戴好富,梅文莉,曾艳波,等.红树林植物木果楝细胞毒活性和化学成分研究[J].天然产物研究与开发,2007,19(1):74-76.
6 Yin S, Fan CQ, Wang XN, et al. Xylogranatins A-D: novel tetranortriterpenoids with an unusual 9,10-seco scaffold from Marine mangrove xylocarpus granatum[J]. Org Lett, 2006, 8(21):4935-4938.
7 Shen LR, Dong M, Guo D, et al. Xylomexicanins A and B, new Delta14,15-mexicanolides from seeds of the Chinese mangrove Xylocarpus granatum[J]. Z Naturforsch C, 2009, 64(1-2):37-42.
8 王思明,王溪,苏晓会,等. 续随子中千金二萜烷化合物抑制人妇科肿瘤细胞增殖活性的研究[J]. 中国药理学通报,2011,27(6):774-776.
9 靳鹏,谢晓冬,刘兆喆,等. 异黏蛋白在复发转移性乳腺癌表达及其临床意义的研究[J]. 解放军医学院学报,34(2):133-136.
10 李捷,张艳君,王建东,等.以腋窝淋巴结转移为首发症状的隐性乳腺癌诊治分析[J].军医进修学院学报,2011,32(5):418-419,482.
11 张帆,杨俊兰.乳腺癌靶向治疗进展[J].军医进修学院学报,2009,30(5):757-758.
12 尉承泽,江泽飞.乳腺癌治疗基本原则和临床选择[J].中国实用外科杂志,2009,29( 09):774-776.
13 常和平,王思明,霍长虹,等.木果楝内酯化合物抑制人肺肿瘤细胞增殖活性及作用机制的研究[J].中国药理学通报,2012,28(6):807-810.
14 Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy[J]. Cancer, 1994, 73(8):2013-2026.
15 许薇薇,黄一飞.放射线导致肿瘤细胞死亡的分子生物学机制[J].解放军医学院学报,2013,34(3):304-306.

