Tat融合蛋白表达载体TAT-OCT4的克隆化及蛋白表达研究
王建军,万志红,赵 平,靳雪源,谢国明,辛绍杰1解放军医学院,北京 100853;解放军第30医院,北京 100039
2006年,Takahashi和Yamanaka[1]将OCT4、sox2、c-Myc和klf4基因转染小鼠胚胎成纤维(mouse emb-ryonic fibroblast,MEF)细胞,使其重编程为类似胚胎干细胞的一种细胞类型,即诱导性多能干细胞(induced pluripotent stem cell,iPSC)。已有研究发现,iPSCs可分化为多种组织细胞,如造血前体和功能的破骨细胞[2],胰腺胰岛素产生细胞[3],心肌细胞[4],感光细胞[5]和神经转换细胞[6]、肝细胞[7-8],具有广阔的临床应用前景。但是既往的研究中,iPSC的生成,通过逆转录病毒或慢病毒载体将转录因子引入细胞,存在着激活致癌基因或抑制抑癌基因的可能性。蛋白导入细胞效率低。采用Tat融合蛋白转导的方式将转录因子转入细胞,避免了逆转录病毒和慢病毒载体导致肿瘤发生的潜在风险,也提高了转导效率。为建立安全的诱导性多能干细胞株,我们构建了其中一个重要的转录因子OCT4的Tat融合蛋白表达载体TAT-OCT4。
材料和方法
1 材料和试剂 载体PET-28b-TAT-V2(美国霍华德休斯医学研究所Steven Dowdy教授惠赠)。人皮肤成纤维(human skin fibroblasts,HSF)细胞由昆明细胞中心提供。PCR回收试剂盒、质粒提取试剂盒、凝胶回收试剂盒、NdeⅠ、BamHⅠ及T4 DNA连接酶,TransStart FastPfu DNA Polymerase购自全式金公司。DL5000购自TaKaRa公司。琼脂糖购自上海Yito公司。卡那霉素购自华北制药有限公司。Trans1-T1感受态购自全式金公司,NI-4FF亲和层析柱,PD-10脱盐柱购于美国GE公司。寡核苷酸引物合成及DNA序列测定由生工公司完成。OCT4单克隆抗体、辣根酶标记山羊抗鼠IgG(H+L)二抗、FITC标记亲和纯化山羊抗小鼠IgG(H+L)二抗购自Abgent公司(美国)。
2 OCT4基因引物设计与合成 用RT-PCR从人胚胎干细胞的poly(A+)RNA中扩增OCT4的cDNA,两端分别引入NdeⅠ和BamHⅠ酶切位点,引物为:上游引物:5'GGATCCGACCTGGCTAAGCTTCCAAG3';下游引物:5'GCTAGCCTGAGAAAGGAGACCCAGC AG3' PCR扩增条件:95 ℃预变性5 min,然后95 ℃变性30 s、52 ℃退火30 s、72 ℃延伸90 s,循环35次后,72 ℃保温10 min。1%琼脂糖凝胶电泳鉴定扩增结果。
3 TAT-OCT4载体的构建 OCT4基因PCR扩增产物及载体PET-28b-TAT-V2经NdeⅠ和XhoⅠ双酶切后应用EasyPureTM PCR Purification Kit试剂盒纯化回收,在T4连接酶的作用下16 ℃连接过夜后,转化Trans1-T1感受态,在卡那霉素阳性细菌平板筛选出单个阳性克隆,提取细菌质粒行NdeⅠ和BamHⅠ双酶切鉴定,并送生工公司测序。
4 TAT-OCT4融合蛋白的表达纯化及Western blot检测 待测序验证正确后,用电击转化法将正确的质粒导入到BL21菌中。取10 μl的BL21菌转入5 ml新鲜卡那霉素LB培养基中,37 ℃,250 r/min过夜振荡培养。第2天按1∶250把摇起的菌接入新鲜培养基,1 L。37 ℃,250 r/min振荡培养至菌浓度OD=0.6,然后加入终浓度1 mm异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactopyranoside,IPTG)诱 导3 h。收集培养的菌入50 ml高速离心管,离心去掉培养基,加入PBS悬起菌,离心去除上清。加入35 ml PBS,用超声波破碎机,破碎25 min,功率200 W。13 000 r/min离心5 min,去除上清,加入PBS悬起超声后沉淀,离心去除上清。沉淀主要为包涵体,将包涵体溶于8 mol/L尿素溶液中,用GE NI- 4FF亲和层析柱进行纯化,250 mmol/L的咪唑洗脱结合于柱上的蛋白,收集蛋白峰,用PBS透析后,纯化产物进行SDS-PAGE电泳分析。纯化后的蛋白用PD-10柱子脱盐。脱盐后的蛋白样品取20 μl行SDS-PAGE电泳,蛋白转膜后,以鼠源抗OCT4单克隆抗体(1∶1 000稀释)为一抗,碱性磷酸酶标记的羊抗鼠IgG(1∶5 000稀释)为二抗行Western Blot检测。凝胶成像扫描系统扫描分析结果。
5 TAT-OCT4融合蛋白转导HSF细胞的免疫荧光检测 取HSF细胞以5×104个/ml接种入24孔板内,过夜培养后加入8 μg/ml的TAT-OCT4蛋白,2 h后弃培养基,PBS洗3次。4%多聚甲醛固定细胞15 min,PBS洗3次。加入抗OCT4单克隆抗体(浓度为1∶50),37℃孵育1 h,PBS洗3次,加入抗山羊抗小鼠IgG-FITC(浓度为1∶50),37 ℃孵育1 h,PBS洗3次,荧光显微镜观察。
结 果
1 OCT4基因的扩增 经RT-PCR反应后,1%琼脂糖凝胶电泳见约1.0 kb处有亮带,与预计OCT4基因片段大小相符,见图1。
2 TAT-OCT4的酶切鉴定及测序报告 挑取单个白色菌斑,扩大培养并提取质粒,分别经NdeⅠ和XhoⅠ双酶切鉴定,双酶切结果显示在4.8 kb和1.0 kb均有亮带,说明酶切片段的大小和插入方向均与预计相同,见图2;将鉴定正确的菌液送生工公司基因测序,利用NCBI的BLAST服务器对Oct4序列进行的分析同源性达到100%,以上结果均表明表达载体TAT-OCT4构建成功。
3 TAT-OCT4融合蛋白的诱导和纯化 重组质粒TAT-OCT4转化大肠埃希菌BL21,挑取单个菌落培养经IPTG诱导后均获得高效表达,对菌体总蛋白、上清和沉淀蛋白分别进行电泳分析,发现重组蛋白TAT-OCT4主要以沉淀形式表达,见图3。经GE NI-4FF亲和层析柱进行纯化,纯化产物进行SDS-PAGE电泳分析。在50 KU左右见到一特异性蛋白条带,与预期结果一致,见图4。
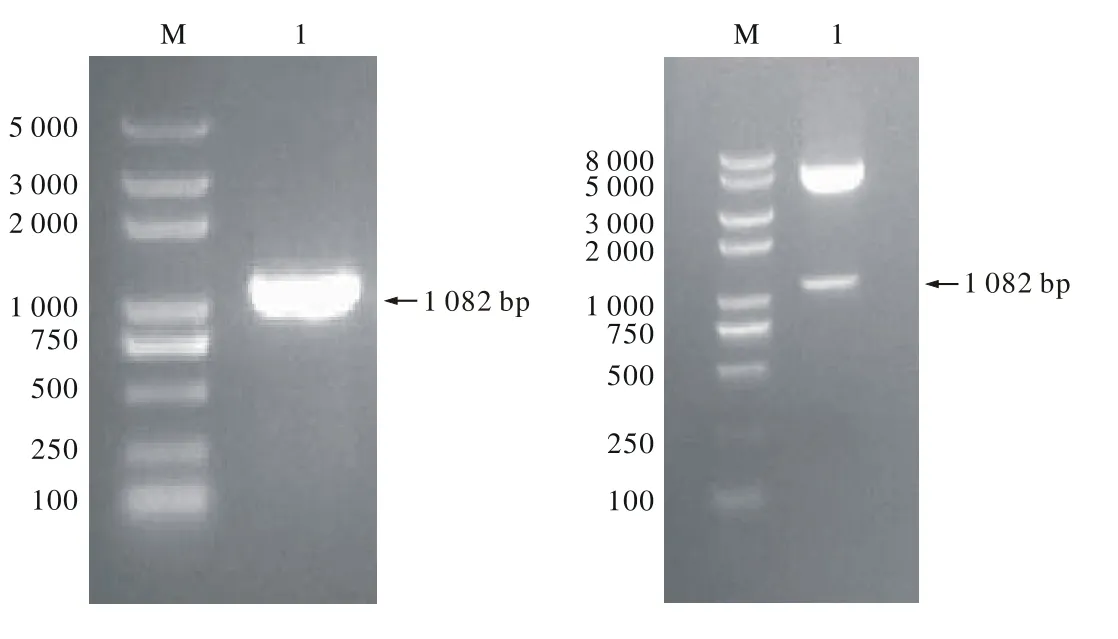
图 1 OCT4基因PCR电泳图(左) M:marker(bp); 1: OCT4基因PCR纯化片段图 2 TAT-OCT4重组质粒NdeⅠ和BamHⅠ双酶切鉴定图(右) M:DNA marker(bp); 1:TAT-OCT4质粒NdeⅠ和XhoⅠ双酶切Fig. 1 PCR electrophoresis of OCT4 gene(left) M: DNA marker(bp);1: PCR-purif i ed fragments of OCT4Fig. 2 NdeⅠand BamHⅠdigestion of recombinant TAT-OCT4 plasmid(right) M: DNA marker(bp); 1: The TAT-OCT4 plasmid was digested by NdeⅠand BamHⅠ
4 TAT-OCT4融合蛋白的Western Blot鉴定取SDS-PAGE分析证实含有目的蛋白的洗脱液样品, 鼠源抗OCT4单克隆抗体为一抗进行Western Blot鉴定。结果显示的蛋白与抗OCT4抗体有良好的反应性,见图5。
5 TAT-OCT4融合蛋白转导HSF细胞实验TAT-OCT4融合蛋白转导HSF细胞2 h后,倒置荧光显微镜可见细胞内有明显分布的红色荧光,见图6。提示融合蛋白已快速转导入细胞内,故融合蛋白有快速转导入细胞的能力。
讨 论
诱导性多能干细胞具有形成人和动物个体所有类型细胞的多向分化潜能、可以不断自我更新,很容易从单个病人的体细胞获得。通过它可以了解遗传性疾病的发病机制和临床疾病表现的关系,以利于筛选新的治疗药物和发现药物新的药理作用。同时,由于其具有自我更新、增殖和分化的全能性,且绕开了胚胎干细胞研究一直面临的伦理和法律等诸多障碍,已成为细胞替代治疗新的研究热点。经典的诱导性多能干细胞的产生是通过逆转录病毒或慢病毒载体将转录因子引入细胞来诱导,但存在着激活致癌基因或抑制抑癌基因的可能性。直接应用蛋白导入细胞可以避免这种风险。但生物膜的屏障使很多活性蛋白难以进入细胞或者特殊的器官组织,因此把活性蛋白从细胞外直接导入细胞的蛋白转导结构域(protein transduction domain,PTD)成为目前研究的热点。PTD能把与之共价相连的蛋白质、核酸和化合物等,以浓度依赖的方式快速地转导进入培养细胞(15 min内)或动物体内几乎所有细胞(2 h内)。目前已发现多种PTD,其中转导效率最高,研究最多的是HIV-1 TAT蛋白的转导结构域(tans-activator transcription,TAT),它仅由11个氨基酸组成(YGRKKRRQRRR)。在最近报道的研究中,与之相连的多种蛋白质都被成功地转导进了哺乳细胞或动物体内,并产生了相应的生物活性[9-10]。

图 3 TAT-OCT4蛋白的诱导表达(左)M: 标准蛋白质marker; 1: 未诱导全菌; 2: 沉淀; 3:上清图 4 TAT-OCT4蛋白的纯化结果的SD-PAGE分析(右)M: 标准蛋白质marker; 1:样品(上柱前); 2: 样品穿柱; 3: 20 mm咪唑洗脱; 4: 50 mm咪唑洗脱Fig. 3 The induction expression of TAT-OCT4 protein(left)M: Protein marker; 1:Total bacteria; 2: precipitation; 3:supermatantFig. 4 SDS-PAGE showing purif i ed TAT-OCT4 protein(right)M:Protein marker; 1: sample before pass-through the fraction;2: sample before pass-through the fraction; 3: eluted by 20mm Imidazole; 4: eluted by 50 mm Imidazole

图 5 TAT-OCT4蛋白的Western Blot检Fig. 5 Western blot showing TATOCT4
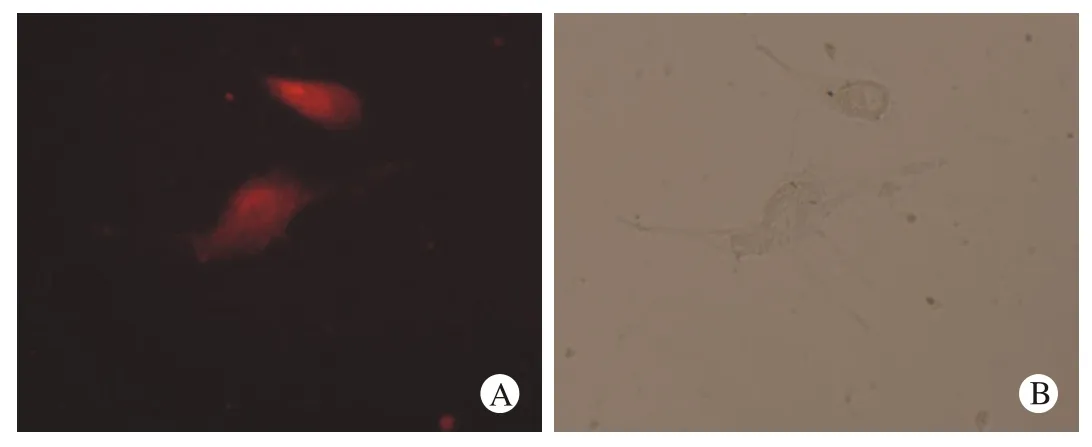
图 6 TAT-OCT4蛋白转导HSF细胞荧光倒置显微镜观察结果(×200)Fig. 6 Fluorescence microscopy showing TAT-OCT4- transduced HSF cells(×200)A: fl uorescence; B: white light
人的OCT4基因位于6号染色体上(6p21.31),是最重要的维持胚胎干细胞多潜能性和自我更新的关键基因,并在不同种系之间高度保守[11]。OCT4蛋白是由Pou5f1基因所编码的,属于POU(PIT/OCT/UNC)转录因子家族Ⅴ类成员,其激活或抑制靶基因的表达是通过结合目的基因启动子或增强子区的八聚体基序ATGCAAAT[12]。作为胚胎干细胞的特异性基因,OCT4主要表达于胚胎和生殖细胞肿瘤中,近年的研究也发现OCT4在非生殖系统肿瘤细胞和组织,如胰腺癌、肝癌、宫颈癌、人乳腺癌和膀胱癌组织中表达[13-15]。非生殖系统肿瘤细胞中表达OCT4的现象可以解释为干细胞致癌的一种证据。也就提示了基因诱导诱导性多能干细胞的致癌风险。另外,目前对重编程机制的研究显示:OCT4是重编程中不可缺少的核心转录因子[16-18],通过直接将OCT蛋白转导入细胞的方式一方面可以起到应用基因转导类似的诱导细胞重编程的功能,又可以避免基因转导所带来的致癌风险。TAT蛋白的转导结构域与OCT4的融合蛋白可以一方面在保留OCT4蛋白活性同时,解决蛋白转导细胞效率低下的问题。
在本实验中,我们从人胚胎干细胞RNA中成功克隆出OCT4基因编码区全序列CDNA,成功构建了它的TAT融合蛋白表达载体,并在大肠埃希菌中成功获得了表达,应用Western Blot进一步鉴定了OCT4表达的正确性,由于重组蛋白TATOCT4主要以沉淀形式表达,经GE NI-4FF亲和层析柱进行纯化,进一步获得了纯化的TAT-OCT4融合蛋白,通过免疫荧光实验,提示融合蛋白具有快速地转导入HSF细胞的能力,为进一步通过蛋白转导方式诱导多能干细胞提供了物质基础。
1 Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell, 2006, 126(4): 663-676.
2 Grigoriadis AE, Kennedy M, Bozec A, et al. Directed differentiation of hematopoietic precursors and functional osteoclasts from human ES and iPS cells[J]. Blood, 2010, 115(14): 2769-2776.
3 Zhang D, Jiang W, Liu M, et al. Highly efficient differentiation of human ES cells and iPS cells into mature pancreatic insulinproducing cells[J]. Cell Res, 2009, 19(4): 429-438.
4 Gai H, Leung EL, Costantino PD, et al. Generation and characterization of functional cardiomyocytes using induced pluripotent stem cells derived from human fibroblasts[J]. Cell Biol Int, 2009, 33(11): 1184-1193.
5 Viczian AS, Solessio EC, Lyou Y, et al. Generation of functional eyes from pluripotent cells[J]. PLoS Biol, 2009, 7(8):e1000174.
6 Chambers SM, Fasano CA, Papapetrou EP, et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling[J]. Nat Biotechnol, 2009, 27(3): 275-280.
7 Gai H, Nguyen DM, Moon YJ, et al. Generation of murine hepatic lineage cells from induced pluripotent stem cells[J].Differentiation, 2010, 79(3): 171-181.
8 Li W, Wang D, Qin J, et al. Generation of functional hepatocytes from mouse induced pluripotent stem cells[J]. J Cell Physiol,2010, 222(3): 492-501.
9 Shang X, Bao Y, Chen S, et al. Expression and purification of TAT-fused carbonic anhydrase III and its effect on C2C12 cell apoptosis induced by hypoxia/reoxygenation[J]. Arch Med Sci, 2012, 8(4):711-718.
10 Yuan H, Fales AM, Vo-Dinh T. TAT peptide-functionalized Gold nanostars: enhanced intracellular delivery and efficient NIR photothermal therapy using ultralow irradiance[J]. J Am Chem Soc, 2012, 134(28): 11358-11361.
11 Morrison GM, Brickman JM. Conserved roles for Oct4 homologues in maintaining multipotency during early vertebrate development[J].Development, 2006, 133(10): 2011-2022.
12 Pesce M, Schöler HR. Oct-4: control of totipotency and germline determination[J]. Mol Reprod Dev, 2000, 55(4): 452-457.
13 Yu H, Fang D, Kumar SM, et al. Isolation of a novel population of multipotent adult stem cells from human hair follicles[J]. Am J Pathol, 2006, 168(6): 1879-1888.
14 Atlasi Y, Mowla SJ, Ziaee SA, et al. OCT-4, an embryonic stem cell marker, is highly expressed in bladder Cancer[J]. Int J Cancer,2007, 120(7): 1598-1602.
15 Ezeh UI, Turek PJ, Reijo RA, et al. Human embryonic stem cell genes OCT4, NANOG, STELLAR, and GDF3 are expressed in both seminoma and breast carcinoma[J]. Cancer, 2005, 104(10):2255-2265.
16 Masui S, Nakatake Y, Toyooka Y, et al. Pluripotency governed by Sox2 via regulation of Oct3/4 expression in mouse embryonic stem cells[J]. Nat Cell Biol, 2007, 9(6):625-635.
17 Park IH, Zhao R, West JA, et al. Reprogramming of human somatic cells to pluripotency with defined factors[J]. Nature, 2008, 451(7175):141-146.
18 Boyer LA, Lee TI, Cole MF, et al. Core transcriptional regulatory circuitry in human embryonic stem cells[J]. Cell, 2005, 122(6):947-956.

