锦州地区腹泻住院儿童星状病毒检测及同源性分析
王 文,牛 科,阚丽丽,张尚松,杜海婷,赵 微辽宁医学院 基础医学院实验动物教研室,辽宁锦州 000;辽宁医学院附属第一医院 检验科,辽宁锦州 000;盘锦市辽河油田总医院,辽宁盘锦 4000
星状病毒(human astrovirus,HAstV)是一种无包膜单股正链RNA病毒,现已知有8个传统的血清型HAstV 1~8和多种新的亚型,如MLB1、AV1、HMO A~C等[1-7]。HAstV-Ⅰ型在全世界范围流行。是引起婴幼儿、老年人和免疫缺陷患者病毒性胃肠炎的重要病原体,也是健康成人发生胃肠炎的病因之一,发病率仅次于轮状病毒(rotavirus,RV)[8-9]。我国星状病毒腹泻的研究、监测和控制工作起步较晚,缺乏相关的系统性研究,而锦州市也未曾开展过相关的专题调查研究。为了解锦州市地区腹泻住院儿童星状病毒感染状况,本实验于2011年10月-2012年3月收集了锦州地区三家医院住院腹泻儿童粪便标本235份,进行星状病毒核苷酸检测和序列测定,并与国内外常见的星状病毒参考株核苷酸序列进行同源性比对和遗传进化分析,以确证病原体和分析其基因特征。
材料和方法
1 样本来源 收集2011年10月-2012年3月锦州市附属一院、锦州市妇婴医院、锦州市中心医院儿科住院腹泻患儿粪便标本235份,患儿年龄2~5岁,发病>3 d,每日排便>3次,且大便性状为水样稀便,大便常规检测无脓细胞及血细胞。样本采用PBS溶液(NaCl 137 mmol/L,KCl 2.7 mmol/L,Na2HPO410 mmol/L,KH2PO42 mmol/L,pH 7.2~7.4)进行1∶5稀释,剧烈漩涡震荡后离心,收集上清液,-80 ℃保存备用。
2 病毒基因组RNA提取及HAstV基因扩增 采用TRziol试剂(invitrogen公司)提取粪便上清液中的病毒RNA。采用RT-PCR法扩增HAstV基因。星状病毒检测引物如表1所示,引物由上海生工生物有限公司合成。分别以下游引物Mon348、Mon270作为反转录引物,采用大连宝生物公司的MMLV RTase cDNA反转录试剂盒进行第一链cDNA合成。以上述cDNA为模板进行RT-PCR反应,第一次PCR反应条件为:95 ℃,5 min预变性 ;95 ℃ 30 s,50 ℃30 s,72 ℃ 50 s进行35个循环,最后延伸10 min,扩增星状病毒ORF1a保守区。第二次PCR反应中退火温度为55 ℃,其余条件相同。扩增产物用1%琼脂糖电泳进行检测。Taq DNA 聚合酶、dNTP等PCR反应试剂购自大连宝生物公司。
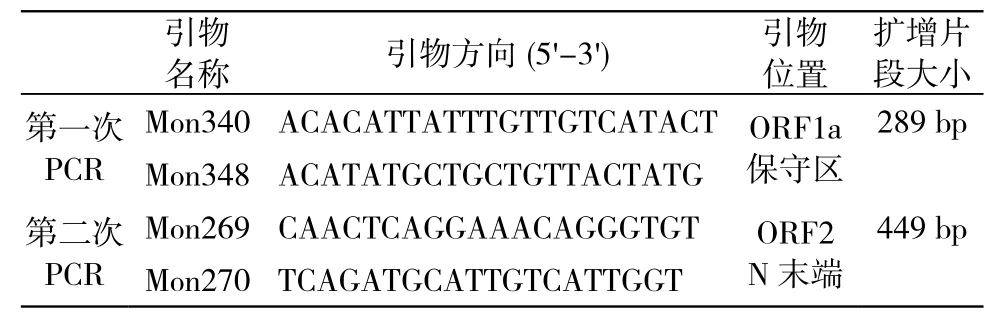
表1 星状病毒检测引物
3 序列测定及遗传进化分析 经电泳检测的PCR阳性产物克隆至PMD-18T载体,进行核酸序列测定,测序由上海生工生物有限公司完成。测序结果与GenBank中的HAstV基因进行序列BLAST比较分析。使用clustal8.0和MEGA4软件的邻近法建立遗传进化树。
结 果
1 RT-PCR结果及感染阳性率 利用Mon340和Mon348对235份粪便标本进行第一次PCR扩增,检测到星状病毒阳性29份,扩增产物289 bp(图1),阳性率为12.3%。扩增的阳性29份样本采用Mon269和Mon270引物进行第二次PCR扩增,所有样本均检测到450 bp的目的条带(图2),与预期结果相符。
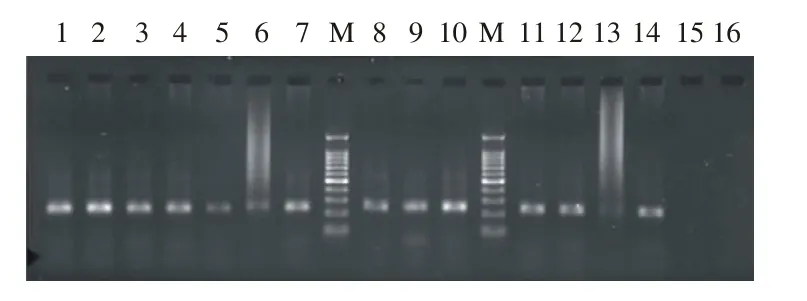
图 1 部分阳性样本第一次RT-PCR检测结果泳道1-16为部分样本扩增结果, 泳道M为100 bp marker

图 2 部分阳性样本第二次PCR检测结果泳道1-11为部分样本扩增结果, 泳道M为DL2000 marker
2 多序列对比分析 扩增的29份阳性样本中,我们选择了检出信号较强的5份进行测序分析,分别命名为jinzhou-1、jinzhou-2、jinzhou-3、jinzhou-4、jinzhou-5。经过核酸相似性分析,5个样本序列测序结果之间核苷酸相似性和氨基酸相似性均为99%。我们采用ORF2衣壳蛋白基因,基于348 bp进行不同国家地域星状病毒序列的多序列对比分析,结果表明:本实验分离的毒株与文献报道的我国北京、武汉、大连、沈阳毒株核酸相似性均在89%~90%,而与美国毒株3085/1999、哥伦比亚毒株COL359、德国毒株AC10BR/2005、巴西毒株RJ8408、西班牙毒株Bcn1.5核酸相似性高达96%~97%,提示本研究分离到的星状病毒毒株在遗传进化上可能与我国已报道的毒株具有一定差异性。
3 遗传进化分析 以扩增的ORF2区序列348 bp为标准,采用Neighbour-joining法构建进化树,并进行lineage分类。本研究中分离到的毒株属于HAstV-1型1d亚型,与本研究室前期在儿童暴发腹泻粪便样本中分离的星状病毒Astro-CHN/LiaoNing毒株(结果尚未发表)相似性达到98%,属于同一个基因型和lineage。而与我国目前已经分离的星状病毒毒株不属于一个亚型,见图3。

图 3 HAstV基于ORF2基因348bp核酸序列的遗传进化分析
讨 论
星状病毒诱导的病毒性胃肠炎在世界范围内普遍流行,感染率通常为2%~9%[10-12]。国外文献报道HAstV在儿童住院腹泻病例中的检出率为0.6%~14%[7]。中国部分地区腹泻患儿中星状病毒的感染率为8.7%~16.6%,而本研究HAstV检出率为12.3%(29/235)[13]。
本研究采用两侧RT-PCR检测星状病毒感染,第一次采用星状病毒非结构蛋白ORF1a作为扩增引物,该区域在所有星状病毒亚型中高度保守,可以扩增所有星状病毒亚型,以免出现漏检现象[14]。第二次采用星状病毒结构蛋白ORF2 N端区域作为扩增区域,ORF2为病毒衣壳蛋白,其N端序列可以作为不同星状病毒亚型分型的依据,用来确定星状病毒的型别[15]。本研究采用两次PCR进行扩增,避免了漏检及出现假阴性结果,大大提高了病毒检出的特异性和准确性。但本研究中所用的引物不能扩增新型星状病毒亚型如MLB型、 VA型、HMOAstV型,样本中是否存在新型星状病毒亚型感染还尚未确定。
根据星状病毒衣壳蛋白ORF2序列的348 bp分型序列的变异情况,可以对同一个型别的星状病毒毒株进行lineage划分,将该区域序列的变异性在7%以内的划分为同一个lineage。根据这个原则,HAstV-1分为6个lineage(lineage 1a~1f)。根据国内报道过的HAstV-1 lineage,中国地区流行的HAstV-1 均以lineage 1b为主。而本研究中分离的HAstV-1为lineage 1d,与我国武汉和北京分离的HAstV-1流行毒株不属于同一个lineage,这有可能与不同的地域差异及样本采集当时流行的毒株特点有关[16-17]。
本研究通过对2011年10月-2012年3月锦州市三家医院病毒性腹泻病原学情况进行检测,初步分析和总结了锦州市病毒性腹泻实验室监测数据及病毒病原的构成,为今后研究星状病毒的分子流行病学,探讨病毒起源、变异、进化途径等提供了依据。
1 Madeley CR, Cosgrove BP. Letter: 28 nm particles in faeces in infantile gastroenteritis[J]. Lancet, 1975, 2(7932): 451-452.
2 De Benedictis P, Schultz-Cherry S, Burnham A, et al. Astrovirus infections in humans and animals - molecular biology, genetic diversity, and interspecies transmissions[J]. Infect Genet Evol,2011, 11(7): 1529-1544.
3 Finkbeiner SR, Le BM, Holtz LR, et al. Detection of newly described astrovirus MLB1 in stool samples from children[J]. Emerg Infect Dis, 2009, 15(3): 441-444.
4 Finkbeiner SR, Li Y, Ruone S, et al. Identification of a novel astrovirus (astrovirus VA1) associated with an outbreak of acute gastroenteritis[J]. J Virol, 2009, 83(20): 10836-10839.
5 Finkbeiner SR, Holtz LR, Jiang Y, et al. Human stool contains a previously unrecognized diversity of novel astroviruses[J]. Virol J,2009, 6:161.
6 Glass RI, Noel J, Mitchell D, et al. The changing epidemiology of astrovirus-associated gastroenteritis: a review[J]. Arch Virol Suppl, 1996, 12:287-300.
7 Kapoor A, Li L, Victoria J, et al. Multiple novel astrovirus species in human stool[J]. J Gen Virol, 2009, 90(Pt 12): 2965-2972.
8 Fields BN, Knipe DM, Howley PM, et al. Fields virology[M]. 3rd.Philadelphia:Lippincott-Raven Publishers, 811-824.
9 Giordano MO, Martinez LC, Rinaldi D, et al. Diarrhea and enteric emerging viruses in HIV-infected patients[J]. AIDS Res Hum Retroviruses, 1999, 15(16):1427-1432.
10 Resque HR, Munford V, Castilho JG, et al. Molecular characterization of astrovirus in stool samples from children in São Paulo, Brazil[J]. Mem Inst Oswaldo Cruz, 2007, 102(8): 969-974.
11 Chen SY, Chang YC, Lee YS, et al. Molecular epidemiology and clinical manifestations of viral gastroenteritis in hospitalized pediatric patients in Northern Taiwan[J]. J Clin Microbiol, 2007, 45(6):2054-2057.
12 Guix S, Caballero S, Villena C, et al. Molecular epidemiology of astrovirus infection in Barcelona, Spain[J]. J Clin Microbiol,2002, 40(1): 133-139.
13 方肇寅,孙亚萍,叶新华,等. 中国七个地区1998-2005年急性腹泻住院患儿中星状病毒感染研究[J]. 中华流行病学杂志,2006,27(8):673-676.
14 牛科,单思,巴彩凤. 人星状病毒Ⅰ型衣壳蛋白序列分析[EB/J].http://www.cnki.net/kcms/detail/11.3275.R.20121126.1005.001.html
15 Dong J, Dong L, Méndez E, et al. Crystal structure of the human astrovirus capsid spike[J]. Proc Natl Acad Sci U S A, 2011, 108(31): 12681-12686.
16 Guo L, Xu X, Song J, et al. Molecular characterization of astrovirus infection in children with diarrhea in Beijing, 2005-2007[J]. J Med Virol, 2010, 82(3): 415-423.
17 Liu MQ, Yang BF, Peng JS, et al. Molecular epidemiology of astrovirus infection in infants in Wuhan, China[J]. J Clin Microbiol, 2007, 45(4): 1308-1309.

