半月板损伤程度与膝关节软骨T2值的相关性研究
徐基磐,胡铁成,徐文丽,王 倩,高德双,谭 威,马贺骥
辽宁医学院附属第一医院 放射科,辽宁锦州 121001
随着人口的老龄化,骨性关节炎(osteoarthritis,OA)发病率逐年上升,已成为下肢关节失用的主要病因。OA的早期表现主要为关节软骨的损伤,晚期可表现为关节形态学的改变。Lange等[1]认为半月板的损伤与关节软骨的退变有关。目前,MRI为评价关节软骨及半月板的首选检查手段,T2-mapping成像是一种新的MRI生理性成像技术,通过测量T2弛豫时间定量分析关节软骨内组织成分的变化。本文旨在探讨T2-mapping成像技术在膝关节软骨损伤中的应用及OA患者关节软骨损伤与半月板退变之间的关系。
资料和方法
1 资料 收集辽宁医学院附属第一医院2011年3月-2012年7月间90例行常规MRI序列及T2-mapping序列检查的OA患者(左膝49例右膝41例);其中男35例,女55例,年龄45~70(62.1±5.7)岁。所有病例既往无膝关节手术、外伤,无骨代谢疾病,无骨感染、骨梗死、肿瘤病史。参照中华医学会骨科学分会2007年修订的《骨关节炎诊治指南》中关于膝关节OA的诊断标准:1)近1个月内反复膝关节疼痛;2)站立或负重位X线片示关节间隙变窄、软骨下骨硬化和(或)囊性变、关节缘骨赘形成;3)关节液(至少2次)清亮、黏稠,WBC<2 000个/ml;4)中老年患者(≥40岁);5)晨僵≤3 min;6)活动时有骨摩擦音(感)。符合1)+2)条或1)+3)+5)+6)条或1)+4)+5)+6)条,可诊断为OA。运动或负重能导致关节软骨T2值的改变,因此要保证入选患者在行MRI检查前无剧烈运动。由于半月板前角的解剖学变异较大,因此为了减小假阳性率本研究只选择半月板后角进行研究[2]。
2 仪器与方法 采用GE 1.5T MRI扫描仪(signa HDxt)及8通道膝关节专用线圈(HD TRknee)完成检查。常规MRI序列包括:矢状位T1WI,TR/TE=540/12.1 ms,层厚4.0 mm,层距0.5 mm,FOV 18 cm×18 cm,矩阵320×224,NEX 2;矢状位脂肪抑制质子密度像(fast suppressed protondensity,FS-PD),TR/TE=2 640/30 ms,层厚4.0 mm,层距0.5 mm,FOV 18 cm×18 cm,矩阵320×224,NEX 4;冠状位T2WI脂肪抑制像,TR/TE=2 800/70.6 ms,层厚4.0 mm,层距1.0 mm,FOV 18 cm×18 cm,矩阵320×224,NEX 2。矢状位T2-mapping采用8回波SE序列扫描,TR 1 000 ms,TE分别为8.8、17.5、26.3、35.1、43.8、52.6、61.4、70.1 ms, 层厚4.0 mm,层间距0.5 mm,FOV 18 cm×18 cm,矩阵320×224,NEX 2。
3 T2值测定 利用GE AW4.5工作站,应用functool软件对图像进行处理。在邻近半月板后角中心处的关节软骨选取4个大小为1 mm2的感兴趣区(ROI)(见图1A、B),并取平均值作为该处软骨T2值。所测关节软骨区域包括股骨内侧髁、股骨外侧髁、胫骨内侧髁、胫骨外侧髁。
4 图像分析 半月板的损伤分级标准参照Stoller等[3]制订的关于半月板损伤标准。0级:表现为半月板在所有序列信号均匀,形态规整,为正常半月板,并设为对照组;Ⅰ级:表现为半月板内局限性圆形或不规则状高信号,范围未达到半月板关节面;Ⅱ级:表现为半月板内线状、水平状高信号并延伸至半月板的关节囊缘,但未延及半月板的关节面缘;Ⅲ级:表现为半月板内的高信号到达关节边缘。采用双盲法由两名具有10年以上工作经验的放射医师独立对病例MRI常规序列图像进行诊断分级。依据半月板的分级标准分为4组:0级组、Ⅰ级组、Ⅱ级组、Ⅲ级组,半月板信号0级组设为对照组,其他3组为病例组。
5 统计学分析 所有数据采用SPSS17.0软件进行统计学分析,计量数据以-x±s表示。两独立样本的t检验用于各病例组组内半月板后角所对应软骨T2值之间差异的比较。单因素方差分析用于病例组与对照组之间软骨T2值差异的比较。P<0.05为差异有统计学意义。
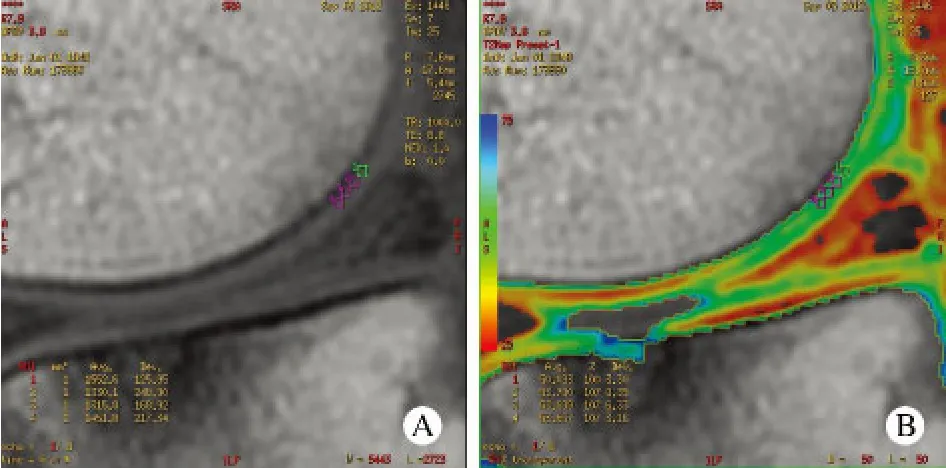
图 1 (A)于股骨内侧髁邻近半月板后角中心处关节软骨选取4个大小为1 mm2的感兴趣区(ROIs)(B)利用T2-mapping伪彩图测量所取ROIs的T2值Fig. 1 Four 1 mm2 ROIs in medial femoral condyle cartilages adjacent to the center of the medial meniscus posterior horn(A) and T2 values measured by T2-mapping (B)
结 果
按Stoller分级,本研究共纳入168个半月板,其中内侧半月板93个,外侧半月板75个。内侧半月板0级20个(20/93,21.51%),Ⅰ级21个(21/93,22.58%),Ⅱ级23个(23/93,24.73%),Ⅲ级29个(29/93,31.18);外侧半月板后角信号0级31个(31/75,41.33%),Ⅰ级15个(15/75,20.00%),Ⅱ级11个(11/75,14.67%),Ⅲ级18个(18/75,24.00%)。损伤Ⅰ、Ⅱ级组之间无统计学差异(P=0.33),与对照组关节软骨T2值相比无增高(P=0.53、0.99)。损伤Ⅲ级组关节软骨T2值高于Ⅰ、Ⅱ级组(P<0.05)。损伤Ⅲ级组软骨T2值明显高于对照组(P<0.01)。Ⅲ级组61.7%的Ⅲ级信号见于内侧半月板后角(29/47)。Ⅲ级组胫骨及股骨内侧髁软骨T2值高于胫骨及股骨外侧髁软骨(P<0.05)(见表1)。

表1 不同组半月板对应软骨T2值Tab. 1 T2 values of knee joint cartilages in different groups(-x±s, ms)
讨 论
关节软骨的T2弛豫时间反映了软骨的结构和生物化学特征。OA发生时可引起关节软骨中胶原丢失从而导致胶原网状结构的破坏及胶原纤维排列的改变,这些改变可导致水通透性的增加,从而使软骨T2值升高,胶原纤维具有短T2效应,T2-mapping可以通过测量组织T2弛豫时间来定量分析关节软骨内组织结构的变化[4]。
半月板损伤与关节软骨的缺失有关,并且半月板损伤是OA患者软骨损伤的危险因素[5-6]。本研究利用T2-mapping成像定量分析半月板损伤与关节软骨T2值变化之间的关系。研究发现Ⅰ、Ⅱ级组关节软骨T2值之间差异无统计学意义(P=0.33),并且与对照组相比Ⅰ、Ⅱ级组关节软骨T2值无增高(P=0.53,P=0.99)。半月板的Ⅰ、Ⅱ级损伤是一个连续的病理过程,在病理上表现为半月板的黏液样变性,其生化基础为半月板软骨基质内的黏多糖产物的增加。Stoller等[3]通过4年的随访研究发现Ⅰ、Ⅱ级半月板损伤的信号改变并没有进一步的发展,即Ⅰ、Ⅱ级过程并不是Ⅲ级改变的中间过程。大体标本中Ⅰ、Ⅱ级信号改变中没有明显的裂隙或撕裂,因此可以推测Ⅰ、Ⅱ级损伤时半月板对软骨的保护功能尚未丧失。
本研究发现,损伤Ⅲ级组软骨T2值明显高于对照组(P<0.01),这与国外的研究结果类似[7]。Henry等[8]的研究发现半月板的撕裂与软骨损伤的发生率有很强的相关性。半月板衬垫于胫骨与股骨之间,在负重时有约70%在半月板上,这就大大降低了胫骨平台上的应力,从而起到保护软骨的作用。所有Ⅲ级信号的半月板均可以看到半月板的分离或撕裂,因此可以推测半月板发生Ⅲ级损伤时,其对软骨保护的功能明显降低。此外Englund等[9]的研究也证实了半月板的撕裂和脱出与OA的进展有关,因此半月板发生Ⅲ级信号改变的OA患者,需要相关治疗以防止关节软骨的进一步破坏。
本研究发现,病例组股骨及胫骨内侧髁软骨的T2值均高于外侧软骨。Pelletier等[10]的研究发现OA患者股骨及胫骨内外侧髁软骨的丢失是有差别的,此外Biswal等[11]通过研究也发现在OA患者中,内侧软骨丢失的速度快于外侧软骨。有关生物力学的相关研究已经证明,膝关节在承重时,力的分布是不对称的,股骨及胫骨内侧髁承重更多。因此这些区域的关节软骨损伤更快。此外,本研究发现66.7%的Ⅲ级信号见于内侧半月板后角,这可能与膝关节活动,胫骨、股骨间扭转时使内侧半月板后角下方所受的张力和应力增加有关。
本研究的局限性在于未将体重、药物治疗等可能影响软骨T2值的因素考虑在内。尽管MRI诊断内外侧半月板撕裂的准确率分别为86%、89%,本研究未采用“金标准”关节镜对半月板及软骨的损伤进行评价,因而实验结果可能产生偏倚[12]。
总之,本研究通过应用T2-mapping技术发现在OA患者中Ⅰ、Ⅱ级半月板损伤时对应处关节软骨T2值没有升高,半月板Ⅲ级损伤时对应处软骨T2值明显升高,从而揭示半月板撕裂处的关节软骨在发生形态学改变之前微结构及组织成分的变化,为临床早期诊断、早期治疗提供可靠依据。
1 Lange AK, Fiatarone Singh MA, Smith RM, et al. Degenerative meniscus tears and mobility impairment in women with knee osteoarthritis[J]. Osteoarthritis Cartilage, 2007, 15(6): 701-708.
2 Tyler P, Datir A, Saifuddin A. Magnetic resonance imaging of anatomical variations in the knee. Part 2: miscellaneous[J].Skeletal Radiol, 2010, 39(12):1175-1186.
3 Stoller DW, Martin C, Crues JV 3rd, et al. Meniscal tears:pathologic correlation with Mr imaging[J]. Radiology, 1987, 163(3): 731-735.
4 Disler DG. Articular cartilage in the knee: current Mr imaging techniques and applications in clinical practice and research. Invited commentary[J]. Radiographics, 2011, 31(1): 61-62.
5 Fox AJ, Bedi A, Rodeo SA. The basic science of human knee menisci: structure, composition, and function[J]. Sports Health,2012, 4(4):340-351.
6 Ding C, Martel-Pelletier J, Pelletier JP, et al. Meniscal tear as an osteoarthritis risk factor in a largely non-osteoarthritic cohort: a cross-sectional study[J]. J Rheumatol, 2007, 34(4):776-784.
7 Joseph GB, Baum T, Alizai H, et al. Baseline mean and heterogeneity of MR cartilage T2 are associated with morphologic degeneration of cartilage, meniscus, and bone marrow over 3 years--data from the Osteoarthritis Initiative[J]. Osteoarthritis Cartilage, 2012, 20(7):727-735.
8 Henry S, Mascarenhas R, Kowalchuk D, et al. Medial meniscus tear morphology and chondral degeneration of the knee: is there a relationship?[J]. Arthroscopy, 2012, 28(8):1124-1134.
9 Englund M, Guermazi A, Lohmander SL. The role of the meniscus in knee osteoarthritis: a cause or consequence?[J]. Radiol Clin North Am, 2009, 47(4):703-712.
10 Pelletier JP, Raynauld JP, Berthiaume MJ, et al. Risk factors associated with the loss of cartilage volume on weight-bearing areas in knee osteoarthritis patients assessed by quantitative magnetic resonance imaging: a longitudinal study[J]. Arthritis Res Ther,2007, 9(4):R74.
11 Biswal S, Hastie T, Andriacchi TP, et al. Risk factors for progressive cartilage loss in the knee: a longitudinal magnetic resonance imaging study in forty-three patients[J]. Arthritis Rheum, 2002, 46(11):2884-2892.
12 Crawford R, Walley G, Bridgman S, et al. Magnetic resonance imaging versus arthroscopy in the diagnosis of knee pathology,concentrating on meniscal lesions and ACL tears: a systematic review[J]. Br Med Bull, 2007, 84(1): 5-23.

