EPA甲酯和DHA甲酯标准样品的制备和结构解析
晋文慧,方华,谢全灵,陈伟珠,洪专,易瑞灶
(国家海洋局第三海洋研究所,国家海洋局海洋生物资源综合利用工程技术研究中心,福建厦门 361005)
海洋脂类活性物质是一类具有独特生理功能的化合物,富含ω-3系高度不饱和脂肪酸(PUFA),主要包括二十碳五烯酸 (cis-5,8,11,14,17-eicosapentaenoic acid,EPA)和二十二碳六烯酸(cis-4,7,10,13,16,19-Docosahexaenoic Acid,DHA)等[1-3]。EPA和DHA都是人体所必需的脂肪酸,但在人体内难以合成,主要来自于海洋鱼类,是理想的功效食品或营养品,具有调节血脂、软化血管、降低血液粘度、改善视力、促进生长发育和提高人体免疫功能等作用[4],其中EPA被誉为“血管清洁剂”,具有降血脂、抗血小板聚集、延缓血栓形成的作用;DHA被称为“脑黄金”,具有健脑作用。EPA,DHA与人体许多生命现象有关,对维护人体健康有重要作用,在医药和食品等许多领域有着广泛的应用,并已广泛应用于各种保健食品中[5-6]。目前,有关海洋不饱和脂肪酸酯的制备、检测、表征及药理作用已有很多文献报道[7-11]。笔者采用甘油酯型鱼油为起始原料,通过皂化和酰化反应制备多不饱和脂肪酸甲酯,经过层析、精制得到高纯度的EPA甲酯和DHA甲酯标准样品,并利用红外光谱、质谱、1H和13C 核磁共振波谱等手段对海洋不饱和脂肪酸甲酯的结构进行了表征。
近年来国内外对脂肪酸的研究日益广泛深入,脂肪酸甲酯标准品是定性定量检测其相应的不饱和脂肪酸的重要标准物质,而高不饱和脂肪酸的检测研究、提取分离研究和医药研究均需要相应的高纯度不饱和脂肪酸甲酯标准物质作为其研究的前提保证。本工作为标准样品的研制提供了必要的基础。
1 实验部分
1.1 主要仪器与试剂
液质联用仪:3100型,美国Waters公司;
气相色谱仪:GC2010-Plus型,配FID检测器,日本岛津公司;
红外光谱仪:VERTEX 70型,德国Bruker公司;
核磁共振波谱仪:400 MHz型,德国Bruker公司;
超纯水纯化系统:Milli-Q型,美国Millipore公司;
甘油酯型鱼油粗品:国药控股星鲨制药(厦门)有限公司;
氢氧化钾、叔丁基-4-羟基茴香醚、草酰氯、二甲基甲酰胺、三乙胺、二氯甲烷:分析纯,国药集团化学试剂有限公司;
硝酸银-硅胶层析柱:自制;
正已烷:色谱纯。
1.2 EPA甲酯和DHA甲酯的制备
采用甘油酯型鱼油为起始原料,通过皂化和酰化反应制备多不饱和脂肪酸甲酯。游离多不饱和脂肪酸甲酯粗产物根据文献的方法制备[12]。步骤如下:
(1)皂化反应。将适量氢氧化钾、乙醇、水和叔丁基-4-羟基茴香醚加入到反应瓶中,充分溶解,待混均后,再加入粗鱼油,均匀搅拌。在充氮气条件下,于75℃恒温持续搅拌1 h。待溶液冷却后,用硫酸溶液中和皂化液,调节使其pH值为2~3,然后将皂化液移入分液漏斗中,上层即为游离脂肪酸液。
(2)甲酯化反应。在冰水浴条件下,将不饱和脂肪酸、甲醇按物质的量比1∶1.2于反应瓶中混合,慢慢加入适量草酰氯充分混合,0.5 h后再滴加适量二甲基甲酰胺。反应1.5 h后将上述溶液滴加到适量甲醇、三乙胺和二氯甲烷的混合液中,冰水浴下反应1 h。用二氯甲烷萃取2次,合并有机相,用无水硫酸镁干燥,过滤,旋蒸,纯化,得到不饱和脂肪酸甲酯粗品。
1.3 EPA甲酯和DHA甲酯的分离纯化
1.3.1 层析柱分离提纯
称取2 g不饱和脂肪酸甲酯粗品,加入硝酸银-硅胶层析柱中,以丙酮-石油醚混合溶液进行洗脱,起始洗脱剂为石油醚,在洗脱过程中逐渐增加丙酮的比例直至20%,控制洗脱流速为1 mL/min,每50 mL收集洗脱液进行气相色谱测定,合并含量相同的洗脱液,于40℃水浴中旋转浓缩至溶剂挥干,可分别获得较高纯度的EPA甲酯和DHA甲酯(纯度高于70%),于-18℃以下保存备用。
1.3.2 液相色谱技术精制
分别以经过层析柱分离提纯的EPA甲酯和DHA甲酯作为原料,使用C18色谱柱(250 mm×20 mm)进行分离精制,收集纯度高于99%的馏分片段,于40℃水浴中旋转浓缩至溶剂挥干,再经高真空石油醚三级油扩散泵蒸干,即可得到纯度较高的DHA甲酯和EPA甲酯。
1.4 色谱条件
色谱柱:聚乙二醇类FFAP色谱柱(30 m×0.25 mm,0.25 μm);柱流量:1.0 mL/min;进样体积:1 μL;选择分流进样,分流比为1∶10;进样口温度:260℃;柱温:以100℃为初始温度,保持5 min,以5℃/min的速率升高至220℃,保持20 min;检测器温度:270℃。
1.5 分析检测
取精制的EPA甲酯和DHA甲酯单体各10 mg,置于10 mL的容量瓶中,加入正己烷稀释至标线,按1.4色谱条件进行气相色谱分析,按照面积归一法计算纯度,经气相色谱检测其纯度均高于99%。EPA甲酯和DHA甲酯单体的GC色谱图见图1、图2。
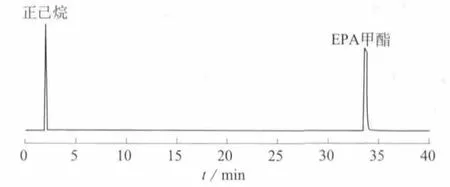
图1 EPA甲酯单体的GC分析谱图
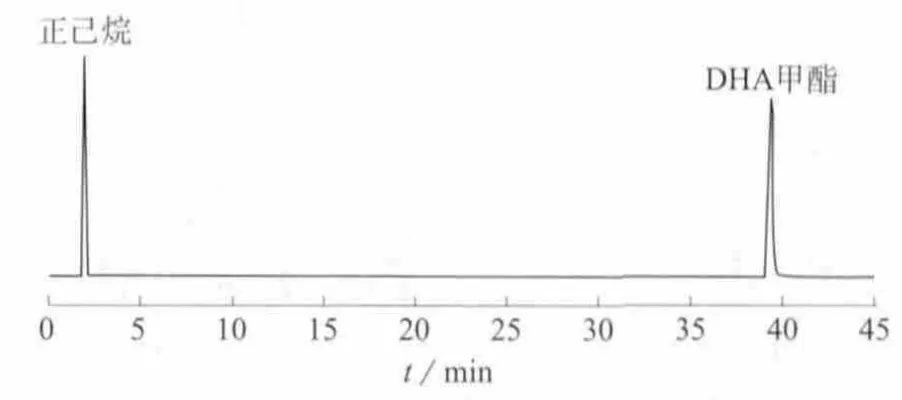
图2 DHA甲酯单体的GC分析谱图
1.6 实验条件
1.6.1 红外吸收光谱
KBr压片液膜法;波数范围:7 500~370 cm-1;分辨率:0.4 cm-1;采样速率:80张/秒。
1.6.2 质谱
API电离源,源温度为120℃;毛细管电压:3.5 kV;脱溶剂温度:350℃;脱溶剂氮气流速:500 L/h;锥孔氮气流速:50 L/h。
1.6.3 核磁共振波谱
1H谱工作频率:400 MHz;采样时间:2 s;脉冲宽度:2.1 μs;延迟时间:10 s。
13C谱工作频率:100 MHz;采样时间:0.5 s;脉冲宽度:8.7 μs;延迟时间:1 s。
实验温度:20℃;溶剂:CDCl3;内标:δTMS0。
2 结果与讨论
2.1 EPA甲酯的结构表征
二十碳五烯酸甲酯的结构式如图3所示。
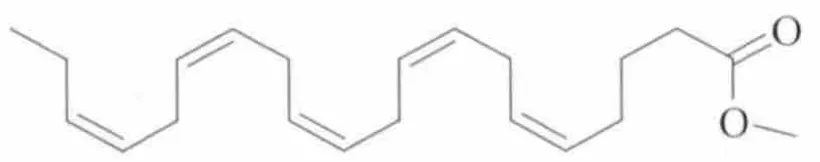
图3 EPA甲酯的结构式
2.1.1 红外吸收光谱(IR)
图4为EPA甲酯的红外光谱图。由图4可知,3 012 cm-1为烯烃的C=C双键伸缩振动,2 961 cm-1为烷烃的C—H伸缩振动,1 741 cm-1为甲酯的C=O伸缩振动,1 155 cm-1为甲酯的C—O伸缩振动,709 cm-1为顺式烯烃上C—H的变形振动,是一个特征峰。样品的红外光谱数据说明结构中存在碳碳双键C=C、酯键及顺式碳碳双键等基团。
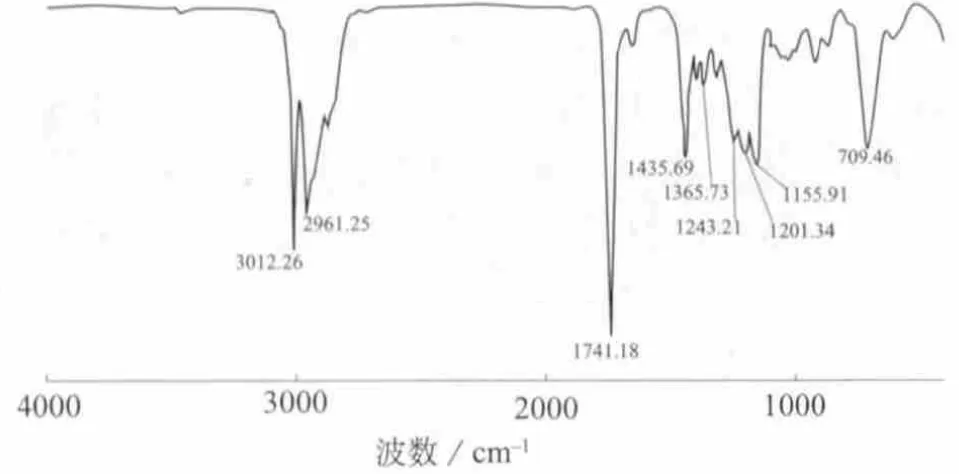
图4 EPA甲酯的红外光谱图
2.1.2 质谱
该化合物化学式为C21H32O2,其相对分子质量理论值为316,测得准分子离子峰m/z=317 [M+H]+与其理论值相符。
2.1.3 核磁共振谱

图5 EPA甲酯的13C NMR核磁共振谱图

图6 EPA甲酯的1H NMR核磁共振谱图

图7 EPA甲酯的的HMBC谱图
化合物EPA甲酯的化学式为C21H32O2,不饱和度Ω=6。图5~图7分别为EPA甲酯的碳谱图、氢谱图、HMBC谱图。根据13C NMR谱图,6个不饱和度分别由10个烯碳CH(5个不饱和度)和1个羰基碳C(1个不饱和度)组成。由图5和图6可知,化合物EPA甲酯含有1个CH3,1个OCH3,8个CH2,5个—CH=CH—和一个羰基C=O。根据1H NMR和HMBC谱图数据,可以确认单重峰δ3.68(s,3H,OCH3)是一个连着羰基的甲氧基—OCH3(HMBC:H22和C1有耦合),而三重峰δ0.99(t,3H,J=7 Hz,CH3)和多重峰δ2.09~2.15 (m,2H,CH2)相连组成—CH2—CH3片段接在烯碳端(HMBC :H20和 C19,C18有耦合,H19和 C18,C20有耦合)。多重峰δ1.69~1.76 (m,2H,CH2)同时与羰基碳174.0、双键碳127.0及亚甲基碳26.55和33.43都有耦合,可以确定δ2.33 (t,J=7 Hz,2H,CH2)、δ2.09~2.15 (m,2H,CH2)和δ1.69~1.76 (m,2H,CH2)是一组—CH=CH—CH2—CH2—CH2—C=O的分子片段 (HMBC :H2和 C1,C3;H3和 C1,C2,C4,C5有耦合;H4和 C3,C5有耦合 )。另一方面,位于δ5.32~5.43 (m,10H,5 —CH=CH—)的多重峰指认为5个—CH=CH—的分子结构片段,经详细辨认其耦合裂分常数J=7.2 Hz,也证实了此双键是顺式结构。
分子中除去C=O, —O—CH2—CH3,—CH2—CH3, —CH=CH—CH2—CH2—CH2—C=O和5个—CH=CH—,还有4个亚甲基,1H NMR显示一组多重峰 2.81~2.87 (m,8H,4CH2),由化学位移和HMBC可以指认这4个CH2分别位于5个烯键中间。
综上所述,样品的核磁共振谱图(1H NMR,13C NMR,13C-1H HMBC)所给出的结构信息与化合物EPA甲酯的化学结构式相符。
2.2 DHA甲酯的结构表征
DHA甲酯的结构式如下:
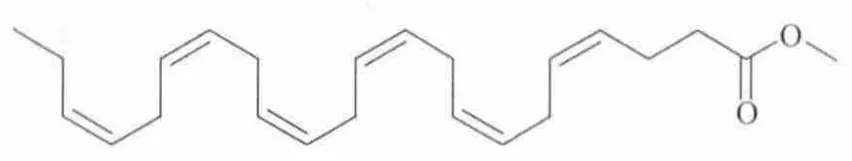
图8 DHA甲酯的结构式
2.2.1 红外吸收光谱(IR)
如图9所示,3 013为烯烃的C=C双键伸缩振动,2 963 cm-1为烷烃的C—H伸缩振动,1 742 cm-1为甲酯的C=O伸缩振动,1 161 cm-1为甲酯的C—O伸缩振动,709 cm-1为顺式烯烃上C—H的变形振动,是一个特征峰。样品的红外光谱数据说明结构中存在碳碳双键C=C、酯键及顺式碳碳双键等基团。
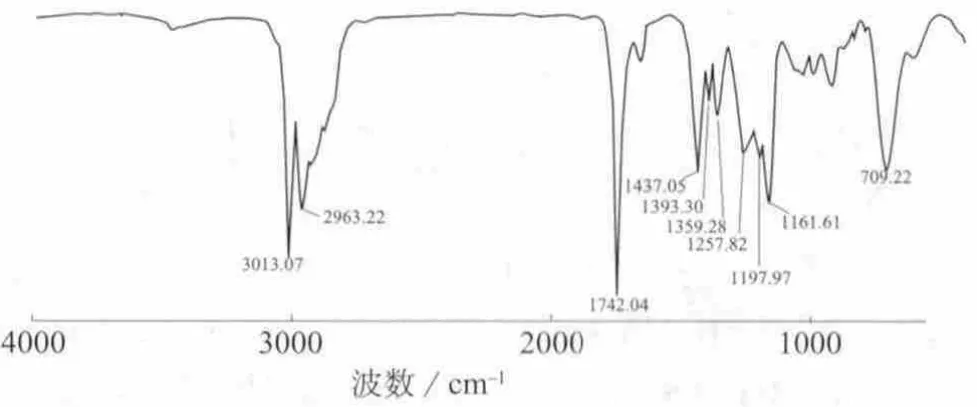
图9 DHA甲酯的红外光谱图
2.2.2 质谱
该化合物化学式为C23H34O2,其相对分子质量理论值为342,测得准分子离子峰m/z=343 [M+H]+,与其理论值相符。
2.2.3 核磁共振谱
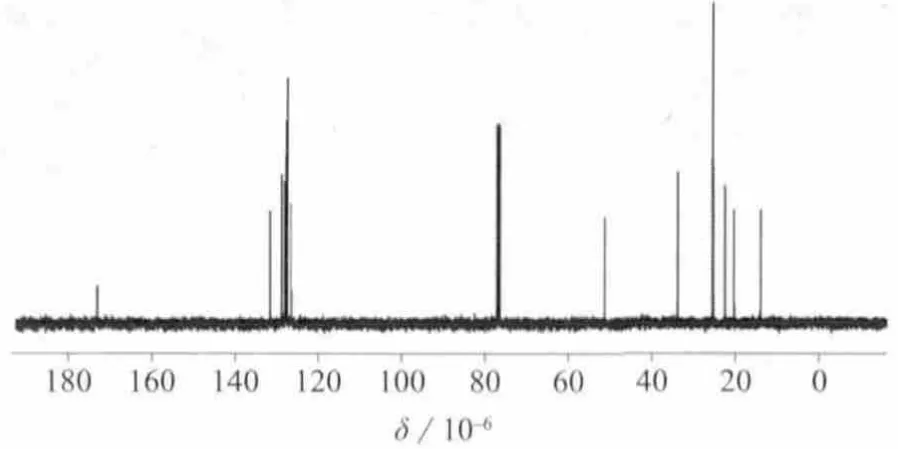
图10 DHA甲酯的13C NMR核磁共振谱图
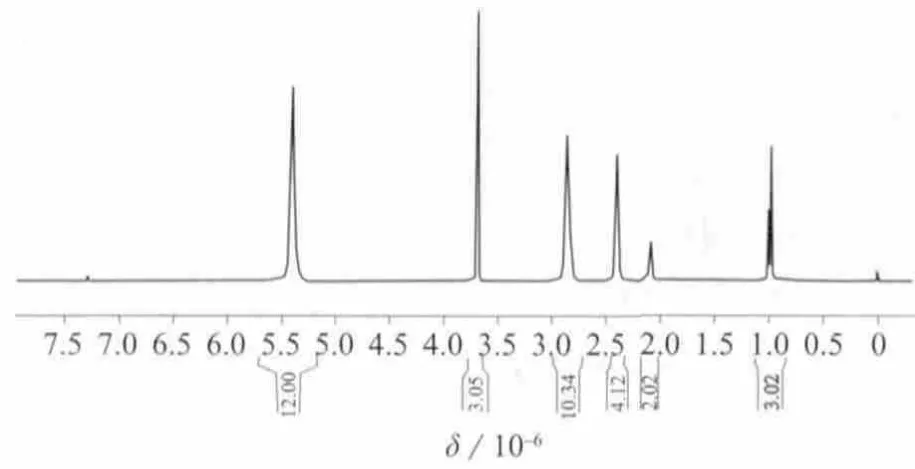
图11 DHA甲酯的1H NMR核磁共振谱图
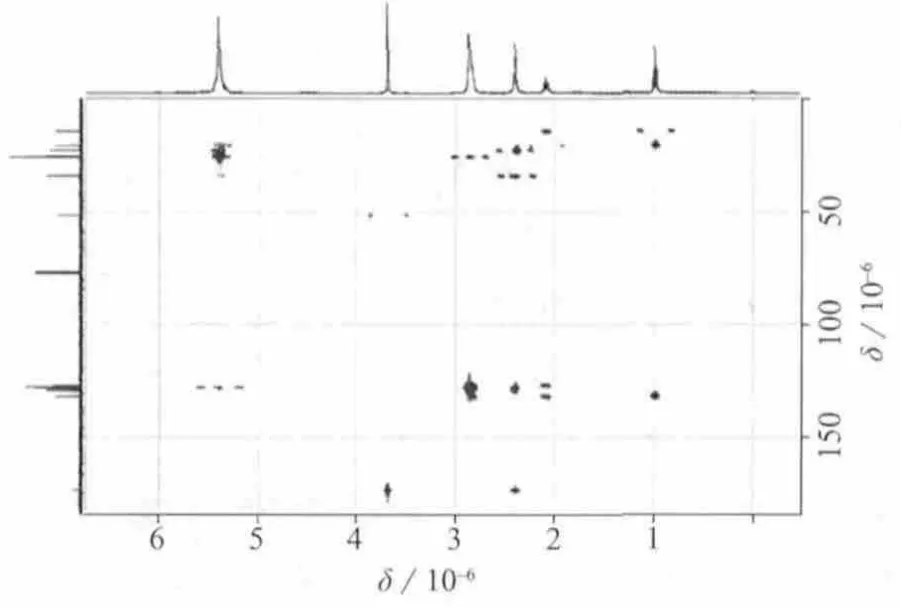
图12 DHA甲酯的的HMBC谱图
化合物DHA甲酯的分子式为C23H34O2,不饱和度Ω=7。图10~图12分别为DHA甲酯的13C NMR,1H NMR,HMBC谱图。根据13C NMR谱,7个不饱和度分别是由12个烯碳CH(6个不饱和度)和1个羰基碳C(1个不饱和度)组成。根据图10和图11,化合物DHA甲酯含有1个CH3,1个OCH3,8个 CH2,6个 —CH=CH—和一个羰基C=O。根据1H NMR,HMBC谱图,可以确认单重峰δ 3.68 (s,3H,OCH3)是一个连着羰基的甲氧基—OCH3(HMBC:H24和 C1有耦合 ),而三重峰 δ 0.99 (t,3H,J=7 Hz,CH3)和多重 峰 δ 2.05~2.12(m,2H,CH2)相连组成—CH2—CH3片段接在烯碳端 (HMBC :H22和 C21、C20有耦合,H21和 C20、C22有耦合 )。同时,位于 δ 5.29~5.46 (m,12H,6—CH=CH—)的多重峰指认为6个—CH=CH—的分子结构片段,经详细辨认其耦合裂分常数J=7.2 Hz,也证实了此双键是顺式结构。
分子中除去O=C,—OCH3,—CH2—CH3和6个—CH=CH—的分子结构片段,还有7个亚甲基,1H NMR显示2组多重峰δ 2.81~2.87 (m,10H,5CH2)、2.37~2.44 (m,4H,2CH2),由化学位移和HMBC可以确认有5个CH2分别位于5个烯键中间,而 δ 2.37~2.44 指认为—CH2—CH2—分子片段,且此分子片段与羰基C1有耦合作用,所以它们组成—CH2—CH2—C=O片段。
综上所述,样品的核磁共振谱图(1H NMR,13C NMR,13C-1H HMBC)所给出的结构信息与化合物DHA甲酯的化学结构式相符。
3 结语
制备了两种高纯不饱和脂肪酸甲酯,为标准样品的研制工作打下了坚实的基础,也为高不饱和多烯脂肪酸进一步的检测研究和医药研究提供了基础保障。
[1]黄明发,吴桂苹,焦必宁.二十二碳六烯酸和二十碳五烯酸的生理功能[J].食品与药品,2009,9(2): 69-71.
[2]陶宁萍,鲍丹.鱼油的营养和药用价值及其提取工艺的研究进展[J].上海水产大学学报,2005,14(2): 197-200.
[3]马永钧,杨博.海洋鱼油深加工技术研究进展[J].中国油脂,2011,36(4): 1-5.
[4]胡燕,陈忠杰.不饱和脂肪酸与人体健康关系探讨[J].肉类研究,2011(1): 17-20.
[5]赵亚平,吴守一,陈钧,等.鱼油中二十碳五烯酸和二十二碳六稀酸提取分离研究现状和进展[J].江苏理工大学学报,1996,17(4): 1-6.
[6]唐君,张春枝,吴文忠.一种鱼油中EPA和DHA富集的新方法[J].大连工业大学学报,2008,27(2): 102-104.
[7]彭宏伟,张博,杨小川,等. HPLC法测定鱼鱼油中二十碳五烯酸、二十二碳六烯酸的含量[J].中国药房,2010,21(13):1 228-1 230.
[8]冀克俭,刘元俊,张银生,等.鱼油多烯脂肪酸乙酯的NMR表征[J].化学分析计量,2001,10(3): 3-5.
[9]Alkio M,Gonzalez C,Jäntti M,et al. Purification of polyunsaturated fatty acid esters from tuna oil with supercritical fl uid chromatography[ J]. Journal of the American Oil Chemistry Society,2000,77(3): 315-321.
[10]Liu D Y,Jiang J,Wang P, et al. Simultaneous quantitative determination of olmesartan and hydrochlorothiazide in human plasma and urine by liquid chromatography coupled to tandem mass spectrometry[J]. Journal of Chromatography B,2010,879: 743-748.
[11]Spoof L,Neffl ing M R,Meriluoto J. Separation of microcystins and nodularins by ultra performance liquid chromatography[J].Journal of Chromatography B,2009,877: 3 822-3 830.
[12]余元祥,牟峻,荣会,等.五种高不饱和多烯脂肪酸甲酯实物标准样品研制[J].检验检疫科学,1999,9(3): 33-37.

