柠檬酸和温度联合处理对海水鱼中副溶血性弧菌的杀灭作用
丁珊珊,杨振泉,李宝利,潘志明,焦新安
2.扬州大学食品科学与工程学院,扬州 225009
副溶血性弧菌(Vibrioparahaemolyticus,以下简称Vp)属于弧菌科弧菌属,是一种革兰氏阴性嗜盐细菌,主要分布在近海岸的海水、海河交界处和鱼类、虾类、贝类等海产品中。江苏地区2008年和2009年食源性致病菌监测研究数据显示Vp检出率分别为15.9%和7.8%,居于首位,生食水产品导致食源性疾病的风险较高[1]。因此,控制在海产品中Vp的带菌量,建立科学的减菌和杀菌方法至关重要。
目前对于Vp的控制手段主要有流水净化、温度处理、高压处理、辐射等,但是这些方法都不能经济安全有效地抑制水产品中Vp[2]。有研究发现有机酸食品添加剂能有效抑制Vp,但是在抑制过程中食品的风味发生了改变[3]。2000年,Andrews等人提出低温巴氏杀菌(48℃~50℃,5 min)可使贝类中Vp(1.2×105MPN/g)降低到不能检测水平(<3MPN/g),但是这种处理可能会导致贝内容物发生变化[4]。很少有研究报道有机酸和温度联合处理对于Vp的作用,为此,我们建立一种既能降低Vp带菌量,又能最大限度地保证海产品鲜度的新型控制手段。
1 材料与方法
1.1 菌株与试剂Vp大流行株RIMD2210663由军事医学科学院馈赠;Vp标准菌株ATCC33847和ATCC17802由上海疾病预防与控制中心馈赠;环境分离株Vp098、Vp343和Vp012由扬州大学江苏省人兽共患病学重点实验室分离鉴定并保存。
琼脂培养基TCBS购自杭州微生物试剂有限公司。LBS液体培养基、高离子强度盐溶液(0.1 mol/L KCl+0.01mol/L NaCO3+ 0.04 mol/L Na HCO3)、50 mmol/L CaCl2、4 M KCl均由本实验室自制,其它试剂均为分析纯。1.2 方法
1.2.1 菌悬液制备 挑取 RIMD2210663、ATCC33847、ATCC17802、Vp098、Vp343、Vp012的TCBS典型单菌落至LBS培养液,37℃,180 r/min,过夜振荡培养。分别吸取10 μL过夜培养物至新鲜LBS培养液,37℃,180 r/min,振荡培养4~5 h,测六种菌株的OD600值,并调OD600至0.8左右。均匀混合 RIMD2210663、ATCC33847、ATCC17802、Vp098、Vp343、Vp012这6种菌株,制成混合菌悬液备用。1.2.2Vp死亡率测定 用无菌微量移液器分别吸取处理前后菌液100μL,沿管壁缓缓注入含有900μL PBS的无菌1.5 m L离心管中(注意吸管或吸头尖端不要触及稀释液面),振摇使其混合均匀,制成1∶100的样品匀液。根据对样品污染状况的估计,按上述操作,依次制成十倍递增系列稀释样品匀液。选取2~3个适宜的连续稀释度,每个稀释度接种3个无菌TCBS平皿,每皿100μL。选取菌落数在20 CFU-300 CFU之间的平板,分别计数平板上出现的典型和可疑Vp菌落,典型菌落为墨绿色。
计算公式:

1.2.3单因素试验 以死亡率为指标,分别对p H、温度、时间作单因素试验。吸取100μL混合菌液于1.5 m L中,12 000 r/min离心8 min,重悬,在45℃、50℃、55℃、60℃、65℃水浴中处理,分别于5 s、25 s、45 s、65 s、85 s取样分析细菌的死亡率。同样分别吸取100μL混合菌液,离心沉淀,用PBS重悬,稀释,涂板,37℃,培养24 h,计数得到处理前菌落数,其余分别用p H2.5、p H3.5、p H4、p H4.5、p H5的柠檬酸溶液重悬,在55℃水浴中处理15 s,稀释,涂布,37℃,培养24 h,计数,计算死亡率。
1.2.4 响应面法优化温度、p H和时间 在单因素试验的基础上,根据Box-Benhnken的中心组合实验设计,以温度、p H、时间3个因素为自变量,菌株死亡率为响应值,采用响应面分析法在三因素三水平上对处理条件进行优化,以获得最大死亡率。试验因素与水平设计如表1所示。根据表1,Box-Benhnken软件自动生成17种组合条件,如表2所示。例如第一种组合是吸取两组混合菌悬液各100μL,一组直接离心、PBS重悬、稀释涂板,37℃培养24 h,计数,获得处理前菌落数,另一组混合于1 mL p H5.5柠檬酸溶液中,60℃水浴处理15 s,然后离心、PBS重悬,稀释涂布,37℃培养24 h,计数,获得处理后菌落数,以计算死亡率。其它16种组合根据具体条件做法同上。
1.2.5 最优条件的验证 根据17种组合的试验数据,软件自动分析得出最佳组合条件,对该条件进行验证并考查该条件对鱼蛋白活性的影响。
1.2.5.1 样品处理 将市售新鲜三文鱼肉冷冻状态下切割成大小均一的块状,用灭菌生理盐水浸泡洗涤9~10次,并检测Vp的携带情况。

表1 响应面分析因素与水平Tab.1 Factors and their coding levels in response surface analysis
1.2.5.2 人工污染 取6块鱼肉样品解冻后置于混合菌液中浸泡10~15 min,用镊子取出分装至玻璃瓶中(每瓶1片),其中3瓶做对照组,加PBS,搅匀,稀释涂布于TCBS平板,37℃培养24 h后计数。其余3瓶做处理组,加p H4.96柠檬酸溶液,在55.5℃条件下处理25 s后,搅匀,稀释涂布于TCBS平板,37℃培养24 h后计数。
1.2.6 鱼蛋白活性的测定
1.2.6.1 肌原纤维蛋白的制备 为了进一步观察处理条件对鱼蛋白活性的影响,参考李来好等[5]的报道取三文鱼肉2 g各两份,一份做对照组,一份用p H4.96,55.5℃,25 s处理,两组分别放在研钵中并置于冰箱急冻室冷冻5~10 min,取出研碎,在冻水浴中边研磨边加入20 m L预冷的高离子强度盐溶液,研磨15 min。然后加10倍冰水稀释,搅匀放在4 000 r/min的离心机中离心10 min,弃去上清液,取出沉淀物。再同法洗涤离心3次,最后得到的肌原纤维沉淀物加Tris-HCl缓冲液(p H7.0)匀浆搅匀,然后定容至100 m L,所得的肌原纤维悬浊液供Ca2+-ATPase活性测定。
1.2.6.2 Ca2+-ATPase 活性的测定 在试管中加入 20 mmol/L Tris-HCl 2.5 mL、50 mmol/L CaCl21.0 mL、4 M KCl 1.0 m L、6.67 mmol/L d ATP 1.5 m L和4.0 m L肌原纤维蛋白酶液,最后加入1.0 m L15%的三氯醋酸终止反应。用钼酸铵法在314 nm波长测定磷含量。
2 结 果
2.1 单因素试验结果 在45℃、50℃、55℃、60℃、65℃温度条件下分析了温度对Vp死亡率的影响(图1a),死亡率随温度的升高而增大,45℃至50℃死亡率上升最迅速,上升了近13%,55℃至60℃上升较迅速,上升了近5%,当温度大于60℃时,死亡率已接近100%,变化不显著。结合实际生产应用情况,适宜的温度范围确定为50℃~60℃。
在p H2.5、p H3.5、p H4、p H4.5、p H5.5条件下分析了p H对Vp死亡率的影响(图1b),Vp死亡率随p H的增大而降低。Vp在p H2.5的柠檬酸溶液中死亡率近100%,当p H至5.5时死亡率降低了近5%,这说明Vp有一定的耐酸能力。考虑到食品风味的需求,适宜的p H范围确定为4.5~5.5。
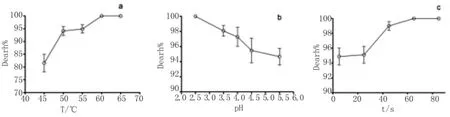
图1 单因素试验注:图1(a)、图1(b)、图1(c)分别为温度、p H、时间作为单因素对Vp 死亡率的影响。Fig.1 Single factor experimentNote:(a),(b),and(c)show the effects of single factor temperature,p H and time,respectively,on the death of Vp.
在不同作用时间分析了时间对Vp死亡率的影响对Vp死亡率的影响(图1c),曲线呈S型,在起始25 s内,死亡率仅增加了1%,在25 s至45 s,死亡率增加了近4%,65 s后死亡率接近100%。为了保证食品鲜度,尽可能选择较短作用时间,故选择5 s-25 s。
2.2 响应面分析法对控制条件的优化
2.2.1 模型建立及显著性检验
根据单因素试验结果,以温度(A)、时间(B)、p H(C)为自变量,以死亡率(y)为响应值,分析方案及实验结果见表2。
二次多项回归模型方程为:

对该模型进行方差分析,结果见表3,模型系数显著性检验见表4。由表3可以看出P<0.000 1,说明模型方程不同处理间的差异显著;失拟项P=0.1262>0.05,不显著;模型的校正决定系数R2Adj=96.73%,说明该模型能解释约96.73%响应值的变化,仅有总变异3.27%不能用此模型解释,相关系数R=99.28%,说明该模型拟合程度良好。表4回归方程系数显著性检验可知:模型一次项A(P<0.05)、C(P<0.05)显著;二次项 A2、C2显著;交互项不显著。

表2 响应面分析方案及实验结果Tab.2 Experimental design and results for response surface analysis

表3 回归模型方差分析Tab.3 Variance analysis of regression equation
2.2.2 响应曲面分析及优化 由上述结果得出,T和p H是对Vp死亡率影响最大的因素,其中以p H尤为重要。可以看出,随着温度的升高和p H的降低,死亡率也逐渐升高。当温度和p H分别在53.5℃~60℃和4.75~5.25的范围内时,死亡率最大。响应面软件给出的最优组合是:55.5℃、25 s、p H4.96,模型预测死亡率为97.36%。
2.3 最优条件的验证
2.3.1Vp死亡率 人工污染三文鱼,根据下面三组条件处理,比较死亡率。从上图3可以看出,70℃,25 s处理后死亡率达到76.09%,p H4.6,5 s处理后死亡率达到94.1%,而55.5℃,25 s与p H4.96联合处理后死亡率达到97.07%,这说明p H和温度的联合作用优于它们单独处理效果。

表4 回归方程系数显著性检验表Tab.4 Significance test for regression coefficients

图2 Vp的死亡率与个两因素的函数关系图和等高线图Fig.2 Response surface and contour plots for the effect of cross-interaction among two factors on death rate of Vibrio parahaemolyticus

图3 在三文鱼上验证Vp死亡率Fig.3 Death rate of Vp on salmon
2.3.2 鱼蛋白活性 Ca2+-ATPase活性单位,是在一定的条件下,以每分钟每毫克肌原纤维蛋白酶分解ATP所释放的磷酸根中磷微克分子量来计算(μmol Pi/min.mg pro.)。图4显示,与对照组相比,55.5 ℃、p H4.96、25 s处理后 Ca2+-ATPase活性差异不显著,而p H2,25 s和80℃,25 s处理后,Ca2+-ATPase活性显著降低。这说明55.5 ℃、p H4.96、25 s的处理条件从某种程度上可以保证鱼蛋白的活性。

图4 鱼蛋白活性的测定结果Fig.4 Ca2+ -ATPase activity of salmon
3 讨 论
作为某些天然成分的有机酸对人类无害,被列为食品添加剂。因为有机酸的抗菌效应,它还被应用于控制饲料原料和饲料保存中细菌的生长[6]。有机酸通过两种途径作用于微生物,一是p H的影响,二是其阴离子还具有独特的杀菌功能[7]。对于引起胃肠疾病的病原菌,Russell等人认为,有机酸的杀菌作用主要是由其阴离子引起的。无机酸作用不佳,可能在于不具有有机酸阴离子的类似作用[8]。有机酸的抗菌效果随着有机酸碳链的增长和不饱和度的增加而增强[9]。有人研究报道柠檬酸饮料对弧菌有强烈的抑制作用[10]。
目前,水产品鲜度的评价方法主要包括感官评价、微生物检验、化学检验、物理指标评价和鲜度指示蛋白评价等[11]。基于本研究的目的是要考察温度和酸性环境对鱼鲜度的影响,我们借鉴李来好[5]等人的关于鲻鱼蛋白质变性研究,选择鱼蛋白Ca2+-ATPase活性作为指标。鱼的肌动蛋白和肌动球蛋白切断ATP末端的磷酸基团产生ADP和Pi。通过比色测定,测定无机磷含量,可以表明ATPase活性。无机磷含量的测定采用钒钼酸铵法。
我们研究发现,70℃处理25 s时,Vp死亡率达到76.09%(降低了0.59-0.67个数量级),而55.5℃、p H4.96处理25 s,Vp死亡率达到97.73%(降低了1.34-1.92个数量级)。Castillo等人报道使用单独蒸汽灭菌效果明显不及乳酸和温度联合的蒸汽灭菌效果[12]。又有人研究也发现单独用p H 2.40乳酸处理15 s后肠炎沙门菌降低了0.70个数量级,但是当用p H 2.40乳酸、82℃、15 s处理后,降低了0.86~1.19个数量级[13]。Ikeda等人研究报道被单核细胞增生性李斯特菌人工污染的牛肉经过75℃,30 s处理和p H 2.40、55℃、30 s处理后,菌落数分别降低了1.4~2和1.8~2.6个数量级[14]。尽管这些研究条件有差异,但是它们和本研究一起证实了有机酸处理使较低温杀菌成为可能。而且本研究还进一步验证了建立的条件对鱼蛋白活性影响不显著。但是在实际应用中,鱼肉的大小和厚度会不会影响灭菌效果,而且Pohlman等人指出当使用多种抑菌处理手段时,处理的顺序是很重要的[15]。这需要后续试验完善。目前有研究报道3%NaCl相比于2%和1%NaCl使VpO3:K6对p H和温度环境的压力有很好的耐受力[16],说明盐度与Vp的耐酸机制有关。那么本研究中那些经过处理后近3%存活的Vp,是否也有什么保护机制存在,还不清楚,有待进一步探讨。
[1]Yuan BJ,Dai Y,Fu XM,et al.Surveillance on food-borne pathogens in Jiangsu province during 2008-2009[J].Jiangsu J Prev Med,2010,21(4):1-3.(in Chinese)
袁宝君,戴月,符晓梅等.江苏地区2008年-2009年食源性致病菌监测研究[J].江苏预防医学,2010,21(4):1-3.
[2]Su YC,Liu C.Vibrioparahaemolyticus:a concern of seafood safety[J].Food Microbiol,2007,24(6):549-558.DOI:10.1016/j.fm.2007.01.005
[3]Sun Y,Oliver JD.Antimicrobial action of some GRAS compounds againstVibriovulnificus[J].Food Addit Contam,1994,11(5):549-558.
[4]Andrews LS,Park DL,Chen YP.Low temperature pasteurization to reduce the risk ofVibrioinfections from raw shell-stock oysters[J].Food Addit Contam,2000,17(9):787-791.
[5]Li LH,Chen PJ,Li LD,et al.Protein denaturation ofMugil cephalusin refrigeration[J].J Fisheries China,2001,25(4):363-366.(in Chinese)
李来好,陈培基,李刘冬等.鲻在冷冻过程中蛋白质的变性[J].水产学报,2001,25(4):363-366.
[6]Li CL,Zhou AG,Wang ZS.Developments in anti-bacteria effects and its mechanism research[J].Feed Industry,2006,27(11):35-41.(in Chinese)
李成良,周安国,王之盛.有机酸的抗菌效应及其机制的研究进展[J].饲料工业,2006,27(11):35-41.
[7]Foster JW.When protons attack:microbial strategies of acid adaptation[J].Curr Opin Microbiol,1999,2(2):170-174.DOI:10.1016/S1369-5274(99)80030-7
[8]Russell JB.Another explanation for the toxicity of fermentation acids at low p H:anion accumulation versus uncoupling[J].J Appl Microbiol,1992,73(5):363-370.DOI:10.1111/j.1365-2672.1992.tb04990.x
[9]Foegeding PM,Busta FF.Chemical food preservatives[M].In:Disinfection,sterilization and preservation,Philadelphia:Lea &Febiger,1991:802-832.
[10]Tomotake H,Koga T,Yamato M,et al.Antibacterial activity of citrus fruit juices againstVibriospecies[J].J Nutr Sci Vitaminol(Tokyo),2006,52(2):157-160.DOI:10.3177/jnsv.52.157
[11]Li JR,Li TT,Li XP.Advances in methods for evaluating freshness of aquatic products[J].J Beijing Technol Business Univ(Nat Sci Ed),2010,28(6):1-8.(in Chinese)
励建荣,李婷婷,李学鹏.水产品鲜度品质评价方法研究进展[J].北京工商大学学报(自然科学版),2010,28(6):1-8.
[12]Castillo A,Lucia LM,Goodson KJ,et al.Decontamination of beef carcass surface tissue by steam vacuuming alone and combined with hot water and lactic acid sprays[J].J Food Prot,1999,62(2):146-151.
[13]Ozdemir H,Yildirim Y,Kuplulu O,et al.Effects of lactic acid and hot water treatments onSalmonellaTyphimuriumandListeriamonocytogeneson beef[J].Food Contr,2006,17:299-303.DOI:10.1016/j.foodcont.2004.11.003
[14]Ikeda JS,Samelis J,Kendall PA,et al.Acid adaptation does not promote survival or growth ofListeriamonocytogeneson fresh beef following acid and nonacid decontamination treatments[J].J Food Prot,2003,66(6):985-992.
[15]Pohlman FW,Stivarius MR,McElyea KS,et al.The effects of ozone,chlorine dioxide,cetylpyridinium chloride and trisodium phosphate as multiple antimicrobial interventions on microbiological,instrumental color,and sensory color and odor characteristics of ground beef[J].Meat Sci,2002,61(3):307-313.DOI:10.1016/S0309-1740(01)00198-X
[16]Whitaker WB,Parent MA,Naughton LM,et al.Modulation of responses ofVibrioparahaemolyticusO3:K6 to p H and temperature stresses by growth at different salt concentrations[J].Appl Environ Microbiol,2010,76(14):4720-4729.DOI:10.1128/AEM.00474-10

