赤芍对糖尿病肾病大鼠肾脏TNF-α、MCP-1、ICAM-1表达及巨噬细胞浸润的影响
郑亚萍,康红钰
(漯河医学高等专科学校,河南漯河 462002)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见且最严重的并发症之一,是糖尿病致残致死的重要原因。赤芍组成的方剂具有明显保肾疗效[1],但单方赤芍对糖尿病肾病的作用及相关机制尚少见报道。本研究通过观察赤芍对DN肾功能的影响及肾组织相应肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)、细胞间黏附因子-1(ICAM-1)和巨噬细胞ED-1表达变化,初步探讨赤芍对DN发生、发展的作用以及可能机制。
1 材料与方法
1.1 动物
体质量200~250g的雌性SD大鼠,由郑州大学医学院实验动物中心提供。
1.2 试剂
链脲佐霉素(STZ,Sigma公司产品),赤芍注射液(漯河医专分析测试中心),小鼠抗大鼠ED-1(巨噬细胞表面标志),单克隆抗体(美国 Santa Cruz公司),链酶亲和素-生物素复合物、DAB试剂盒(武汉博士德),RT-PCR试剂盒(大连宝生物工程有限公司)。
1.3 DN模型和分组
采用左肾摘除加高糖高脂饮食加小剂量STZ 30mg/kg腹腔注射制备糖尿病肾病模型,以注射72h后血糖高于16.7mmol/L,为 DN模型建立成功[2]。大鼠随机分为正常对照组(NC组)、糖尿病肾病组(DN组)、赤芍组腹腔注射30g/kg赤芍,正常对照组和糖尿病肾病组给予同剂量的生理盐水腹腔注射,每日1次,连续给药8周。
1.4 标本采集及处理
第8周末收集各组大鼠24h尿,离心后-20℃保存;动物麻醉称重,股动脉放血,离心后血清-80℃保存;取右肾去包膜后称重并于4%甲醛固定。
1.5 血尿素氮(BUN)、内生肌酐清除率(Ccr)及24h尿蛋白测定
用OLYMBUSAU-600全自动生化仪测测大鼠尿素氮、血肌酐,采用放免法测定24h尿微量蛋白含量。
1.6 RT-PCR 检测 TNF-α、MCP-1、ICAM-1 mRNA表达
按Trizol说明提取细胞 RNA,逆转录合成cDNA,为其以模板做PCR扩增。扩增片断引物TNF-α(203bp):5’-TTCTCATCCTGCTCGTGG-3’,5’-TTTGGTGGTTCGCCTCCT-3’;MCP-1(432bp):5’-GCCAGATCTCTCTTCCTCCA-3’;5’-GAGG TG GTTGTGGAAAAGAG-3’;ICAM-1:(413bp)5’-GG CG TCCATTTACACCTATTA-3’,5’-TTCCTTTTCTT CTCTTGCTTG-3’;内参基因 β-actin(141bp):5’-GACAGGATGCAGAAGGAGATTACT-3’,5’-AGAT CCACATCTGCTGGAAGGT-3’。PCR产物在10g/L琼脂糖凝胶(EB染色)电泳检测,以 Marker为分子大小标记,以与内参β-actin的 PCR扩增产物条带光密度之比作为反映 TNF-α、MCP-1、ICAM-1 mRNA水平的相对指标。
1.7 SABC法检测肾脏ED-1阳性细胞数
切片常规脱蜡水化,3%H2O2封闭内源性过氧化物酶,微波封闭内源性生物素;滴加1∶10正常羊血清或兔血清;10%小牛血清蛋白封闭非特异性抗原。滴加小鼠抗大鼠ED-1单克隆抗体(1∶50),4℃过夜。滴加生物素化二抗IgG(1∶200),37℃ 20min滴加SABC,37℃ 20min。洗涤后室温下滴加DAB显色液,镜下控制显色时间。中止反应后,苏木素复染3 min,1%盐酸乙醇分化。常规脱水、透明、封片。实验采用删除第一抗体作阴性对照。阳性物质呈棕色颗粒状,高倍镜视野下随机选择30个肾小球,计数每个肾小球横截面积(gcs)ED-1阳性细胞数,取均值。
1.8 统计学处理
采用SPSS 10.0统计软件,计量资料用均数±标准差(±s)表示,组间比较采用方差分析,P<0.05为有统计学意义。
2 结果
2.1 各组大鼠一般指标
表1显示,与对照组比较,DN组显著增加BUN、Ccr、24h尿微量蛋白及肾重/体质量(P< 0.01),赤芍可显著抑制糖尿病肾病大鼠的BUN、Scr、24h尿微量蛋白及肾重/体质量增加。
表1 各组DN大鼠BUN、Scr、24h尿微量蛋白及肾重/体质量(±s)
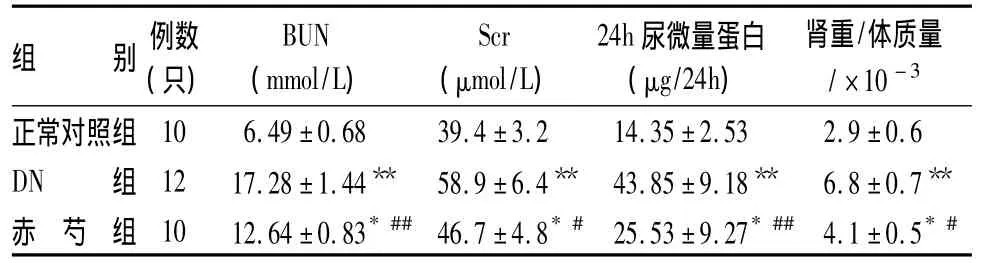
表1 各组DN大鼠BUN、Scr、24h尿微量蛋白及肾重/体质量(±s)
注:与正常对照组比较:*P <0.05,**P < 0.01;与DN组比较:#P < 0.05,##P <0.01
组 别 例数(只)BUN(mmol/L)Scr(μmol/L)24h尿微量蛋白(μg/24h)肾重/体质量/×10-3正常对照组10 6.49 ±0.68 39.4 ±3.2 14.35 ±2.53 2.9 ±0.6 DN 组 12 17.28 ±1.44** 58.9 ±6.4** 43.85 ±9.18** 6.8 ±0.7**赤 芍 组 10 12.64 ±0.83*## 46.7 ±4.8*# 25.53 ±9.27*## 4.1 ±0.5*#
2.2 各组大鼠肾脏 TNF-α、MCP-1、ICAM-1 mRNA表达
表2各组大鼠肾脏TNF-α、MCP-1、ICAM-1mRNA表达(±s)

表2各组大鼠肾脏TNF-α、MCP-1、ICAM-1mRNA表达(±s)
注:与正常对照组比较:*P < 0.05,**P < 0.01;与 DN组比较:#P <0.05,##P < 0.01
组 别 例数(只) TNF-αMCP-1 ICAM-1正常对照组10 0.56 ±0.11 0.89 ±0.15 1.08 ±0.16 DN 组 12 2.09 ±0.32** 1.93 ±0.38** 2.33 ±0.15**赤 芍 组 10 0.97 ±0.26*##1.25 ±0.19*## 1.35 ±0.13##
表2显示,与对照组比较,DN组 TNF-α、MCP-1、ICAM-1 mRNA表达显著增加(均P< 0.01),而赤芍抑制糖尿病肾病大鼠的TNF-α、MCP-1、ICAM-1 mRNA表达(图1~3)。
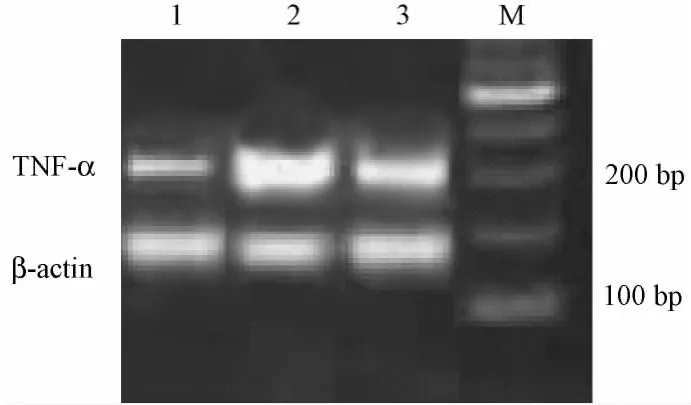
图1 各组大鼠肾脏TNF-αmRNA表达

图2 各组大鼠肾脏MCP-1mRNA表达
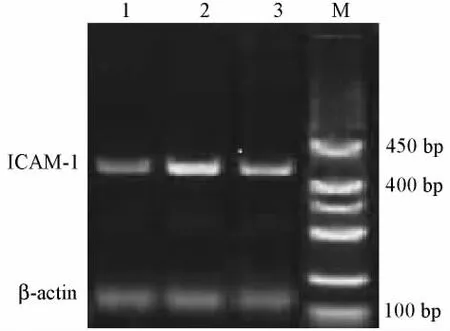
图3 各组大鼠肾脏ICAM-1mRNA表达
2.3 各组大鼠肾脏ED-1阳性细胞数
表3显示,DN组肾小球可见呈现褐色颗粒ED-1阳性表达的巨噬细胞显著较对照组增多(P<0.01)(图4),赤芍组可减少肾小球内褐色颗粒ED-1阳性表达的巨噬细胞浸润及增殖显著增加(P<0.01)。

图4 各组肾小球ED-1阳性表达(×400)
3 讨论
TNF-α是由激活的单核-巨噬细胞产生的小分子多肽,能发挥聚集巨噬细胞、刺激成纤维细胞增殖及胶原合成,在肾组织纤维化起重要作用。有研究显示,TNF-α 可通过上调 MCP-1及 ICAM 表达[2],进而促使巨噬细胞迁移至受累组织。本研究显示,链脲佐霉素腹腔注射制备的大鼠DN模型TNF-αmRNA表达及巨噬细胞浸润、增殖较对照组显著增加。
表3各组大鼠肾脏ED-1表达(±s)

表3各组大鼠肾脏ED-1表达(±s)
注:与正常对照组比较:*P <0.05,**P <0.01;与DN组比较:#P< 0.05,##P < 0.01
组别 例数(只) 肾小球(n·gcs-1)正 常 对 照 组10 0.91 ±0.53 DN 组 12 3.75 ±1.09**赤 芍 组 10 2.13 ±0.68*##
单核-巨噬细胞、肾小管细胞等可产生 MCP-1,MCP-1对单核巨噬细胞具有特异性趋化激活作用,且随后引发胶原 mRNA表达增加 ,这与肾小球纤维化密切相关[3,4]。敲除ICAM-1基因大鼠肾小球巨噬细胞浸润减少,Ⅳ胶原增生也下降[2,5],证实MCP-1、ICAM-1在糖尿病肾脏病中发挥关键作用。本实验也证实,链脲佐霉素所致的DN肾小球就有ICAM-1及MCP-1 mRNA的表达增加。
单核-巨噬细胞在肾小球和肾间质浸润是DN的特征性表现,肾组织中浸润的巨噬细胞在激活后产生损伤介质,巨噬细胞局部增殖与肾脏病理损害及肾功能衰退密切相关,对DN的发生发展起重要作用[6,7]。本动物实验也发现,糖尿病大鼠肾小球有大量ED-1表达的巨噬细胞浸润,且其浸润程度显著高于对照组大鼠,聚集的巨噬细胞产生各种细胞因子如TNF-α、ICAM-1及 MCP-1,进一步加速了肾组织纤维化。
赤芍能下调血脂、抑制血小板聚集及血栓形成,临床研究已有其组方治疗糖尿病肾病。我们先前研究表明,其能降低血脂、减少BUN、Scr及24h尿微量蛋白,发挥保护肾脏的作用。本研究在此基础上进一步探讨赤芍对DN保护作用机制,结果显示赤芍能通过抑制 TNF-α来减少肾组织 ICAM-1及MCP-1表达,进而减少肾组织巨噬细胞浸润及增殖,发挥抗纤维化作用从而产生对肾脏的保护作用。
[1]王秀霞,郑亚萍,王玉中.益肾排浊汤配合贝那普利治疗糖尿病肾病的临床研究[J].辽宁中医杂志,2009(6):56-58.
[2]秦贵军,岳欣阁,张贺,等.糖尿病大鼠肾小球IL-18、ICAM-1和TNF-α表达的实验研究[J].中国糖尿病杂志,2008(9):541-543.
[3]Tam F W,Riser B L,Meeran K,et al.Urinary monocyte chemoattractant protein-1(MCP-1)and connective tissue growth factor(CCN2)as prognostic markers for progression of diabetic nephropathy[J].Cytokine,2009,47(1):37-42.
[4]Malik A R,Little M A,Henriksson M,et al.Peritonitis,peritoneal inflammation and membrane permeability:a longitudinal study of dialysate and serum MCP-1 in stable patients on peritoneal dialysis[J].J Nephrol,2007,20(3):340-349.
[5]王兴木.血清 sICAM-1、Ⅳ-C检测与DM2肾病相关性分析[J].放射免疫学杂志,2007(1):47-48.
[6]Sheryanna A M,Smith J,Bhangal G,et al.Treatment with a cyclin-dependent kinase inhibitor, seliciclib, iseffective in reducing glomerular macrophage numbers and the severity of established experimentalglomerulonephritis[J]. Nephrology(Carlton),2011,16(4):410-416.
[7]Behmoaras J,Smith J,D’Souza Z,et al.Genetic loci modulate macrophage activity and glomerulardamagein experimental glomerulonephritis[J].J Am Soc Nephrol,2010,21(7):1136-1144.

