黄芪桂枝五物汤对STZ诱发糖尿病大鼠周围神经保护作用
齐 峰,邱昌龙,朱 亮,赵 舒,杨小溪
(河北联合大学中医学院,河北唐山 063000)
糖尿病累及周围神经系统可产生糖尿病周围神经病变(Diabetic Peripheral Neuropathy DPN),而且可随病程的延长而加重,是糖尿病致残、致死的主要原因之一[1]。黄芪桂枝五物汤是我们临床常用的治疗DPN基本处方之一,且近年来因其疗效确切而屡见报道[2~5]。为进一步探明其作用效果和机制,我们开展了如下研究。
1 材料与方法
1.1 动物
8周龄健康雄性Wistar大鼠,体质量200~220g(SCXK(京)2011-0005),由河北联合大学实验动物中心代购。
1.2 药物
黄芪桂枝五物汤:黄芪15g,桂枝 15g,白芍15g,生姜30g,大枣4枚(15g)组成,成人每日处方生药量为 90g。药材加水 300ml,浸泡 30min,煎30min,二煎加水200ml,煎20min,将2次煎汁混匀,水浴浓缩为165%(1ml含1.65g生药)的药液,4℃保存备用。所需药材从北京同仁堂唐山分部一次性购买;弥可保片(080626)500ug/,日本卫材(中国)药物有限公司。
2.2 主要试剂和仪器
链脲佐菌素(STZ):sigma公司产品(lg/瓶,批号S0130);NGF(免疫组化试剂盒),北京博奥森生物科技公司;JT502N电子天平:上海伦捷;SZ-97自动三重纯水蒸馏器:上海亚荣生化仪器厂。
1.3 溶液配置
柠檬酸钠-柠檬酸缓冲液(pH值4.2~4.5)的配置:取2.1g柠檬酸加入双蒸水100ml配成A液,取2.94g柠檬酸钠加入双蒸水100ml配成B液。用时将A、B液按1∶1.32比例混合,pH计测定pH值,调节pH=4.2~4.5,即是所需配置STZ的柠檬酸钠-柠檬酸缓冲液,现配现用。
1.4 实验方法
1.4.1 动物造模与分组 选取8周龄健康雄性Wisart大鼠,体质量200~220g,自然光线,不限制饮水,适应性喂养l周后禁食12h,将链脲佐菌素用0.1mmol/L柠檬酸钠-柠檬酸缓冲液(pH4.2,4℃)避光条件下配成1%浓度溶液,按50mg/kg剂量左下腹腔内单次注射,72h后尾静脉取血测血糖,凡血糖≥16.7mmol/L作为糖尿病大鼠。将50只糖尿病大鼠随机分为模型组(A)、弥可保组(B)、黄芪桂枝五物汤低(C)、中(D)、高剂量组(E)5组。5组动物的血糖水平在研究基础上一致,差异无统计学意义(P>0.05)。另取10只同批无差异大鼠作为正常对照组(F)。
1.4.2 给药方法 模型复制1周后,加味黄芪桂枝五物汤低、中、高剂量组分别按4.5g/kg、9 g/kg、12.5g/kg剂量灌胃给药,正常组和模型组灌服等容积的蒸馏水,弥可保组按375ug/kg灌胃,灌胃每日1次,连续8周给药后取标本进行检测。所需药液用蒸馏水定期配制,4℃冰箱保存,大鼠实验期间按组分笼饲养,标准饲料自由摄食、饮水。
1.4.3 检测指标及方法
1.4.4 坐骨神经传导速度检测 第8周治疗结束后,以戊巴比妥钠30mg/kg腹腔注射麻醉动物,在麻醉状态下经十六导电生理仪检测大鼠坐骨神经运动传导速度(MNCV)[6]。用2个电极针经皮插入,第一刺激部位在坐骨窝,第二刺激部位在踝部,电极间距为2mm,接地于尾部,用方形波(10~20mA,40us脉波宽)刺激坐骨神经,用2个针电极在同侧的足部骨间肌记录复合肌肉动作电位。记录3对不同的M波潜伏期取其平均值,近端和远端的潜伏期差值作为运动神经在2个刺激部位间的传导时间,再测量出2个刺激部位间的距离。根据公式计算MNCV(m/s)=距离/潜伏期差值,同样方法检测大鼠坐骨神经感觉传导速度:(SNCV)=距离/潜伏期差值。
1.4.5 大鼠NGF表达 上述步骤完成后,大鼠在麻醉状态下迅速剥离大脑海马组织,置于4%的多聚甲醛固定液中固定。常规石蜡包埋、切片,以75%明胶处理过的载玻片接片,60℃烘片30min备用。所有步骤严格按照免疫组化试剂盒说明进行操作,图片分析采用HPIAS-1000高清晰彩色病理图文分析系统进行图像分析。每鼠取切片5张,400倍镜下检测各片的平均光密度值并计算 density值,分别测定后累加取其平均值,即为density值。终值单位为像素点,检测场面积为15万个像素点。
2 统计学方法
选用SPSS 17.0 for windows统计软件进行统计分析,各项实验数据以均数±标准差(±s)表示,各组间样本均数比较采用单因素方差分析,组间比较采用q检验。
3 结果
3.1 一般情况
实验期间,正常组大鼠精神状态良好,动作自如,毛色光泽。其余各组大鼠均出现多饮、多食、多尿、消瘦,皮毛污秽无光泽,精神萎靡,蜷卧拱背、后肢活动不灵活甚至痿废不用等现象。实验过程中模型组大鼠于第3周死亡2只,经解剖死于巨结肠,黄芪桂枝五物汤低剂量组1只于实验第1周死于灌胃不当,其余组别大鼠未见死亡。
3.2 坐骨神经传导速度
表1显示,模型组大鼠坐骨神经传导速度表达明显低于其他各组,提示周围神经病变明显,各治疗组与模型组比较差异均有统计学意义(P<0.01或0.001),提示药物干预具有不同提高坐骨神经传导速度作用,其强弱顺序为F组>E组>D组>C组>B组。
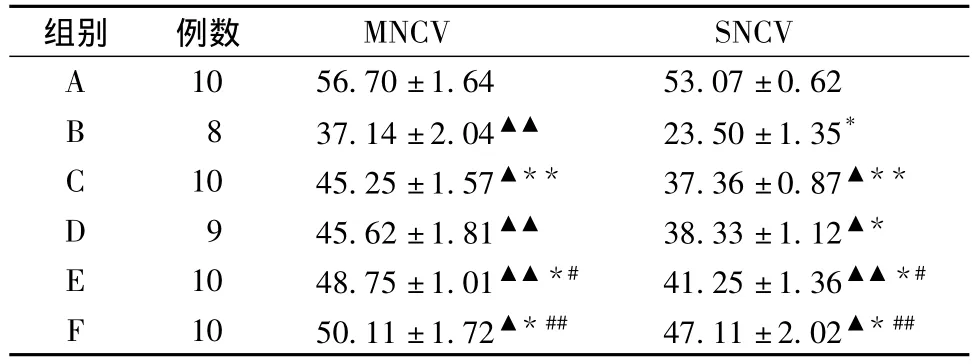
表1 药物干预8周后不同组别坐骨神经传导速度
3.3 神经生长因子的表达
表2图1显示,模型组大鼠NGF表达明显低于其他各组,各治疗组与模型组比较差异均有统计学意义(P<0.01或0.001),提示药物干预具有不同促进NGF表达的作用,其强弱顺序为F组>E组>D组>C组>B组。

表2 药物干预8周后不同组别神经生长因子的表达
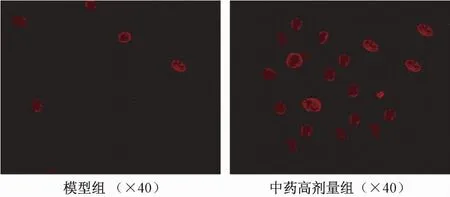
图1 光镜下神经生长因子比较
4 讨论
目前国内外广泛认可的使用链脉佐菌素(STZ)制备糖尿病动物模型(血糖值大于16.65mmo1/L作为糖尿病大鼠空腹或非空腹的成模标准)[7],因其同时具备了人类糖尿病性周围神经病变的特点[8],从而被广泛地应用于DPN的实验研究之中。坐骨神经传导速度降低是糖尿病大鼠模型的周围神经病变特点之一[9]。DPN时,神经功能的改变先于并伴随神经解剖的损害,因而神经电生理检查作为早期诊断DPN的敏感指标被大家认可;临床上许多DPN患者在出现运动、感觉障碍之前就有明显的神经传导速度减慢[10]现象,神经传导速度减慢被看做是糖尿病性神经病变发生的先兆之一,这也是该项检测成为目前评价糖尿病患者神经功能最常用指标的原因;神经生长因子(NGF)是最先发现的细胞生长调节因子,NGF是交感神经元、感觉神经元和中枢部分胆碱能神经元生长、发育、存活、维持功能所必需的营养因子,其生物学活性主要是维持交感神经和感觉神经的功能,能诱导神经递质的合成、蛋白磷酸化、甲基化以及类似ras蛋白的基因表达所需酶的合成,能有选择地营养交感神经节神经元和周围神经系统的小纤维感觉神经元。已有实验证明,无论是糖尿病动物模型还是糖尿病神经病变患者,其组织或血中的NGF水平均明显降低[11-12]。本次实验观察到,模型组大鼠坐骨神经传导速度明显降低,神经生长因子表达明显下调,与正常对照组比较差异有极显著统计学意义(P<0.01),提示模型组大鼠具备DPN的特点。
目前,西医针对DPN缺乏理想的治疗方法[13],中医学从整体出发,调理阴阳,对于该病复杂病理机制,中药复方的作用呈现出多途径、多靶点和多系统的特点,尤其是在改善患者症状、提高生活质量及远期疗效上显示了独特的优势,是单靶点和单系统化学合成药不可比拟的。因此,充分发挥中医药简便效廉的特点,开发有效中药复方,对解决DPN这一临床难题是切实可行的。黄芪桂枝五物汤出自《金匮要略》:“血痹,阴阳俱微,寸口关上微,尺中小紧,外证身体不仁,如风痹状,黄芪桂枝五物汤主之。”方中黄芪为君药,甘温益气固表;桂枝散风寒而温经通痹;芍药养血和营而通血痹,与桂枝合用,调和营卫而和表里,两药为臣;生姜辛温,疏散风邪,以助桂枝之力;大枣甘温,养血益气以资黄芪、芍药之功,两药为佐使,5味药物配伍精当,共奏养血祛风、益气通络、调和营卫之功。临床之中以身体外周痛、痒、麻木为该方的使用要点,这正与糖尿病周围神经病变的常见表现相类似,都反映了营卫气血不足、风寒闭阻经络这一核心病机,因此针对这一核心病机的黄芪桂枝五物汤可作为临床治疗DPN的基本方。本次实验观察到,弥可保组较模型组大鼠神经传导速度和NGF表达差异均有统计学意义(P<0.05),说明弥可保对实验性糖尿病鼠周围神经损害有一定的防治作用,这与以往文献报道一致[13]。但我们同时观察到,黄芪桂枝五物汤高、中、低剂量组亦有效提高糖尿病大鼠神经传导速度,并上调NGF的表达,与模型组和弥可保组比较,差异皆有统计学意义(P<0.05或0.01),显示黄芪桂枝五物汤对糖尿病大鼠周围神经功能有明显改善作用,其作用与剂量成正比,上调NGF的表达可能是其作用机制之一。
[1]Laslie Rd.United Kingdorn Prospective.Diabeters study(UKPDS).WHAT now or so what?[J].Diabetes Metab Res Rev,2003,15:65.
[2]刘建农,邓蓉燕,彭乃群.加味黄芪桂枝五物汤治疗糖尿病周围神经病变38 例[J].时珍国医国药,2006,17(9):1755.
[3]舒长兴.黄芪桂枝五物汤加减治疗糖尿病周围神经病变34例[J].江西中医药,2007,38(9):24.
[4]憨兰.黄芪桂枝五物汤加减治疗糖尿病周围神经病变24例[J].甘肃中医,2008,21(2):8.
[5]高岑,宋俊生,薛晓焕,等.黄芪桂枝五物汤与西药治疗糖尿病周围神经病变疗效比较的系统评价[J].辽宁中医杂志,2012,39(6):993-994.
[6]Kalichm an M W,D ines KC,Bobik M,et al.Nerve conduction velocity,laser Doppler flow,and axonalcaliber in galactose and streptozocin[J].Brain Res,1998,810(1-2):130-1376.
[7]Hensley K,Folyd RA.Reactive oxygen species and protein oxidation in aging:a look back[J].Biochem Biophys,2002,397(2):377-383.
[8]Coppey LJ,Davidson EP,Dunlap JA,et al.Yorek MA.Slowing of motor nerve condu-ction velocity in streptozotocin-induced diabetic rats is preceded by impaired vasodilation in arterioles that overlie the sciatic nerve[J].Int J Exp Diabetes Res,2000,1(2):131-143.
[9]刘立新,刘好文,刘力强,等.实验性2型糖尿病大鼠模型及其周围神经病变特点[J].脑与神经疾病杂志,2005,13(2):117-118.
[10]Sekido H,Suzuki T,Jomori,T,et al.Reduced cell replication and induction of apoptosis by advanced glycation end products in rats Schwann cells[J].Biochem Biophys Res Commun,2004,320(1):241-248.
[11]Hellweg H,Hariung HD.Endogenous levels of nerve growth factor(NGF)are altered in experimental diabetes mellitus:a possible role for NGF in the Pathogenesis of diabetic neuropathy[J].Joumal of Neurosciene Research,1990,26:258.
[12]FaradjiV,Sotelo J.Lower serum levels of nerve growth factor in diabetic neuropathy[J].Acta-Neurol Scand,1990,81:402.
[13]Smith AG,Singleton JR.Diabetic neuropathy[J].Continuum(Minneapolis Minn),2012 ,18(1):60-84.
[14]张蜀平,陆菊明,潘长玉,等.弥可保对糖尿病周围神经病变治疗作用的实验研究[J].中华内分泌杂志,1998,14,(2):130-131.

