去泛素化酶7与髓样分化因子88蛋白相互作用的研究
战飞翔,常静,马立新,周玉玲
(湖北大学生命科学学院,湖北 武汉430062)
0 引言
Toll-like受体(TLRs)是一类跨膜受体,它能识别各种病原微生物,激活机体的天然免疫反应并诱导特异性免疫响应,在动物先天免疫系统识别和响应病原微生物的入侵方面起着至关重要的作用.作为TLR信号途径重要的衔接分子,在宿主的固有免疫和炎症反应中扮演着重要角色的髓样分化因子88(MyD88)成为了TLR信号传导途径主要调控点[1-2].现有的研究结果表明,泛素化和去泛素化等可以参与调控TLR途径衔接分子MyD88的表达,干预TLR途径信号传递,但泛素化和去泛素化如何参与MyD88活性的调控还知之甚少[3-4].
MyD88是NF-κB途径中的重要接头分子,很多研究一直把调控MyD88活性的问题作为控制信号通路参与的重要问题来研究.本研究通过大规模酵母双杂交列阵筛选得到了10多对与TLR信号途径相关的潜在的新的人源蛋白质相互作用对,其中MyD88与SPOP的相互作用引起了我们的关注.有研究发现3种新的含有TRAF结构域的蛋白包括SPOP和USP7,他们通过TRAF结构域自我结合或与其他蛋白结合,调控细胞信号通路[5].USP和SPOP都含有TRAF结构域,USP7是否也能通过TRAF结构域与TLR4途径中MyD88相互作用,从而调控TLR信号通路?为了验证MyD88与USP7的相互作用,我们通过免疫共沉淀和免疫共定位等实验验证了这两种蛋白质存在相互作用.这些工作的展开必将拓展我们对USP7所行使的生理功能的认识,确定这种相互作用会对TLR信号通路产生何种影响,从而为筛选抗肿瘤和炎症药物提供理论支持.
1 材料和方法
1.1 菌株和质粒 pcDNA3.1-Myc-MyD88;pcDNA3.1-Myc-USP7;pcDNA3.1-Flag-USP7;pcDNA3.1-Flag-MyD8;pkozak-USP7-eGFP;pkozak-MyD88-DsRed本实验室构建;Monoclonal anti-c-Myc购自Sigma公司;HELA细胞,HEK293T细胞购于武汉大学菌种典藏中心.
1.2 免疫共沉淀 用pcDNA3.1-Myc-MyD88和pcDNA3.1-Flag-USP7一起转染HEK293T细胞36h后,离心去掉培养基后,加入0.5mL预冷的细胞裂解液,并于4℃放置30min,离心后转到小离心管中.每0.5mL总蛋白中加入20μL Protein G sepharose beads,4℃摇晃2h以去除非特异性杂蛋白,降低背景.4℃,3 600r/min离心5min,将上清转移到一个新的小离心管中,去除Protein G sepharose beads.加入一定体积的1∶100稀释的特异抗体到500μL总蛋白中,4℃缓慢摇动抗原抗体混合4h.3 600r/min瞬时离心5min,收集琼脂糖珠-抗原抗体复合物,去上清,加入预冷的细胞裂解液500μL洗涤3次.加入2×SDS-PAGE上样缓冲液[5],100℃加热5min后,离心收集上清溶液,然后用SDS-PAGE电泳[6].
1.3 荧光共定位 用pcDNA3.1-eGFP-USP7和pcDNA31-DsRed-MyD88载体转染HEK293T细胞36h后,吸去培养基,PBS洗涤干净后加入4%甲醛固定20min,冲洗后加入0.1%Triton-X100,覆盖10min.洗涤后加入染色液,避光静置20min,然后取干净的载玻片,滴1滴水溶性封片剂,然后盖玻片上贴有细胞的一面贴上即可于荧光显微镜下观察.
1.4 间接免疫荧光 取适量细胞于NaOH处理过的盖玻片上,使单层细胞铺至60%培养面积,分别共转和单转待检测的质粒.24h后,弃去培养液,用PBS洗涤盖玻片,加入2mL 4%甲醛,室温固定约30 min.用PBS静置洗涤3次后,于六孔板相应空中加入含0.2%TritonX-100、1%BSA的PBS约1mL,冰上静置5min,然后于六孔板相应空中加入1mL含1%BSA的PBS,室温封闭1h,然后用PBS洗涤,重复3次.吸干PBS后,按1∶50~1∶100比例加入适当浓度稀释的一抗于六孔板相应孔中,室温,避光,静置2~3h.PBS洗涤3次后,加入用1%BSA的PBS稀释的荧光二抗至4mg/mL(约1∶100),室温,避光,静置1~1.5h.荧光显微镜或激光共聚焦显微镜检测相应荧光.
2 结果
2.1 免疫共沉淀证明USP7与MyD88间的相互作用 哺乳动物表达质粒pcDNA3.1-Myc-MyD88单独转染HEK293T细胞中,并把pcDNA3.1-Myc-MyD88和pcDNA3.1-Flag-USP7共同转染至HEK293T细胞中.培养36h后,我们以表达目的蛋白的HEK293T细胞进行免疫共沉淀实验,以anti-Myc或anti-Flag抗体沉淀免疫复合物,沉淀经Western印迹检测.如图1所示,在共表达USP7与MyD88的细胞裂解物中,以anti-Flag抗体于免疫复合物中可检测到MyD88蛋白的存在,在单独表达USP7的细胞裂解物中,以anti-Flag抗体于免疫复合物中未检测到MyD88蛋白的存在.这一结果表明,USP7与MyD88在哺乳动物细胞中可发生特异性相互作用.
2.2 USP7与MyD88共定位于细胞质中 细胞内蛋白质间空间位置的一致性是蛋白质间相互作用的一种重要提示,也是它们发生相互作用的一种表现形式,为了更充分验证USP7与MyD88在哺乳动物细胞中的相互作用,我们对两种蛋白质在HEK293T细胞中的亚细胞定位进行了检测.将哺乳动物表达质粒pcDNA3.1-eGFP-USP7和pcDNA3.1-DsRed-MyD88共同转染至HEK293T细胞中,转染24h后,于激光共聚焦显微镜下观察荧光在细胞中的分布.结果(图2)显示当共同转染这两种表达质粒至HEK293T细胞中时,可观察到绿色荧光和红色荧光以重叠形式分布于细胞质中,表明USP7与MyD88两种蛋白可共定位于细胞质中,在空间上具有相互作用的可能性.
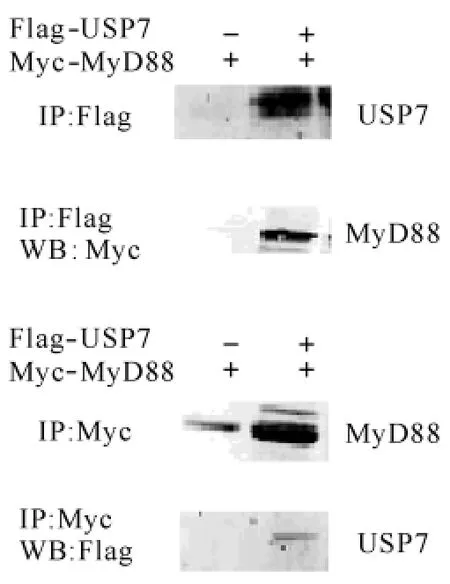
图1 免疫共沉淀
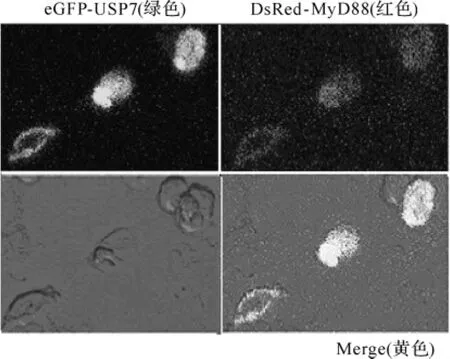
图2 免疫荧光共定位
2.3 间接免疫荧光共定位 为了更进一步检测USP7与MyD88在细胞质内发生相互作用,将pcDNA3.1-Myc-MyD88 和 pcDNA3.1-Flag-USP7 共同转染至HELA细胞中,转染24h后,加入荧光抗体,于激光共聚焦显微镜下观察荧光在细胞中的分布.结果(图3)显示当共同转染这两种表达质粒至HELA细胞中时,可观察到绿色荧光和红色荧光以重叠形式分布于细胞质中,表明USP7与MyD88蛋白可共定位于细胞质中.

图3 间接免疫荧光共定位
3 讨论
MyD88是TLRs途径中的重要接头分子,许多研究一直把调控MyD88活性的问题作为控制信号通路参与的重要问题来研究,而USP7是p53信号通路中的重要调控蛋白,主要定位在细胞核内[7].有研究表明在病毒和LPS等免疫刺激因子的刺激下,有部分USP7从细胞核内转移至细胞质,与NF-κB和JNK途径上的TRAF6和IKKγ结合并去泛素化,从而终止TLR免疫反应[8].
本研究利用荧光共定位,间接免疫荧光和免疫共沉淀等方法分别从不同角度验证了MyD88和USP7这对蛋白质相互作用的真实性.通过荧光共定位和间接免疫荧光实验,可清楚看到MyD88和USP7定位在细胞质,表明这两种蛋白在空间上具有相互作用的可能性.免疫共沉淀实验中MyD88和USP7可以被抗体同时沉淀下来,而空载对照没有,则表明MyD88与USP7可以在生理上发生相互作用.MyD88和USP7相互作用的确定对了解TLR信号通路的机制具有重要作用,因此,我们希望在进一步的的研究中阐明USP7与MyD88的相互作用是否介导MyD88去泛素化以及这种相互作用对TLR信号通路的影响机制.
[1]Lang T,Mansell A.The negative regulation of Toll-like receptor and associated pathways[J].Immunol Cell Biol,2007,85(6):425-434.
[2]Liew F Y,Xu D,Brint E K,et al.Negative regulation of toll-like receptor-mediated immune responses[J].Nat Rev Immunol,2005,5(6):446-458.
[3]王素霞,刘媛,吴慧娟,等.去泛素化酶的研究及其进展[J].临床与实验病理学杂志,2008,24(6):734-737.
[4]李跃华,哈团柱,陈琪,等.MyD88依赖性核因子-κB信号途径在心肌肥大发生过程中的调控作用[J].中华医学杂志,2005,85(4):262-272.
[5]Zapata J M,Pawlowski K,Haas E,et al.A diverse family of proteins containing tumor necrosis factor receptorassociated factor domains[J].J Biol Chem,2001,276,26:24242-24252.
[6]Li Chunhua,Ma Lixin,Chen Xinwen.Interferon regulatory factor 3-CL,an isoform of IRF3,antagonizes activity of IRF3[J].Cell Mol Immunol,2011(8):67-74.
[7]Wullaert A,Heyninck K,Janssens S,et al.Ubiquitin:tool and target for intracellular NF-kappaB inhibitors[J].Trends Immunol,2006,27(11):533-540.
[8]Daubeuf S,Singh D,Tan Y H,et al.HSV ICP0recruits USP7to modulate TLR-mediated innate response[J].Blood,2009,113(14):3264-3275.

