重组人促红细胞生成素早期治疗新生儿缺氧缺血性脑损伤疗效观察
王 艺 亢相逢 宋博今 李志洁
郑州大学第二附属医院 郑州 450014
1 资料和方法
1.1 一般资料 选取2011-01—2012-06郑州大学第二临床学院NICU科收治的中、重度HIBD患儿共86例,入选标准:(1)入院时日龄不超过72h;(2)37周≤胎龄≤42周,出生体质量≥2.5kg;(3)头颅CT结果符合新生儿中、重度脑损伤的表现;(4)且有下列情况之一:①生后的Apgar评分1 min≤4分、5min≤7分;②脐静脉血或生后60min的动脉血标本pH≤7.1;③出生12h内出现脑损伤的临床表现、无严重的先天性异常或大量颅内出血等并发症。全部入选病例随机分为2组,治疗组44例在常规治疗的基础上加用rhEPO,对照组42例常规治疗。所有病例均需患儿家属知情,并签署知情同意书。2组患儿的性别、胎龄、出生体质量、生后的Apgar评分及病情程度(临床分型均系中、重度脑损伤),差异均无统计学意义(P>0.05)。
1.2 治疗方法 2组患儿均按新生儿缺氧缺血性脑损伤的常规治疗方案(控制惊厥、维持水电解质平衡、营养脑神经药物应用等综合治疗)进行[1];治疗组在常规治疗基础上,于入院后24h内加用rhEPO(沈阳三生制药股份有限公司,国药准字:S19980074)250U/kg静脉注射,隔日1次,总疗程均为15d。
1.3 疗效评价 (1)新生儿行为神经测定(NBNA)[2]:由固定的专业医师分别于生后7d、14d、28d进行新生儿行为神经测定(NBNA);(2)婴幼儿智能发育评估(CDCC)[3]:包括智力发育指数(MDI)和心理运动发育指数(PDl),由固定的专业人员分别对出生后6个月的患儿进行双盲评估;(3)新生儿头颅CT复查均在出生后30d时进行;(4)随访6个月。
1.4 统计学方法 采用SPSS 12.0统计软件进行数据分析,计量资料以±s表示,两样本均数比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 头颅CT检查 治疗前2组患儿头颅CT均符合中、重度缺氧缺血性脑损伤影像学改变;治疗后,对照组头颅CT正常12例(28.6%),异常30例(71.4%)(CT表现脑白质密度减低),治疗组正常29例(65.9%),异常15例(34.1%)。2组正常比率比较差异有统计学意义(χ2=4.17,P<0.05)。
2.2 2组患儿生后7d、14d、28dNBNA评分比较 见表1。

表1 2组缺氧缺血性脑损伤新生儿生后7d、14d、28dNBNA评分 (x¯±s)
2.3 2组出生后12个月MDI和PDI结果比较 见表2。
表2 2组缺氧缺血性脑损伤新生儿出生6个月MDI和PDI的结果 (±s)
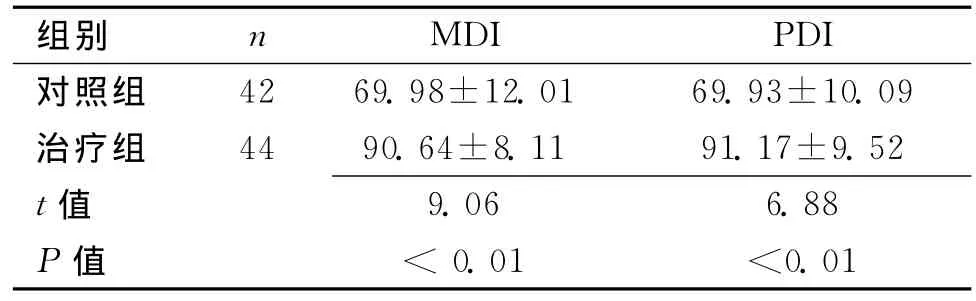
表2 2组缺氧缺血性脑损伤新生儿出生6个月MDI和PDI的结果 (±s)
组别 n MDI PDI对照组42 69.98±12.01 69.93±10.09治疗组 44 90.64±8.11 91.17±9.52 t 值9.06 6.88 P值 <0.01 <0.01
2.4 随访情况 在随访期6个月内,治疗组死亡1例,失访2例,无明显的运动发育异常,预后较为理想;对照组死亡2例,失访2例,5例运动发育异常,预后较不良。
3 讨论
HIBD是指由于各种围生期窒息所引起的部分或完全性脑缺氧、脑血流量减少或暂停所导致的胎儿或新生儿脑损伤,是引起新生儿急性死亡和慢性神经系统损伤的主要原因之一。缺血再灌注损伤、细胞内钙超载、兴奋性氨基酸的神经毒性作用及神经细胞凋亡等是HIBD的主要发病机制[4],脑实质及结构有可塑性,节后再生功能,损伤脑的再生能力可以通过早期的综合治疗,使其得到重塑和修复,并能使神经运动的发育接近或达到正常的儿童。
促红细胞生成素是一种分子量为34kDa的糖蛋白,最初是由肾脏中分离出来的一种细胞因子,能刺激前体红细胞增生和分化,最初应用于慢性肾性贫血及早产儿贫血的防治。Rees等[5]在由内毒素脂多糖(inpopolysaccharide,LPS)引起早产的绵羊脑损伤模型中研究发现,LPS可导致胎儿血氧饱和度不足、血压过低、脑白质损伤、皮质脊髓束中的髓鞘化少突胶质细胞的数量减少,以及视神经中髓鞘的数量减少。实验结果显示,经rhEPO处理后,可减少脑实质损伤,并有利于皮质脊髓束和视神经髓鞘的形成。近年来的研究发现,EPO及其受体(EPO-R)在正常脑组织中均有低水平的表达,在缺氧缺血的刺激下表达增加,并证实EPO具有神经营养及神经保护作用[6]。
本文结果显示,早期应用rhEPO的中、重度缺氧缺血性脑损伤患儿头颅CT表现正常的增多、异常的减少,NBNA、MDI和PDI的评分均增高,提示早期应用rhEPO干预能明显改善中、重度缺氧缺血性脑损伤患儿脑部的结构及近期和远期的功能,且6个月后的随访较为理想,智力低下、脑性瘫痪等后遗症明显减少。表明rhEPO治疗能改善HIBD患儿的神经系统预后,是中、重度HIBD治疗较理想的方法。
虽然重组人促红细胞生成素(rhEPO)疗法可改善缺氧缺血性脑损伤的预后,但rhEPO并不能完全逆转缺氧缺血所致的脑损伤。大剂量的rhEPO在治疗新生儿脑损伤上可能存在一些并发症,尤其是极低出生体质量,如颅内出血、早产儿视网膜病(retinopathy of prematurity,ROP)、坏死性小肠结肠炎、慢性肺部疾病或迟发型败血症等[7-9],需进一步研究有无对抗rhEPO治疗HIBD所带来的不良反应的方法。
[1]金汉珍,黄德珉,官希吉 .实用新生儿学,3版[M].北京:人民卫生出版社 .2003:766-771.
[2]金汉珍,黄德珉,官希吉 .实用新生儿学[M].3版 .北京:人民卫生出版社,2003:57-60.
[3]范存仁 .婴幼儿智能发育测验手册[M].北京:团结出版社,1998:107-140.
[4]Thompson CM,Puterman AS,Linley LL,et al.The value of scoring sys-tern for hypoxic ischemic encephaloplathy in predicting neurodevelop-mental outcome[J].Acts Paediatr,1997,86(7):757-761.
[5]肖梅 .新生儿缺氧缺血性脑病的诊治进展及相关问题[J].临床儿科杂志,2007,25(3):179-182.
[6]Rees S,Hale N,De Matteo R,et al.Erythropoietin is neuroprotective in a preterm ovine model of endotoxin-induced brain injury[J].J Neuropathol Exp Neurol,2010,69(3):306-19.
[7]Siren AL,Knerlich F,Poser W,et al.Erythropoietin and erythropoietin receptor in human ischemic/hypoxic brain[J].Acta Neuropathol Berl,2001,101(3):271-276.
[8]Figueras-Aloy J,Alvarez-Domfnguez E,Morales-Ballus M,et al.Early administration of erythropoietin in the extreme premature,a risk factor for retinopathy of prematurity[J].An Pediatr Bare,2010,73(6):327-333.
[9]Brown MS,Baron AE,France EK,et al.Association between higher cumulative doses of recombinant erythropoietin and risk for retinopathy of prematurity[J].J AAPOS,2006,10(2):143-149.

